
37. Объяснение 1:
Первоначальные температуры азота и аргона найдем из уравнения Менделеева-Клайперона:
![]()
![]() где
1=m1/1=
50 моль и 2=m2/2=
30 моль - количество молей азота и аргона.
где
1=m1/1=
50 моль и 2=m2/2=
30 моль - количество молей азота и аргона.
Температура смеси Т, установившаяся после открытия вентиля, определяется из 1-ого закона термодинамики - внутренняя энергия системы при смешивании газов остается неизменной (теплообмен с окружающими телами отсутствует, система работы не совершает): 1С1(Т - Т1) - 2С2(Т2 - Т) = 0, откуда
![]() Установившееся
давление найдем из уравнения газового
состояния смеси:
Ответ
Установившееся
давление найдем из уравнения газового
состояния смеси:
Ответ![]()
Объяснение 2: После открытия вентиля происходит процесс перемешивания газов, в результате которого в баллонах установятся одинаковое давление ро и темпереатура То. Давление смеси газов (по закону Дальтона) определяется суммой парциальных давлений компонентов, a температура смеси определяется законом сохранения внутренней энергии системы. Таким образом, имели po=p1+p2, где p1=(RT1)/V1, p2 =(RT2)/V2 и Uo=U1+U2, где U1=C1T1, U2 = С2T2.
![]()
![]() где
m1/=m2-
число молей азота и аргона соответственно.
Начальные температуры газов Т1
и Т2
найдем из уравнений состояний:
где
m1/=m2-
число молей азота и аргона соответственно.
Начальные температуры газов Т1
и Т2
найдем из уравнений состояний:
![]() Тогда
окончательно получаем
Тогда
окончательно получаем
Ответ:
![]()
![]()
38.
![]()
39.
![]()
40.
![]()
41. р = роТ1Т2 ( V1 + V2 ) .
То( V1T2 + V2T1 )
42. p = ( p1V1 + p2V2 )/ ( V1 + V2 ) = 3 Па.
43.
![]()
44. T=-2A / (3R)= - 100 К.
45. A=RT(n - 1)/n .
46. A=pV1(T2-T1)/T1 = 136,5 Дж (р=105Па).
47. Q = cTо = 8000 Дж ( 32*10-3 кг/моль - молярная масса кислорода).
48. Ответ:
![]()
Методические указания:
 pпоршня
= ( mпg )/
S; pпоршн.+гр
= (( mп
+mгр
)g)/ S.
pпоршня
= ( mпg )/
S; pпоршн.+гр
= (( mп
+mгр
)g)/ S.
Из уравнения Менделеева- Клайперона
![]()

50. A = pV(T2/T1 - 1) = 300 Дж.
51. Q = 5/2V1(p2 - p1).
52. A = ( n - 1 ) RT = 8310 Дж
53.
![]()
(что близко к молярной массе кислорода к = 0,032 кг/моль).
54. Внутренняя энергия, а значит, и температура газа будут увеличиваться до тех пор, пока скорости обоих поршней не станут одинаковыми и равными 2v. Поэтому разумно решать задачу в системе отсчета, движущейся вправо со скоростью 2v. Записав закон сохранения энергии 2mv2/2 + cTо= cT, получаем
Ответ: T = Tо + mv2/c.
55. cм. решение задачи
65.
![]()
56U = ( 3/2 ) ( m/) RT = 3,11*103 Дж.
A = ( m/ ) RT = 2,08*103 Дж. Q = U + A = 5,19*103 Дж.
57. Запишем условие равновесия поршня в конечном состоянии и закон сохранения энергии: kx = p2S = p2 ( V2 - V1 )
Cv( T - T ) = ( kx2 )/ 2.
Здесь (кx2)/2 - потенциальная энергия пружины, n - число молей. Кроме того, для идеального газа
![]()
![]() Отсюда
Отсюда
Ответ: СV =5/2 R = 21 Дж/(моль*К)
58. А1-2 = - Q - р1V = - 1,38*105 Дж.
59.
 Газ
получает тепло в процессе 1- 2 и отдает
в процессах 2 - 3 и 3 - 1.
Газ
получает тепло в процессе 1- 2 и отдает
в процессах 2 - 3 и 3 - 1.
60. Объяснение: Решение задачи упрощается, если используем известные свойства диаграммы (p,V): работа, совершенная газом за цикл, пропорциональна площади фигуры, ограниченной графиком этого процесса. Значит, необходимо нам построить графики заданных круговых процессов на диаграмме ( p,V ).
Нетрудно видеть, что цикл 1-2-3-1 состоит из процесса изохорического нагревания 1а2, изотермического расширения 2а3 и изобарического охлаждения 3а1. В координатах (p,V) он принимает вид, показанный на рисунке.
Цикл 3-4-2-3 состоит из процессов изохорического охлаждения 4-2 и изотермического расши-рения 2-3 для обоих циклов совпадаеют, то разумно графики зависимости p (V) для них изобразить на одних осях координат ( см. рисунок).
Совершенно очевидно, что площадь фигуры 1-2-3-1 меньше площади фигуры 3-4-2-3. Отсюда непосредственно следует, что по модулю работа газа А в первом процесе меньше, чем во втором, т. е. |А1-2-3-1| < |А3-4-2-3|. Но нельзя забывать, что работа, совершаемая газом, является алгебраической величиной: если процесс происходит с увеличением объема, то А>0, а если объем системы уменьшается, то А<0. Для круговых процессов можно сформулировать такое правило определения знака работы, совершенной газом: если обход контура кругового процесса совершается по часовой стрелке, то А>0; если же обход контура происходит против часовой стрелки, то А <0. Применив это правило к данной задаче, получаем
А1-2-3-1 > 0 и А3-4-2-3 <0.
Окончательный ответ : А1-2-3-1 > А3-4-2-3, но при этом | А1-2-3-1 | < | А3-4-2-3 |.
61. Объяснение: Наиболее распространенная ошибка, которая встречается при ответе заключается в том , что отождествляется два различных понятия: температура и количество теплоты. При этом утверждается, что если температура неизменна (процессы 1-2 и 3-4) , то теплоту не нужно ни подводить, ни отводить. Это, конечно, не верно.
Для решения воспользуемся первым законом термодинамики: Q = U + A.
Здесь Q - количество теплоты, переданное системе, U-изменение внутренней энергии системы и А- работа, совершенная системой.
Внутренняя энергия идеального газа зависит лишь от температуры (конечно при условии , что m=const и=const). Поэтому для изотермического процесса 1а2 изменение внутренней энергии U=0, и первый закон термодинамики принимает вид Q=A.
Так как объем системы увеличивается, то А>0. Следовательно, и Q>0, то есть к системе нужно подвести некоторое количество теплоты.
За счет подведенной теплоты система и совершает работу в процессе изотермического расширения. Аналогич-ные рассуждения можно провести для процесса изотермического сжатия 3а4. Но в этом сслучае объем системы уменьшается, поэтому А < 0, и Q < 0: теплоту нужно от системы отводить.
Процессы 2а 3 и 4 а1 адиабатные. По определению адиабатный процесс - это процесс без теплообмена с окружающей средой, то есть Q = 0. Следовательно, на участках 2 а3 и 4а1 теплота ни подводится к системе, ни отводится от нее.
62.
![]()
Указание: Изобразить данный цикл на диаграмме (p,V).
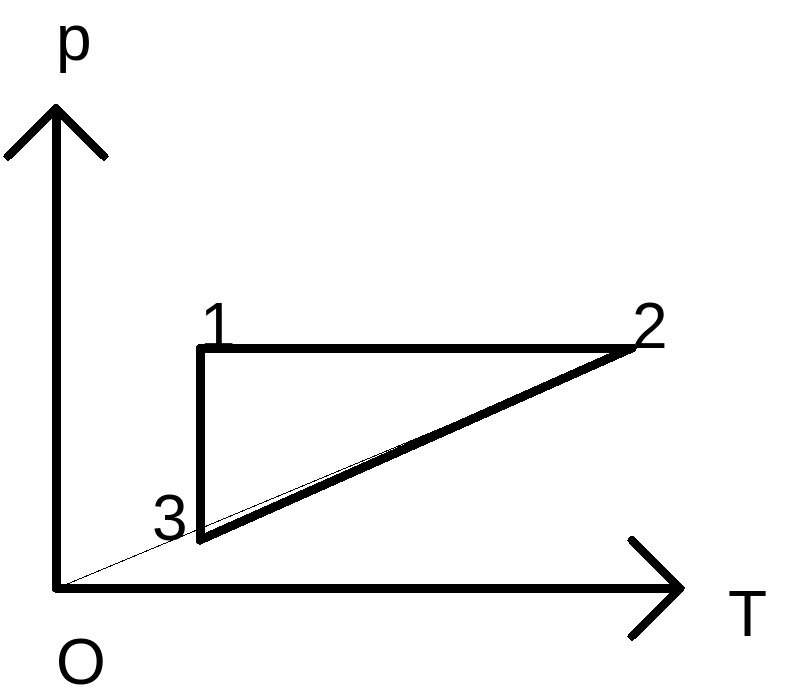
![]() и отдает ее в
процессах 2а3
и 3а1.
см. рисунок.
и отдает ее в
процессах 2а3
и 3а1.
см. рисунок.
64. Согласно
первому закону термодинамики Q = U
+ A. Изменение внутренней энергии U
= c(TM -
TK).
Из уравнения состояния идеального газа
![]()
![]()
![]()
поэтому работу А, совершенную газом при расширении от объема V1 до объема V2, может найти графически: А=рсрV2-V1)=1/2(p1+p2)(V2-V1). Тогда окончательно для количества теплоты Q, поглощенного газом, имеем Ответ:
![]()
65.
Ответ![]() :
:
Объяснение: А=А1-2+ А2-3 + А3-4 + А4-1, где А1-2=А3-4=0 ( для изохорных процессов) А2-3 = R( T3-T2), A4-1= R(T1 - T4), тогда А = R(T3-T2) + R(T1 - T4), где T2=T4=T, а 1 молю. Уравнение примет вид
А = R( T3 - 2T + T1 ).
Для изобарных процессов 2-3 и 4-1
V2/T2
= V3/T3,
V4/T4
= V1/T1;
отсюда т.к. V3
= V4,
![]() а
т.к. V2
= V1,то
получаем Т3/Т
= Т/Т1 или
Т2 =
Т3T1
а
т.к. V2
= V1,то
получаем Т3/Т
= Т/Т1 или
Т2 =
Т3T1
![]() тогда
тогда
![]()
![]()
67. T2=0,7Т1=301 К.
68. Правильный ответ : БВ.
69.
![]()
70. Q=( c1m1 + c2m2) ( t1 + t2 ) = 2*105 Па.
71.
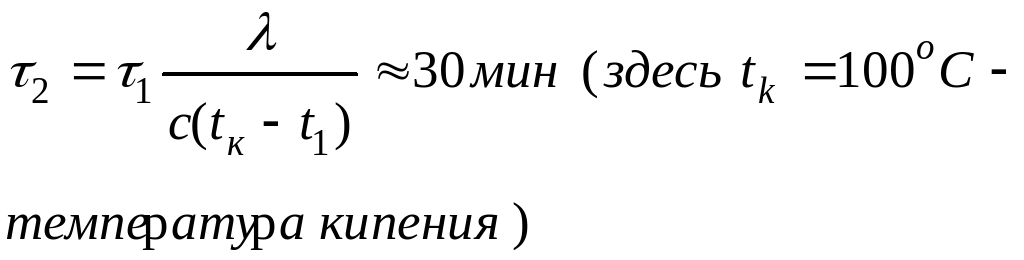
72.
![]()
здесь tо = 0оС - температура плавления льда).
73.
![]()
74. После установления теплового равновесия в калориметре будет смесь льда и воды при температуре 0оС, причем воды будет mв=m2- (c1m1t1)l=0,04 кг.
75. Ответ:
