
Ответы.
1.
![]()
2.
![]()
3. v = 2pnd/j = 200 м/c.
4.
![]()
5. n = (V + Vo) / V = 1,2.
6. Объяснение: Прежде всего расшифруем график, приведенный на диаграмме (p,T), и выясним, какие процессы проводились над газом?
На участке 1-2 давление неизменно и имеет р1, а температура увеличивается от значения Т1 до значения Т2. Изменяться может лишь параметр- объем V. Следовательно, на первом этапе объем изобарически увеличивается от V1 до V2. На диаграмме (p,V) этот процесс изобразится прямой 1-2, параллельной оси V ( cм. рисунок 2).
На участке 2-3 давление изменяется прямо пропорционально температуре (прямая 2-3 проходит через начало координат). Это указывает на то, что на этом участке объем газа не изменяется: V2=V3. На диаграмме ( p,V ) процесс 2-3 изобразится вертикальным отрезком, идущим вниз, так как давление уменьшается.
Процесс 3-4 изобарический (р=р3). Температура, а следовательно, и объем убывают. Процесс 3-4 на диаграмме (p,V) будет изображаться отрезком, параллельным оси V. Но пока остается неизвестным, где заканчивается процесс 3-4, так как неизвестен объем V4. Поэтому предварительно исследуем процесс 4-1. Из рисунка (1) видно, что в процессе 4-1 давление растет прямо пропорционально абсолютной температуре. А это означает, что процесс происходит при V=const, и V4=V1. Окончательно график цикла 1-2-3-4-1 на диаграмме (p,V) имеет вид, показанный на рисунке 2.

7. Параметры систем "1" и "2" связаны соотношением
![]() Возможны
такие частные случаи:
Возможны
такие частные случаи:
а) T1 > T2, если m1 = m2 и m1 = m2;
б) m1 > m2, если T1 = T2 и m1 = m2;
в) m1 < m2, если m1 = m2 и T1 = T2.
8.
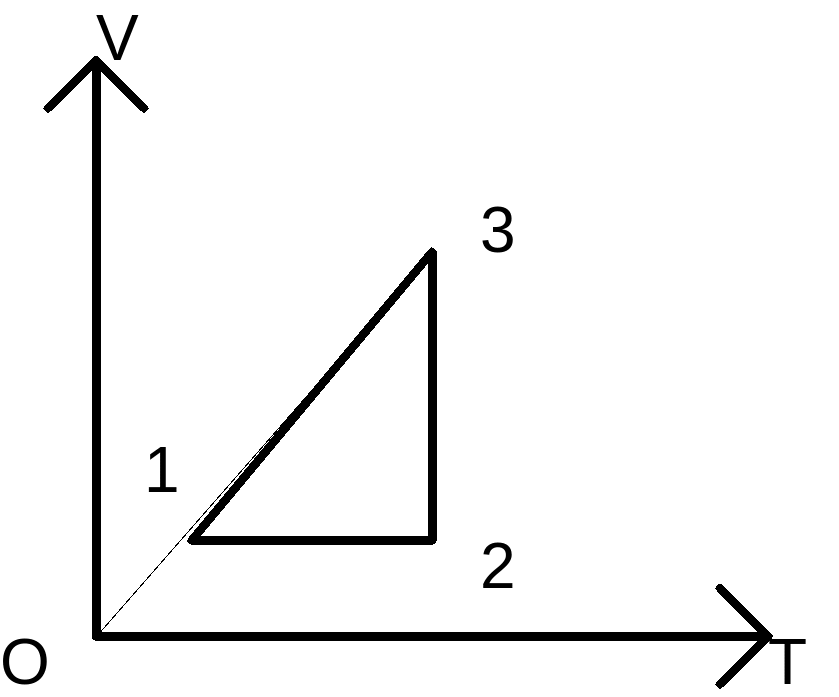
9.
![]()
10. p = NkT /V = 138 Па.
11. p = mg/(2S) = 50 кПа.
12. Объяснение:
Давление, создаваемое водяным паром, будет существенно зависеть от того, насыщенный он или нет. Заранее мы ничего определенного сказать не можем, поэтому примем в качестве гипотезы, что вся введенная в сосуд вода испарилась, но образовавшийся водяной пар все же оказался ненасыщенным. Решим задачу в этом предположении, а затем вычислим давление пара, сравним его с давлением насыщенного пара при 100оС и сделаем вывод о правильности или неправильности гипотезы. Если пар ненасыщнный, то его давление p1 связано с занимаемым объемом V1 уравнением Менделеева-Клайперона:
![]() Поскольку
поршень находится в равновесии, давления
водяного пара и азота должны быть равны:
р1=р2,
где
Поскольку
поршень находится в равновесии, давления
водяного пара и азота должны быть равны:
р1=р2,
где
![]() Отсюда
находим, что
Отсюда
находим, что
![]() Подставляя
найденный объем в формулу для давления
пара, находим, что оно составляет 2,3*105
Па, что превышает давление насыщенного
пара при рассматриваемой температуре
рн=105
Па. Таким образом, наше исходное
предположение было неверным - пар в
цилиндре насыщенный, и его давление
равно 105 Па.
Нам осталось найти объем, занимаемый
азотом, при котором его давление такое
же, как и давление пара
Подставляя
найденный объем в формулу для давления
пара, находим, что оно составляет 2,3*105
Па, что превышает давление насыщенного
пара при рассматриваемой температуре
рн=105
Па. Таким образом, наше исходное
предположение было неверным - пар в
цилиндре насыщенный, и его давление
равно 105 Па.
Нам осталось найти объем, занимаемый
азотом, при котором его давление такое
же, как и давление пара
![]() Ответ:
V2/V = 1,1/2
= 11/20; Vв.п./V
= 9/20.
Ответ:
V2/V = 1,1/2
= 11/20; Vв.п./V
= 9/20.
13.
![]()
ог/моль - молярная масса группы С3Н6О).
14. mв= rвV(1 - T2/T1) = 0,2 кг.
15.
![]()
16.
![]()
17. p = npоVo/V = 2*105 Па.
18.
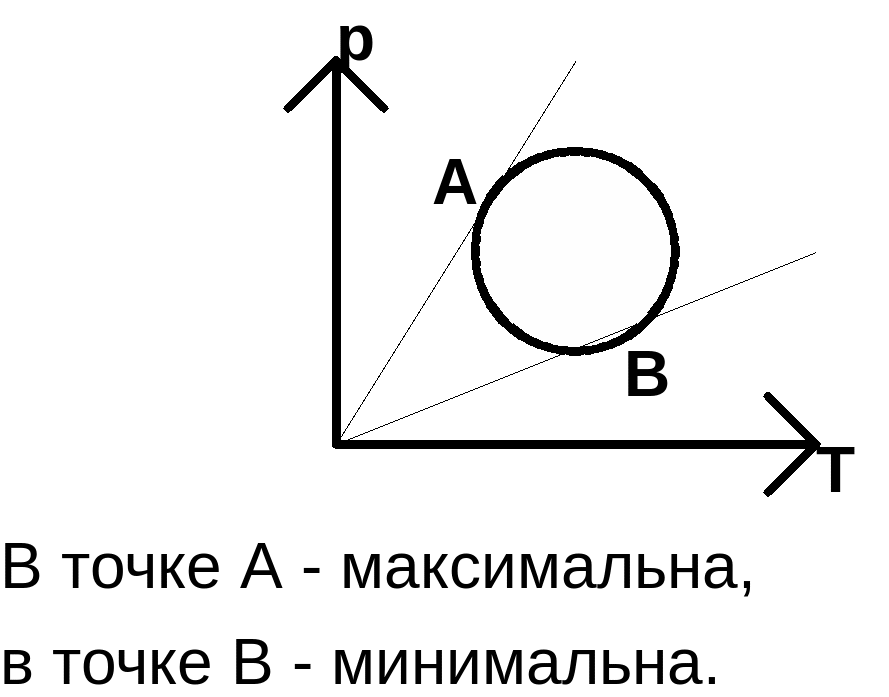
19.
![]()
( здесь ро = 105 Па - нормальное давление).
20.
![]()
21. = 1-n / k.
22. T2 = T1m / (r2V1) = 140 К.
23.р = 2/3 (E / V) = 0,8*106 Па.
24. p2 = 2p1V1T2 / ( V2T1) = 8*105 Па.
25.
![]()
![]() где
плотность
ртути .
где
плотность
ртути .
26.
![]()
27. p'=2(1+z)mRT'/(V)=1,9*108 Па (при полной ионизации кислорода коцентрация электронов в плазме больше концентрации ядер в z=8 раз;
p'/p=2(1+z)T'/T=6*104
28. Запишем уравнения состояния газа для начального и конечного состояний:
![]()
![]()
![]() где
m = m1 + m2.
Отсюда
где
m = m1 + m2.
Отсюда
Ответ![]() :
:
29.
![]() 30.
30.
![]()
m1, m2, m3, - массы и молярные массы водорода, кислорода и воды соответственно.
31. p = ( p1V1+p2V2 ) / ( V1 + V2 ) = 84,1кПа.
32. V2/V1=3.
33. Ответ:
![]()
34. Объяснение: При температуре Т1 для смеси неона и молекулярного водорода можно записать уравнение р1V=(1+2)RT1, если обозначить степень диссоциации водорода, т.е. отношение числа распавшихся молекул к общему числу молекул до диссоциации, через то при температуре Т2 в сосуде окажется 1 молей неона, (1-) 2 молей молекулярного водорода и 22 молей атомарного водорода. Уравнение состояния газовой смеси примет вид p2V= (1+2(1+)RT2.
Ответ:
![]()
35.Ответ:
![]()
![]() Объяснение:
Объяснение:
Если два сосуда с газом соединены трубкой, через которую газ может свободно перетекать, то при равновесии давления в обоих сосудах оказываются одинаковыми независимо от температур газов в каждом сосуде. В данной задаче идет речь не о перетекании газа из одной части сосуда в другую, а о диффузии водорода через проницаемую для него перегородку. В этом случае равновесие наступает при равенстве диффузионных потоков, которые пропорциональны среднему числу ударов молекул водорода о перегородку с той и другой стороны. Вспомним, что среднее число ударов пропорционально числу молекул в единице объема и средней тепловой скорости, которая в свою очередь пропорциональна корню квадратному из температуры. (§7, учебник ) .
Пусть через перегородку продиффундировало n молей водорода. Тогда во второй половине сосуда осталось (1-) молей и условие равенства диффузионных потоков водорода запишется в виде
![]() откуда
откуда
![]() после
установления равновесия давление смеси
аргона и водорода в первой половине
будет равно:
после
установления равновесия давление смеси
аргона и водорода в первой половине
будет равно:
36. Объяснение: В начальном состоянии в баллоне находилось по одному молю водорода и кислорода. Давление р1 смеси этих газов до реакции определяется из уравнения p1V=2RT1: p1=2RT1/V=4,5*105 Па.
В реакцию образования воды всупает весь водород - 1 моль и половина кислорода 1/2 моля; следовательно, после реакции в баллоне будет находиться 1 моль воды и 1/2 моля кислорода. Установившееся давление при температуре Т2=373К зависит, прежде всего, от того, в каком состоянии находится вода - только в парообразном или частично и в жидком тоже. Как известно, при температуре 373 К (точка кипения воды) давление насыщенных паров равно рн=105 Па. Если бы вся образовавшаяся вода испарилась, ее парциональное давление не должно было бы превышать рн. С другой стороны, из уравения Менделеева-Клайперона следует, что давление паров ( если вся вода испарится) pп=RT2/V=3*105 Па.
Таким образом,
часть воды будет находится в жидком
состоянии, а парциальное давление паров
будет равно рн.
Парциальное давление оставшегося в
баллоне кислорода.
![]()
Следовательно, полное давление после окончания реакции р2=рк+рн=2,5*105Па. Отсюда: Ответ: p2/p1=0,55.
