
- •9. Пространство и время в сто Эйнштейна .
- •Закон сохранения импульса .
- •Закон сохранения момента импульса .
- •2.Термодинамический .
- •15. Уравнение состояния .
- •17.Второе начало термодинамики .
- •18. Концепция электромагнетизма .
- •20. Электрический ток . Закон Ома .
- •26. Квантовые свойства материи .
- •27. Корпускулярно-волновой дуализм света и микрочастиц .
- •28. Принцип неопределенности Гейзенберга .
- •31 . Галактики и звезды .
15. Уравнение состояния .
Если я все правильно понял , то имеется ввиду уравнения Менделеева-Клапейрона . Вся охуенность этого уравнения заключается в том , что оно связывает между собой основные характеристики газа , то есть молярный объем , температуру и давление .
Для справки , молярный объем – объем , занимаемый одним молем вещества в данном объеме . Получается он из формулы : V/ν , где V – данный объем , ν(ню) – количество вещества .
Но вернемся к уравнению . Выглядит эта штука так :
P*Vm = R*T
Где P , Vm , T – давление , молярный объем и температура , а R – универсальная газовая постоянная , равная 8,31 (Дж/(Моль*Кельвин)) .
Кельвин , если кто не знает , - единица измерения температуры в молекулярной физике , так что даже не думайте на каверзный вопрос «В чем измеряется температура ?» сказать «ну , ясен пень , в градусах по Цельсию» .
Газовая постоянная – специальная величина , показывающая работу одного моля газа при расширении в изобарном процессе (с постоянным давлением) и нагревании на 1 К .
Это же уравнение можно записать в другом виде :
PV
=
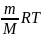
Как к этому выражению прийти :
Vm
=
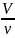
При этом
ν=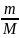
Тогда при подстановке получаем PV =
И теперь то самое , ради чего стоит учить этот вопрос .Барабанную дробь , пожалуйста !
В случае постоянной массы вещества (то есть ν) формула принимает такой вид :

Так как и ν , и R – постоянны , то :

А отсюда получаются формулы для изопроцессов (процессов , в которых P , V или T являются постоянными) :
T = const -> PV = const
P = const -> V/T = const
V = const -> P/T = const
Вот и все )
16. Первое начало термодинамики .
Это , дети мои , закон сохранения энергии , переделанный под термодинамику .
Звучит он так :
Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты Q, сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества N при химическом потенциале μ, и работы A'[3], совершённой над системой внешними силами и полями, за вычетом работы A, совершённой самой системой против внешних сил .
Да ладно , ладно , дядя шутит . Сейчас все объясню )
В общем , смотрите . Как вы знаете , энергия просто так никуда не девается . Поэтому давайте представим , что у нас есть система тел . Пока она изолирована , ее запас энергии остается неизменным , что бы с ней не происходило , если это не происходит под действием внешних сил . Если же системе передается тепло , которое является энергией , то она тратит его на что ? Правильно , на изменение своей внутренней энергии (температуры) и сопротивление внешним силам .
Также первое начало термодинамики говорит , что тело может совершать какую-либо работу только за счет своей внутренней энергии , либо же за счет черпания энергии из внешних источников . Собственно , этот момент является опровержением возможности существования вечного двигателя первого рода , т.е. двигатель , который работал бы без поглощения энергии из внешних источников . вот тут очень интересные задумки описаны и опровержены )
