
- •Гидроаэромеханика.
- •1.3.3. Процессы изменения состояния газа
- •Применение термодинамических потенциалов для описания эффекта Джоуля-Томсона
- •Принцип Даламбера-Лагранжа в интегральной форме.
- •8. Уравнения Лагранжа первого рода.
- •Уравнения Лагранжа второго рода.
- •Элементы гидро- и аэродинамики
- •Вихревая теория
- •Теорема Кельвина о безвихревом движении
- •[Править] Доказательство первой теоремы Кельвина
- •[Править] Формулировка теоремы
- •[Править] Поля, определенные ротором и дивергенцией
- •Стационарный одномерный поток
- •Несжимаемая жидкость
- •Адиабатическое течение
- •Для сжимаемого идеального газа
1.3.3. Процессы изменения состояния газа
На графике p/V можно проследить изменение газа при его переходе от одной точки до другой. Было бы лучше, и более нагляднее, прослеживать изменение газа на графике с тремя осями, а именно р, V и Т. Процесс изменения газа при этом будет отображаться на графике кривой, которая на самом деле будет лежать в трехмерном пространстве. Если же рассматривать отдельные процессы изменения состояния газа, то можно выделить следующие: изохорный процесс (объем при этом остается неизменным); изобарный процесс (давление газа является константой), изотермический процесс (газ имеет постоянную температуру); изотропический или адиабатический процесс (отсутствует теплообмен с внешней средой) и политропический процесс (процесс, при котором используются элементарные математические функции для описания теплообмена с внешней средой).
Примером изохорного процесса является нагревание газа в изолированном резервуаре. Что бы посчитать количество подводимой теплоты можно воспользоваться следующей формулой:


Процесс нагрева газа в цилиндре, с постоянным давлением, представляет собой изобарный процесс. При этом рассчитать количество подводимой теплоты можно по формуле:


Если рассматривать изотермический процесс сжатия, то отмечаем тот факт, что газ в цилиндре сжать по изотерме практически невозможно, т.к. это очень медленный процесс и практически невыполнимый. Что бы добиться постоянной температуры газа при его сжатии необходимо постепенно отводить то количество теплоты, которое образуется при работе сжатия.

При расчетах подводимой теплоты применяют формулу:

Изоэнтропический процесс. Данный процесс можно наблюдать при сжатии газа в изолированном объеме без сопровождения процессов теплообмена с внешней средой. Выразить в виде формулы данный процесс можно так:


Любой процесс, по сути дела, представляет собой промежуточное звено между изотермическим процессом (при теплообмене с внешней средой) и изоэнтропическим процессом (противоположен изотермическому процессу), - такой общий процесс называется политропическим.
Математически данный процесс можно представить так:

Совершенный
газ - в
гидроаэромеханике - газ, параметры
которого удовлетворяют уравнению
Клапейрона
![]() (p
- давление,
(p
- давление,
![]() -
плотность,
R
- газовая
постоянная,
-
плотность,
R
- газовая
постоянная,
![]() -
молярная
масса).
Совершенный газ имеет постоянные
удельные
теплоемкости
при постоянном объеме и давлении
(соответственно,
-
молярная
масса).
Совершенный газ имеет постоянные
удельные
теплоемкости
при постоянном объеме и давлении
(соответственно,
![]() ).
В термодинамике
такой газ называется идеальным
газом;
в гидроаэромеханике
и газовой
динамике
под идеальным газом понимают газ, в
котором отсутствует вязкость
и теплопроводность
(см. Идеальная
жидкость).
Модель совершенного газа удовлетворительно
описывает поведение реальных
газов
и газовых
смесей
(например, воздуха)
в ограниченном диапазоне изменения p
и T
и широко используется при
расчетно-теоретических исследованиях
течения газов.
).
В термодинамике
такой газ называется идеальным
газом;
в гидроаэромеханике
и газовой
динамике
под идеальным газом понимают газ, в
котором отсутствует вязкость
и теплопроводность
(см. Идеальная
жидкость).
Модель совершенного газа удовлетворительно
описывает поведение реальных
газов
и газовых
смесей
(например, воздуха)
в ограниченном диапазоне изменения p
и T
и широко используется при
расчетно-теоретических исследованиях
течения газов.
Применение термодинамических потенциалов для описания эффекта Джоуля-Томсона
Адиабатическое расширение газа обычно приводит к изменению его температуры. Если при адиабатическом расширении уменьшение внутренней энергии газа равно совершенной им механической работе над внешними телами, то такой процесс будет обратимым. При обратимом адиабатическом расширении температура газа изменяется в соответствии с уравнением адиабаты. Для идеального газа эта зависимость имеет вид (см. формулу (2.86)):
|
(4.54) |
где:
![]() и
и
![]() -
объем и температура газа в начале
процесса,
-
объем и температура газа в начале
процесса,
![]() и
и
![]() -
объем и температура газа после расширения.
Так как
-
объем и температура газа после расширения.
Так как
![]() ,
то из формулы (4.54)
следует, что при обратимом адиабатическом
расширении идеального газа происходит
уменьшение его температуры:
,
то из формулы (4.54)
следует, что при обратимом адиабатическом
расширении идеального газа происходит
уменьшение его температуры:
![]() .
.
Указанное уменьшение температуры идеального газа при его адиабатическом расширении происходит только в том случае, если этот процесс является обратимым. Описанный в параграфе 2.4 опыт Гей-Люссака показал, что при необратимом адиабатическом расширении идеального газа без совершения им работы над внешними телами его внутренняя энергия и температура остаются неизменными. Поэтому при таком расширении использование выражения (4.54) для определения температуры идеального газа становится невозможным.
При необратимом адиабатическом расширении величина и знак изменения температуры зависят от свойств использующегося в процессе газа. Необратимое адиабатическое расширение газа может быть осуществлено путем его пропускания через пористую перегородку, которая обеспечивает медленное течение газа без возникновения в нем турбулентных потоков, что позволяет считать кинетическую энергию газа малой величиной. Наблюдаемый при этом эффект, заключающийся в изменении температуры газа, называется эффектом Джоуля-Томсона. На примере описания этого эффекта рассмотрим применение метода термодинамических потенциалов.
На рис. 4.1 схематически
изображен опыт Джоуля-Томсона. Внутри
теплоизолированной трубки помешалась
пористая перегородка, через которую
осуществлялось медленное стационарное
течение газа. Газ внутри пористой
перегородки находится в неравновесном
состоянии, а процесс его протекания -
является необратимым. Но вследствие
медленности течения, газ по обе стороны
от перегородки можно считать находящимся
в равновесии. Давления
![]() и
и
![]() в
обеих частях цилиндрической трубки
поддерживались постоянными. Пусть при
протекании через пористую перегородку
некоторой порции газа, имевшей объем
и
температуру
,
она приобрела объем
в
обеих частях цилиндрической трубки
поддерживались постоянными. Пусть при
протекании через пористую перегородку
некоторой порции газа, имевшей объем
и
температуру
,
она приобрела объем
![]() и
температуру
и
температуру
![]() (см.
рис. 4.1).
(см.
рис. 4.1).
|
Рис. 4.1. Схема опыта Джоуля-Томсона |
Проведем описание процесса протекания газа через пористую перегородку. Считая этот процесс достаточно медленным и адиабатическим, а также, учитывая постоянство давлений и , применим первое начало термодинамики:
|
(4.55) |
или учитывая определение энтальпии (4.28)
|
(4.56) |
Следовательно, рассматриваемый процесс является не только адиабатическим, но и изоэнтальпийным.
Далее будем считать,
что изменения давления
![]() и
температуры
и
температуры
![]() газа
в рассматриваемом процессе малы. Тогда
с точностью до величин второго порядка
малости можно записать:
газа
в рассматриваемом процессе малы. Тогда
с точностью до величин второго порядка
малости можно записать:
|
(4.57) |
Следовательно:
|
(4.58) |
Для определения частных
производных энтальпии
![]() найдем
полный дифференциал от выражения (4.28)
найдем
полный дифференциал от выражения (4.28)
|
(4.59) |
Тогда с учетом формулы (4.57) имеем:

|
(4.60) |
Из формулы (4.60) следует:
|
(4.61) |
|
(4.62) |
где
![]() -
теплоемкость газа при постоянном
давлении. При получении выражения (4.61)
использована формула (1.5)
с учетом выражения (1.12),
а при получении формулы (4.62)
- уравнение (4.24).
-
теплоемкость газа при постоянном
давлении. При получении выражения (4.61)
использована формула (1.5)
с учетом выражения (1.12),
а при получении формулы (4.62)
- уравнение (4.24).
Дифференцирование
выражения (4.43)
по давлению
![]() ,
а формулы (4.44)
по температуре
,
а формулы (4.44)
по температуре
![]() ,
с учетом равенства перекрестных
производных потенциала Гиббса
,
с учетом равенства перекрестных
производных потенциала Гиббса
|
(4.63) |
дает
|
(4.64) |
Подстановка выражения (4.64) в формулу (4.62) и далее, с ее учетом, формул (4.61) и (4.62), в выражение (4.58) позволяет получить следующее соотношение:
|
(4.65) |
или для бесконечно малого изменения давления
|
(4.66) |
где производная
 определяется
уравнением состояния газа. Формула
(4.65)
позволяет рассчитать изменение
температуры газа при просачивании его
через пористую перегородку.
определяется
уравнением состояния газа. Формула
(4.65)
позволяет рассчитать изменение
температуры газа при просачивании его
через пористую перегородку.
Если при проведении опыта использовать идеальный газ, описываемый уравнением Клапейрона-Менделеева (2.10), то имеем:
|
(4.67) |
Следовательно, для
идеального газа
![]() и
изменения его температуры при прохождении
через пористую перегородку не происходит.
и
изменения его температуры при прохождении
через пористую перегородку не происходит.
Таким образом, при необратимом адиабатическом расширении идеального газа через пористую перегородку его температура не изменяется, в отличие от обратимого адиабатического расширения, приводящего в соответствии с формулой (4.54) к охлаждению идеального газа.
Данный результат связан с тем, что при адиабатическом расширении идеального газа в опыте Джоуля-Томсона механическая работа не совершается, в отличие от обратимого адиабатического расширения. При применении в этом опыте реального газа совершаемая им механическая работа определяется силами межмолекулярного взаимодействия, и её знак зависит от этих сил.
Рассмотрим применение в опыте Джоуля-Томсона газа Ван-дер-Ваальса, уравнение (2.117) для одного моля которого имеет вид:
|
(4.68) |
Раскроем скобки в этом уравнении
|
(4.69) |
и пренебрегая третьим
и четвертым слагаемыми в левой части
получившегося выражения в связи с их
малостью (считая
![]() ),
продифференцируем его по температуре
),
продифференцируем его по температуре
![]() при
постоянном давлении
:
при
постоянном давлении
:
|
(4.70) |
или
|
(4.71) |
Выражая
![]() из
формулы (4.68)
и подставляя в (4.71)
с последующим пренебрежением малыми
слагаемыми имеем:
из
формулы (4.68)
и подставляя в (4.71)
с последующим пренебрежением малыми
слагаемыми имеем:
|
(4.72) |
Тогда формула (4.65)
для отношения
![]() принимает
вид
принимает
вид
|
(4.73) |
Из этой формулы следует,
что существует температура
![]() ,
при которой газ Ван-дер-Ваальса, проходя
через пористую перегородку, не изменяет
свою температуру. Эта температура
,
при которой газ Ван-дер-Ваальса, проходя
через пористую перегородку, не изменяет
свою температуру. Эта температура
![]() называется
температурой
инверсии, так как при
называется
температурой
инверсии, так как при
![]() отношение
отношение
![]() и
наблюдается охлаждение газа (так как
и
наблюдается охлаждение газа (так как
![]() и,
следовательно
и,
следовательно
![]() ),
а при
),
а при
![]() отношение
отношение
![]() и
газ нагревается. В первом случае эффект
Джоуля-Томсона считается положительным,
а во втором - соответственно отрицательным.
и
газ нагревается. В первом случае эффект
Джоуля-Томсона считается положительным,
а во втором - соответственно отрицательным.
Как следует из проведенного
анализа, при выполнении условия
![]() наблюдается
охлаждение газа при необратимом
адиабатическом расширении. По этой
причине, как уже отмечалось в параграфе
2.7, эффект Джоуля-Томсона
применяется для охлаждения и ожижения
газов, таких, например, как водород и
гелий.
наблюдается
охлаждение газа при необратимом
адиабатическом расширении. По этой
причине, как уже отмечалось в параграфе
2.7, эффект Джоуля-Томсона
применяется для охлаждения и ожижения
газов, таких, например, как водород и
гелий.
Процесс охлаждения газа может быть реализован так же с помощью обратимого адиабатического расширения. При таком расширении процесс будет происходить при постоянной энтропии, то есть этот процесс будет изоэнтропийным. Тогда для обратимого адиабатического расширения газа можно на основании формулы (4.29) записать:
|
(4.74) |
С учетом формулы (4.57) имеем
|
(4.75) |
Отсюда следует, что при описании обратимого адиабатического процесса вместо формулы (4.58) необходимо использовать выражение
|
(4.76) |
С учетом полученных выше выражений (4.61), (4.62) и (4.64) вместо формулы (4.66) можно записать:
|
(4.77) |
Для газов характерно изобарическое расширение при их нагревании. Поэтому из условия
|
(4.78) |
справедливого для всех газов, следует, что
|
(4.79) |
Поэтому при обратимом
адиабатическом расширении газ охлаждается
(![]() ),
так как при этом его давление уменьшается
(
),
так как при этом его давление уменьшается
(![]() ).
В частности, при расширении идеального
газа, из формул (4.67)
и (4.77)
имеем:
).
В частности, при расширении идеального
газа, из формул (4.67)
и (4.77)
имеем:
|
(4.80) |
Для газа Ван-дер-Ваальса
при обратимом адиабатическом расширении
с учетом формулы (4.72)
при условии
![]() получим
следующее выражение для определения
изменения его температуры
получим
следующее выражение для определения
изменения его температуры
|
(4.81) |
Из выражений (4.80) и (4.81) следует, что как идеальный газ, так и газ Ван-дер-Ваальса охлаждается при обратимом адиабатическом расширении.
Таким образом, применение для охлаждения газа обратимого адиабатического процесса имеет принципиальное преимущество по сравнению с применением эффекта Джоуля-Томсона, связанное с отсутствием явления инверсии. Однако для реализации этого преимущества возникает необходимость создания технических устройств, в которых газ должен совершать механическую работу над внешними телами, например, над поршнем или турбиной. Только в этом случае расширение газа может быть обратимым. Машины, служащие для получения низких температур за счет расширения газа с совершением им механической работы, получили названия детандеров. Для охлаждения больших количеств газа наибольшее распространение получили турбодетандеры, в которых вместо поршня используется турбина. Обеспечение работоспособности детандеров и турбодетандеров в условиях низких температур является достаточно сложной технической задачей.
Задача 4.5. Фотонный газ,
имеющий температуру
,
находится в объеме
![]() .
Величину этого объема резко увеличивают
на
.
Величину этого объема резко увеличивают
на
![]() ,
совершая необратимый адиабатический
процесс. Считая, что фотонный газ не
совершает при рассматриваемом процессе
работы, определить изменение его
температуры
,
совершая необратимый адиабатический
процесс. Считая, что фотонный газ не
совершает при рассматриваемом процессе
работы, определить изменение его
температуры
![]() .
Решить задачу для случая обратимого
адиабатического расширения фотонного
газа. Использовать выражения для
внутренней энергии
.
Решить задачу для случая обратимого
адиабатического расширения фотонного
газа. Использовать выражения для
внутренней энергии
![]() и
энтропии
и
энтропии
![]() фотонного
газа.
фотонного
газа.
Решение: Так как
рассматриваемый необратимый адиабатический
процесс происходит без теплообмена с
окружающей средой:
![]() ,
и, в соответствии с условием задачи,
считается, что при его протекании работа
не совершается:
,
и, в соответствии с условием задачи,
считается, что при его протекании работа
не совершается:
![]() ,
то из первого начала термодинамики
следует сохранение внутренней энергии
фотонного газа:
,
то из первого начала термодинамики
следует сохранение внутренней энергии
фотонного газа:
![]() .
Тогда имеем:
.
Тогда имеем:
![]() .
.
Отсюда следует:
![]() .
.
В случае обратимого
адиабатического процесса должна
сохранятся энтропия фотонного газа:
![]() .
Поэтому
.
Поэтому
![]()
или
![]() .
.
Как следует из полученных результатов, охлаждение фотонного газа зависит от того, какой адиабатический процесс (обратимый или необратимый) над ним осуществляется. При этом обратимое адиабатическое расширение фотонного газа обеспечивает его более интенсивное охлаждение, чем необратимое.
4Вязкость, идеальный газ. Сжимаемость.
Вя́зкость (вну́треннее тре́ние) — одно из трёх явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. Механизм внутреннего трения в жидкостях и газах заключается в том, что хаотически движущиеся молекулы переносят импульс из одного слоя в другой, что приводит к выравниванию скоростей — это описывается введением силы трения. Вязкость твёрдых тел обладает рядом специфических особенностей и рассматривается обычно отдельно.
Различают динамическую вязкость (единицы измерения: пуаз, 0,1Па·с) и кинематическую вязкость (единицы измерения: стокс, м²/с, внесистемная единица — градус Энглера). Кинематическая вязкость может быть получена как отношение динамической вязкости к плотности вещества и своим происхождением обязана классическим методам измерения вязкости, таким как измерение времени вытекания заданного объёма через калиброванное отверстие под действием силы тяжести.
Вязкость — важная физико-химическая
характеристика веществ. Значение
Вязкость приходится учитывать
при перекачивании жидкостей и газов по
трубам (нефтепроводы, газопроводы).
Вязкость расплавленных шлаков
весьма существенна в доменном и
мартеновском процессах. Вязкость
расплавленного стекла определяет
процесс его выработки. По Вязкость
во многих случаях судят о готовности
или качестве продуктов или полупродуктов
производства, поскольку Вязкость
тесно связана со структурой вещества
и отражает те физико-химические
изменения материала, которые происходят
во время технологических процессов.
Вязкость масел имеет большое
значение для расчёта смазки машин и
механизмов и т.д.
Молекулярно-кинетическая теория
объясняет Вязкость движением
и взаимодействием молекул. В газах
расстояния между молекулами существенно
больше радиуса действия молекулярных
сил, поэтому Вязкость газов
определяется главным образом молекулярным
движением. Между движущимися относительно
друг друга слоями газа происходит
постоянный обмен молекулами, обусловленный
их непрерывным хаотическим (тепловым)
движением. Переход молекул из одного
слоя в соседний, движущийся с иной
скоростью, приводит к переносу от слоя
к слою определённого количества движения.
В результате медленные слои ускоряются,
а более быстрые замедляются. Работа
внешней силы F,
уравновешивающей вязкое сопротивление
и поддерживающей установившееся течение,
полностью переходит в теплоту.
Вязкость газа не зависит от
его плотности (давления), так как при
сжатии газа общее количество молекул,
переходящих из слоя в слой, увеличивается,
но зато каждая молекула менее глубоко
проникает в соседний слой и переносит
меньшее количество движения (закон
Максвелла). Для Вязкость
идеальных газов в молекулярно-кинетической
теории даётся следующее соотношение:
![]() где
m — масса молекулы, n — число
молекул в единице объёма,
где
m — масса молекулы, n — число
молекул в единице объёма,
![]() —
средняя скорость молекул и l — длина
свободного пробега молекулы
между двумя соударениями её с другими
молекулами. Так как
—
средняя скорость молекул и l — длина
свободного пробега молекулы
между двумя соударениями её с другими
молекулами. Так как
![]() возрастает
с повышением температуры Т (несколько
возрастает также и l), то Вязкость
газов увеличивается при нагревании
(пропорционально
возрастает
с повышением температуры Т (несколько
возрастает также и l), то Вязкость
газов увеличивается при нагревании
(пропорционально
![]() ).
Для очень разреженных газов понятие
Вязкость теряет смысл.
В жидкостях, где расстояния между
молекулами много меньше, чем в газах,
Вязкость обусловлена в первую
очередь межмолекулярным
взаимодействием, ограничивающим
подвижность молекул. В жидкости молекула
может проникнуть в соседний слой лишь
при образовании в нём полости, достаточной
для перескакивания туда молекулы. На
образование полости (на «рыхление»
жидкости) расходуется так называемая
энергия активации вязкого течения.
Энергия активации уменьшается с ростом
температуры и понижением давления. В
этом состоит одна из причин резкого
снижения Вязкость жидкостей
с повышением температуры (рис. 3)
и роста её при высоких давлениях. При
повышении давления до нескольких тыс.
атмосфер h увеличивается в десятки и
сотни раз. Строгая теория Вязкость
жидкостей, в связи с недостаточной
разработанностью теории жидкого
состояния, ещё не создана. На практике
широко применяют ряд эмпирических и
полуэмпирических формул Вязкость,
достаточно хорошо отражающих зависимость
Вязкость отдельных классов
жидкостей и растворов от температуры,
давления и химического
состава.
Вязкость
жидкостей зависит от химической
структуры их молекул. В рядах сходных
химических
соединений (насыщенные углеводороды,
спирты, органические кислоты и т.д.)
Вязкость изменяется закономерно
— возрастает с возрастанием молекулярной
массы. Высокая Вязкость
смазочных масел объясняется наличием
в их молекулах циклов (см. Циклические
соединения, Нафтены).
Две жидкости различной Вязкость,
которые не реагируют друг с другом при
смешивании, обладают в смеси средним
значением Вязкость Если же
при смешивании образуется химическое
соединение, то Вязкость смеси
может быть в десятки раз больше, чем
Вязкость исходных жидкостей.
На этом основано применение измерений
Вязкость в качестве метода
физико-химического
анализа.
Возникновение
в жидкостях (дисперсных
системах или растворах
полимеров)
пространственных структур, образуемых
сцеплением частиц или макромолекул,
вызывает резкое повышение Вязкость
При течении «структурированной» жидкости
работа внешней силы затрачивается не
только на преодоление истинной
(ньютоновской) Вязкость, но и
на разрушение структуры (см. Реология).
Для нормальных вязких жидкостей между
количеством жидкости Q, протекающей
в единицу времени через капилляр, и
давлением p существует прямая
пропорциональность (см. Пуазёйля
закон). Течение структурированных
жидкостей не подчиняется этому закону,
для них кривые зависимости Q от р
выпуклы к оси давления (рис. 4),
что объясняется непостоянством h.
Аномальной Вязкость, характерной
для структурированных жидких систем,
обладают важнейшие биологические среды
— цитоплазма
и кровь.
М. П. Воларович.
Вязкость
биологических сред определяется в
большинстве случаев структурной
вязкостью. Вязкость жидкого
содержимого клетки-цитоплазмы связана
со структурой составляющих её биополимеров
и субклеточных образований, что вызывает
отклонения (характера тиксотропии)
вязкого течения от ньютоновского закона
нормальных жидкостей. Методы измерения
Вязкость биологических сред
— наблюдение скорости перемещения
гранул при центрифугировании или
железных
опилок в магнитном
поле, измерение среднего смещения
броуновских частиц (см. Броуновское
движение). Абсолютная вязкость
цитоплазмы колеблется от 2 до 50 спз
(1 спз = 10-3 н·сек/м2),
она меняется в различных частях клетки
и в разные периоды клеточного цикла. С
понижением температуры ниже 12—15°С и
при повышении её свыше 40—50°С вязкость
цитоплазмы увеличивается. При воздействии
облучения наблюдается сначала уменьшение
вязкости, а затем, при увеличении дозы,
— её возрастание.
Вязкость
ликвора, лимфы и плазмы крови достаточно
точно описывается ньютоновским законом
вязкого течения, она исследуется в
капиллярных или цилиндрических
вискозиметрах.
Кровь — неньютоновская жидкость, так
как содержит структурированные компоненты
— белки
и клетки крови, её вязкость у человека
в норме 4—5 спз, при патологии
колеблется от 1,7 до 22,9 спз, что
отражается в реакции оседания эритроцитов
(РОЭ).
Лит.: Гaтчек
Э., Вязкость жидкостей, пер. с англ., 2
изд., М. — Л., 1935; Труды совещания по
вязкости жидкостей и коллоидных
растворов, т. 1—3, М. — Л., 1941—45; Френкель
Я. И., Кинетическая теория жидкостей, М.
— Л., 1945; Фукс Г. И., Вязкость и пластичность
нефтепродуктов, М., 1956; Голубев И. Ф.,
Вязкость газов и газовых смесей, М.,
1959; Справочник химика, 2 изд., т. 1, Л. —
М.,1963; Руководство по цитологии, т. 1—2,
М. — Л., 1965—66; Heilbrunn L. V.
The viscosity of protoplasm, W.,
1958.
Н.
Н. Фирсов.
).
Для очень разреженных газов понятие
Вязкость теряет смысл.
В жидкостях, где расстояния между
молекулами много меньше, чем в газах,
Вязкость обусловлена в первую
очередь межмолекулярным
взаимодействием, ограничивающим
подвижность молекул. В жидкости молекула
может проникнуть в соседний слой лишь
при образовании в нём полости, достаточной
для перескакивания туда молекулы. На
образование полости (на «рыхление»
жидкости) расходуется так называемая
энергия активации вязкого течения.
Энергия активации уменьшается с ростом
температуры и понижением давления. В
этом состоит одна из причин резкого
снижения Вязкость жидкостей
с повышением температуры (рис. 3)
и роста её при высоких давлениях. При
повышении давления до нескольких тыс.
атмосфер h увеличивается в десятки и
сотни раз. Строгая теория Вязкость
жидкостей, в связи с недостаточной
разработанностью теории жидкого
состояния, ещё не создана. На практике
широко применяют ряд эмпирических и
полуэмпирических формул Вязкость,
достаточно хорошо отражающих зависимость
Вязкость отдельных классов
жидкостей и растворов от температуры,
давления и химического
состава.
Вязкость
жидкостей зависит от химической
структуры их молекул. В рядах сходных
химических
соединений (насыщенные углеводороды,
спирты, органические кислоты и т.д.)
Вязкость изменяется закономерно
— возрастает с возрастанием молекулярной
массы. Высокая Вязкость
смазочных масел объясняется наличием
в их молекулах циклов (см. Циклические
соединения, Нафтены).
Две жидкости различной Вязкость,
которые не реагируют друг с другом при
смешивании, обладают в смеси средним
значением Вязкость Если же
при смешивании образуется химическое
соединение, то Вязкость смеси
может быть в десятки раз больше, чем
Вязкость исходных жидкостей.
На этом основано применение измерений
Вязкость в качестве метода
физико-химического
анализа.
Возникновение
в жидкостях (дисперсных
системах или растворах
полимеров)
пространственных структур, образуемых
сцеплением частиц или макромолекул,
вызывает резкое повышение Вязкость
При течении «структурированной» жидкости
работа внешней силы затрачивается не
только на преодоление истинной
(ньютоновской) Вязкость, но и
на разрушение структуры (см. Реология).
Для нормальных вязких жидкостей между
количеством жидкости Q, протекающей
в единицу времени через капилляр, и
давлением p существует прямая
пропорциональность (см. Пуазёйля
закон). Течение структурированных
жидкостей не подчиняется этому закону,
для них кривые зависимости Q от р
выпуклы к оси давления (рис. 4),
что объясняется непостоянством h.
Аномальной Вязкость, характерной
для структурированных жидких систем,
обладают важнейшие биологические среды
— цитоплазма
и кровь.
М. П. Воларович.
Вязкость
биологических сред определяется в
большинстве случаев структурной
вязкостью. Вязкость жидкого
содержимого клетки-цитоплазмы связана
со структурой составляющих её биополимеров
и субклеточных образований, что вызывает
отклонения (характера тиксотропии)
вязкого течения от ньютоновского закона
нормальных жидкостей. Методы измерения
Вязкость биологических сред
— наблюдение скорости перемещения
гранул при центрифугировании или
железных
опилок в магнитном
поле, измерение среднего смещения
броуновских частиц (см. Броуновское
движение). Абсолютная вязкость
цитоплазмы колеблется от 2 до 50 спз
(1 спз = 10-3 н·сек/м2),
она меняется в различных частях клетки
и в разные периоды клеточного цикла. С
понижением температуры ниже 12—15°С и
при повышении её свыше 40—50°С вязкость
цитоплазмы увеличивается. При воздействии
облучения наблюдается сначала уменьшение
вязкости, а затем, при увеличении дозы,
— её возрастание.
Вязкость
ликвора, лимфы и плазмы крови достаточно
точно описывается ньютоновским законом
вязкого течения, она исследуется в
капиллярных или цилиндрических
вискозиметрах.
Кровь — неньютоновская жидкость, так
как содержит структурированные компоненты
— белки
и клетки крови, её вязкость у человека
в норме 4—5 спз, при патологии
колеблется от 1,7 до 22,9 спз, что
отражается в реакции оседания эритроцитов
(РОЭ).
Лит.: Гaтчек
Э., Вязкость жидкостей, пер. с англ., 2
изд., М. — Л., 1935; Труды совещания по
вязкости жидкостей и коллоидных
растворов, т. 1—3, М. — Л., 1941—45; Френкель
Я. И., Кинетическая теория жидкостей, М.
— Л., 1945; Фукс Г. И., Вязкость и пластичность
нефтепродуктов, М., 1956; Голубев И. Ф.,
Вязкость газов и газовых смесей, М.,
1959; Справочник химика, 2 изд., т. 1, Л. —
М.,1963; Руководство по цитологии, т. 1—2,
М. — Л., 1965—66; Heilbrunn L. V.
The viscosity of protoplasm, W.,
1958.
Н.
Н. Фирсов.
 Рис.
4. Зависимость
количества жидкости Q, протекающей через
капилляр в 1 сек, от давления p для
нормальных (ньютоновских) и аномальных
(неньютоновских) жидкостей.
Рис.
4. Зависимость
количества жидкости Q, протекающей через
капилляр в 1 сек, от давления p для
нормальных (ньютоновских) и аномальных
(неньютоновских) жидкостей.
![]() Рис.
2. Вязкость некоторых расплавленных
металлов в спз.
S,
из которых нижняя (А) неподвижна, а
верхняя (В) под действием тангенциальной
силы F
движется с постоянной скоростью v0; v(z)
— зависимость скорости слоя от его
расстояния z от неподвижной пластинки;
Dx0 — величина начального сдвига жидкости."
href="a_pictures/18/10/212574081.jpg">
S,
из которых нижняя (А) неподвижна, а
верхняя (В) под действием тангенциальной
силы F
движется с постоянной скоростью v0; v(z)
— зависимость скорости слоя от его
расстояния z от неподвижной пластинки;
Dx0 — величина начального сдвига жидкости."
title="Рис. 1. Схема однородного сдвига
(вязкого течения) слоя жидкости,
заключенного между двумя твердыми
пластинками площадью S,
из которых нижняя (А) неподвижна, а
верхняя (В) под действием тангенциальной
силы F
движется с постоянной скоростью v0; v(z)
— зависимость скорости слоя от его
расстояния z от неподвижной пластинки;
Dx0 — величина начального сдвига жидкости."
src="a_pictures/18/10/th_212574081.jpg">
Рис. 1.
Схема однородного сдвига (вязкого
течения) слоя жидкости, заключенного
между двумя твердыми пластинками
площадью S,
из которых нижняя (А) неподвижна, а
верхняя (В) под действием тангенциальной
силы F
движется с постоянной скоростью v0; v(z)
— зависимость скорости слоя от его
расстояния z от неподвижной пластинки;
Dx0 — величина начального сдвига
жидкости.
Рис.
2. Вязкость некоторых расплавленных
металлов в спз.
S,
из которых нижняя (А) неподвижна, а
верхняя (В) под действием тангенциальной
силы F
движется с постоянной скоростью v0; v(z)
— зависимость скорости слоя от его
расстояния z от неподвижной пластинки;
Dx0 — величина начального сдвига жидкости."
href="a_pictures/18/10/212574081.jpg">
S,
из которых нижняя (А) неподвижна, а
верхняя (В) под действием тангенциальной
силы F
движется с постоянной скоростью v0; v(z)
— зависимость скорости слоя от его
расстояния z от неподвижной пластинки;
Dx0 — величина начального сдвига жидкости."
title="Рис. 1. Схема однородного сдвига
(вязкого течения) слоя жидкости,
заключенного между двумя твердыми
пластинками площадью S,
из которых нижняя (А) неподвижна, а
верхняя (В) под действием тангенциальной
силы F
движется с постоянной скоростью v0; v(z)
— зависимость скорости слоя от его
расстояния z от неподвижной пластинки;
Dx0 — величина начального сдвига жидкости."
src="a_pictures/18/10/th_212574081.jpg">
Рис. 1.
Схема однородного сдвига (вязкого
течения) слоя жидкости, заключенного
между двумя твердыми пластинками
площадью S,
из которых нижняя (А) неподвижна, а
верхняя (В) под действием тангенциальной
силы F
движется с постоянной скоростью v0; v(z)
— зависимость скорости слоя от его
расстояния z от неподвижной пластинки;
Dx0 — величина начального сдвига
жидкости.
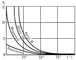 Рис.
3. Измерение вязкости некоторых смазочных
масел в зависимости от температуры (h
дана в пз).
Рис.
3. Измерение вязкости некоторых смазочных
масел в зависимости от температуры (h
дана в пз).
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
Сжимаемость,
способность вещества изменять свой объём под действием всестороннего давления. С. обладают все вещества. Если вещество в процессе сжатия не испытывает химических, структурных и других изменений, то при возвращении внешнего давления к исходному значению начальный объём восстанавливается. У твёрдых тел, имеющих поры, трещины и другие неоднородности структуры, практически обратимая С. может наблюдаться только при достаточно высоком давлении (например, у горных пород при давлении большем 2—5 кбар; 1 кбар = 108 н/м2).
Обычно
С. (объёмной упругостью) называется
обратимое изменение занимаемого
веществом объёма V
под равномерным гидростатическим
давлением р.
Величину С. характеризует коэффициент
С. (b, который выражает уменьшение
единичного объёма тела при увеличении
р
на одну единицу:
![]() ,
где DV
и Dr — изменения объёма V
и плотности r при изменении р
на величину Dр.
К
= 1/b называют модулем объёмной упругости
(модулем объёмного сжатия, объёмным
модулем), для твердых тел
,
где DV
и Dr — изменения объёма V
и плотности r при изменении р
на величину Dр.
К
= 1/b называют модулем объёмной упругости
(модулем объёмного сжатия, объёмным
модулем), для твердых тел
![]() ,
где Е
— модуль нормальной упругости (Юнга
модуль),
m — модуль сдвига. Для идеальных газов
К
= р
при любой температуре Т.
В общем случае С. вещества, а следовательно
К
и b, зависит от р
и Т.
Как правило, b убывает при увеличении р
и растет с Т.
Часто С. характеризуют относит. плотностью
d = r/r0,
где r0
— плотность при О °С и р
= 1 атм.
,
где Е
— модуль нормальной упругости (Юнга
модуль),
m — модуль сдвига. Для идеальных газов
К
= р
при любой температуре Т.
В общем случае С. вещества, а следовательно
К
и b, зависит от р
и Т.
Как правило, b убывает при увеличении р
и растет с Т.
Часто С. характеризуют относит. плотностью
d = r/r0,
где r0
— плотность при О °С и р
= 1 атм.
Сжатие может происходить как при постоянной температуре (изотермически), так и с одновременным разогревом сжимаемого тела (например, в адиабатном процессе). В последнем случае значения К будут большими, чем при изотермическом сжатии (для большинства твёрдых тел при обычной температуре — на несколько %).
Для
оценки С. веществ в широком диапазоне
давлений используют уравнения состояния,
выражающие связь между р,
V
и Т.
Определяют С. непосредственно по
изменению объёма тел под давлением (см.
Пьезометр),
из акустических измерений скорости
распространения упругих волн в веществе,
из экспериментов по ударному сжатию,
дающих зависимость между r и р
при максимальных полученных в эксперименте
давлениях. С. находят также из измерений
параметров кристаллической решётки
под давлением, производимых методом
рентгеновского
структурного анализа.
С. можно определить с помощью измерения
линейной деформации твёрдого тела под
гидростатическим давлением (по т. н.
линейной С.). Для изотропного тела
коэффициент линейной С.
![]() ,
где L
— линейный размер тела.
,
где L
— линейный размер тела.
С. газов, будучи очень большой при давлениях до 1 кбар, по мере приближения их плотности к плотности жидкостей становится близкой к С. жидкостей. Последняя с ростом р уменьшается сначала резко, а затем меняется весьма мало: в интервале 6—12 кбар b уменьшается примерно так же, как в интервале от 1 атм (10-3 кбар) до 1 кбар (примерно в 2 раза), и при 10—12 кбар составляет 5—10% от начального значения. При 30—50 кбар модули К жидкостей по порядку величины близки к К твёрдых тел. Для твёрдых тел при 100 кбар Dr/r0 " 15—25%. Для отдельных веществ, например щелочных металлов, Dr/r ~ 40%, для большинства др. металлов ~ 6—15%. Линейная С. анизотропных веществ зависит от кристаллографических направлений (во всяком случае, до давлений в десятки кбар), причём вдоль направлений со слабым межатомным взаимодействием она может в 8—10 раз превосходить С. по направлениям, вдоль которых в кристаллической решётке имеет место более сильная связь; изменение параметра решётки в этих направлениях в определённом интервале р может быть даже положительным (теллур, селен). С. — важнейшая характеристика вещества, которая позволяет судить о зависимости физических свойств от межатомных (межмолекулярных) расстояний.
Идеальный газ,
теоретическая модель газа, в которой пренебрегается взаимодействием частиц газа (средняя кинетическая энергия частиц много больше энергии их взаимодействия).
Различают классический И. г. (его свойства описываются законами классической физики) и квантовый И. г., подчиняющийся законам квантовой механики.
Частицы классического И. г. движутся независимо друг от друга, так что давление И. г. на стенку равно сумме импульсов, переданных за единицу времени отдельными частицами при столкновениях со стенкой, а энергия — сумме энергий отдельных частиц. Классический И. г. подчиняется уравнению состояния Клапейрона p = nkT, где р — давление, n — число частиц в единице объёма, k — Больцмана постоянная, Т — абсолютная температура. Частными случаями этого уравнения являются законы Бойля-Мариотта, Гей-Люссака и Шарля (см. Газы). Частицы классического И.г. распределены по энергиям согласно распределению Больцмана (см. Больцмана статистика). Реальные газы хорошо описываются моделью классического И. г., если они достаточно разрежены.
При понижении температуры Т газа или увеличении его плотности n до определённого значения становятся существенными волновые (квантовые) свойства частиц И. г. Переход от классического И. г. к квантовому происходит при тех значениях Т и n, при которых длины волн де Бройля частиц, движущихся со скоростями порядка тепловых, сравнимы с расстоянием между частицами.
В квантовом случае различают два вида И. г.; частицы газа одного вида имеют целочисленный спин, к ним применима статистика Бозе — Эйнштейна, к частицам другого вида (с полуцелым спином) — статистика Ферми — Дирака (см. Статистическая физика).
И. г. Ферми — Дирака отличается от классического тем, что даже при абсолютном нуле температуры его давление и плотность энергии отличны от нуля и тем больше, чем выше плотность газа. При абсолютном нуле температуры существует максимальная (граничная) энергия, которую могут иметь частицы И. г. Ферми — Дирака (так называемая Ферми энергия). Если энергия теплового движения частиц И. г. Ферми — Дирака много меньше энергии Ферми, то его называют вырожденным газом. Согласно теории строения звезд, в звездах, плотность которых превышает 1—10 кг/см3, существует вырожденный Ферми — Дирака И. г. электронов, а в звёздах с плотностью, превышающей 109 кг/см3, вещество превращается в Ферми — Дирака И. г. нейтронов (см. Нейтронные звёзды).
Применение теории И. г. Ферми — Дирака к электронам в металлах позволяет объяснить многие свойства металлического состояния. Реальный вырожденный Ферми — Дирака И. г. тем ближе к идеальному, чем он плотнее.
Частицы И. г. Бозе — Эйнштейна при абсолютном нуле температуры занимают наинизший уровень энергии и обладают равным нулю импульсом (И. г. в состоянии конденсата). С повышением Т число частиц в конденсате постепенно уменьшается и при некоторой температуре Т0 (температуре фазового перехода) конденсат исчезает (все частицы конденсата приобретают импульс). При Т < Т0 давление И. г. Бозе — Эйнштейна зависит только от температуры. Свойствами такого И. г. обладает при температурах, близких к абсолютному нулю, гелий. Другим примером И. г. Бозе — Эйнштейна является электромагнитное излучение (И. г. фотонов), находящееся в тепловом равновесии с излучающим телом. И. г. фотонов является также примером ультрарелятивистского И. г., то есть совокупности частиц, движущихся со скоростями, равными или близкими скорости света. Уравнение состояния такого газа: р = e/3, где e — плотность энергии газа. При достаточно низких температурах различного рода коллективные движения в жидкостях и твёрдых телах (например, колебания атомов кристаллической решётки) можно представить как И. г. слабых возбуждений (квазичастиц), энергия которых вносит свой вклад в энергию тела (см. Твёрдое тело, Квантовая жидкость).
Что же такое сжимаемость? Сжимаемостью называется способность
жидкости или газа уменьшать свой объем под действием сил внешнего
давления. Мерой сжимаемости является так называемый модуль объемной
упругости Е, определяемый из равенства
ΔV
Δp = − E , (1.1)
V0
15
где ΔV/V0 означает относительное изменение объема, вызванное
повышением давления на величину Δp. Для капельных жидкостей
сжимаемость чрезвычайно мала. Так, например, для воды Е=20000 кГс/см2,
т.е. повышение давления на одну атмосферу вызывает относительное
изменение объема на 1/20000 = 0,005%. То же самое имеет место и для всех
других капельных жидкостей. Таким образом, для капельных жидкостей
сжимаемость столь мала, что в большей части случаев ею можно пренебречь,
и поэтому течения капельных жидкостей могут рассматриваться как
несжимаемые.
Для газов, если изменение объема остается сравнительно небольшим и
происходит при постоянной температуре, модуль объемной упругости равен
давлению p0 в начальном состоянии, в чем легко убедиться из уравнения
состояния произвольного объема идеального газа. В самом деле, из
pV
уравнения состояния идеального газа = const следует, что при постоянной
T
температуре изменение объема ΔV, вызванное изменением давления Δp,
удовлетворяет соотношению
(p 0 + Δp)(V0 + ΔV) = p 0 V0 ,
ΔV
откуда имеем Δp ≈ −p 0 .
V0
Следовательно, для воздуха в нормальном состоянии, т.е. при давлении,
равном 1 атм, и температуре 00 С
Е=1 кГс/см2.
Таким образом, сжимаемость воздуха в 20 000 раз больше
сжимаемости воды. Аналогичное соотношение имеет место и для
всех газов.
Решение вопроса о том, следует ли при течениях газа учитывать
сжимаемость, зависит от того, вызывают ли изменения
давления, связанные с движением газа, заметное изменение
объема газа или же такого изменения не происходит. Вместо
изменения объема можно оценить изменение плотности Δρ. На
основании закона сохранения массы мы имеем:
(V0 + ΔV)(ρ 0 + Δρ) = p 0 V0 ,
откуда
Δρ ΔV
≈− ,
ρ0 V0
и поэтому равенство (1.1) можно переписать в виде
Δρ
Δp = E . (1.2)
ρ0
Очевидно, что течение жидкости допустимо рассматривать как
несжимаемое до тех пор, пока относительное изменение плотности остается
Δρ
весьма малым, т.е. пока << 1 .
ρ0
Исходя из уравнения Бернулли
16
ρυ 2
p+ = const ,
2
где υ - величина скорости жидкости, установим, что изменение давления Δp,
связанное с процессом течения, имеет величину такого же порядка, что и
динамическое давление q=ρυ2/2, поэтому из равенства (1.2) следует, что
Δρ Δp q
= ≈ . (1.3)
ρ0 E E
Если требуется, чтобы Δρ/ρ0<<1, то на основании равенства (1.3) это
q
равносильно требованию << 1 .
E
Таким образом, получен следующий результат: течение газа можно
рассматривать с хорошим приближением как несжимаемое до тех пор, пока
динамическое давление остается весьма малым по сравнению с модулем
объемной упругости.
Этот результат можно сформулировать несколько иначе, если ввести в
рассмотрение скорость звука а. Согласно формуле Лапласа, скорость звука
определяется равенством
E
a2 = ,
ρ0
Δρ
поэтому, используя соотношение (1.3), условие << 1 , можно переписать в
ρ0
виде
2
Δρ q ρ 0 υ 2 1 ⎛ υ ⎞
= = ≈ ⎜ ⎟ << 1 (1.4)
ρ0 E 2E 2⎝a⎠
Отношение υ/а называют числом Маха и обозначают
υ
M= .
a
Таким образом, течения газа можно рассматривать как несжимаемые, если (с
учетом (1.4))
1 2
M << 1 , (1.5)
2
т.е. при условии, что число Маха остается малым по сравнению с единицей,
или, другими словами, при условии, что скорость течения мала по сравнению
со скоростью звука. Для воздуха, в котором звук распространяется со
скоростью а≈330 м/с, число М при скорости υ=100 м/с, равно 0.3,
следовательно, из уравнений (1.4) и (1.5) относительное изменение
плотности будет
Δρ 1 2
= M ≈ 0.05 .
ρ0 2
Эту скорость течения (υ=100 м/с) можно рассматривать как наибольшую,
при которой газ еще можно оценивать как несжимаемую жидкость.
Оценить сжимаемость можно еще одним способом.
Количественно сжимаемость среды определяется изменением ее
плотности Δρ, отнесенной к единице приложенного давления Δp. В механике
17
обычно пользуются обратной величиной, равной квадрату скорости звука a в
данной среде:
Δp dp
a2 = = .
Δρ dρ
Для мало сжимаемых газов и жидкостей при больших изменениях
давления Δp изменение плотности Δρ будет малым, а следовательно,
скорость звука – большой; и наоборот, для сильно сжимаемых жидкостей
при малых изменениях давления Δp изменение плотности Δρ будет
большим, а скорость звука – малой. Следовательно, характеристикой
сжимаемости жидкостей в состоянии покоя служит скорость звука в данной
среде. Очевидно, что сжимаемость воды, скорость звука в которой ~ 1500
м/с, значительно меньше сжимаемости воздуха, в котором скорость звука ~
330 м/с. В несжимаемой среде (Δρ=0 при Δp≠0) а=∞, т.е. малые возмущения
распространяются мгновенно (в алмазе а=18 км/с). В тех же случаях, когда
газ или жидкость движется, для оценки сжимаемости пользуются не
абсолютным значением скорости звука, а отношением скорости потока υ к
скорости звука (числом М).
Все реальные жидкости обладают вязкостью, и поэтому их называют
вязкими. В некоторых задачах влиянием вязкости можно пренебречь и
ввести понятие идеальная жидкость, вязкость которой равна нулю [2]. Для
всех реальных жидкостей и газов такие физические характеристики, как
вязкость, теплоемкость, теплопроводность и т.д. зависят от их параметров,
например от температуры. Но во многих задачах с достаточной степенью
точности можно полагать эти величины постоянными.
Идеальная жидкость - это жидкость, не обладающая трением. При
движении жидкости без трения между отдельными ее соприкасающимися
слоями возникают только нормальные силы (давления), касательные же
силы (напряжения сдвига) отсутствуют. Это означает, что идеальная жид-
кость не оказывает изменению формы никакого внутреннего
сопротивления.
Теория движения идеальной жидкости математически очень глубоко
разработана и во многих случаях дает вполне удовлетворительную картину
действительных движений. В то же время она совершенно бессильна для
решения проблемы изучения сопротивления тела, движущегося в жидкости,
так как в этом случае приводит к результату, что тело, равномерно
движущееся в неограниченно распространенной жидкости, не испытывает
никакого сопротивления (парадокс Даламбера). Такой совершенно
неприемлемый результат теории идеальной жидкости объясняется тем, что в
действительных жидкостях между жидкостью и поверхностью обтекаемого
тела действуют не только нормальные, но и касательные силы, или, другими
словами, силы трения действительных жидкостей, которые связаны как раз с
таким свойством жидкости, как вязкость.
В идеальной жидкости касательные силы отсутствуют, поэтому на
поверхности соприкосновения твердого тела с жидкостью в общем случае
18
имеется разность касательных скоростей, т.е. происходит скольжение
жидкости вдоль стенки. Напротив, в действительной жидкости на
обтекаемую твердую стенку передаются касательные силы (силы трения), и
это приводит к тому, что жидкость прилипает к стенке.
Наличие касательных напряжений (напряжений сдвига) и прилипание
жидкости к твердым стенкам существенно отличают действительную
жидкость от идеальной. Некоторые жидкости, важные в практическом
отношении, например вода и особенно воздух, обладают малой вязкостью.
Течения таких маловязких жидкостей во многих случаях хорошо
совпадают с течениями идеальной жидкости, так как касательные силы в них
в общем являются очень малыми. Поэтому в теории идеальной жидкости
вязкость совершенно не учитывают, поскольку это проводит к
существенному упрощению уравнений движения, что позволяет построить
широкую математическую теорию. Необходимо, однако, подчеркнуть, что в
жидкостях даже с очень малой вязкостью в противоположность идеальной
жидкости прилипание к стенкам все же существует, что является физической
причиной указанного выше несоответствия между законами сопротивления
для действительной и идеальной жидкостей (парадокс Даламбера).
Сущность вязкости жидкости можно уяснить на опыте Куэтта.
Рассмотрим течение между двумя очень длинными параллельными плоскими
пластинами, из которых одна, например нижняя, неподвижна, в то время как
другая движется в собственной плоскости с постоянной скоростью υ (см.
рис 1).
Обозначим расстояние между пластинами через h и предположим, что
давление во всем пространстве, занимаемом жидкостью, постоянно. Опыт
показывает, что жидкость прилипает к обеим пластинам, следовательно,
непосредственно около нижней пластины скорость жидкости равна нулю, а
непосредственно около верхней пластины она совпадает со скоростью υ
верхней пластины. Далее опыт показывает, что в пространстве между
пластинами имеет место линейное распределение скоростей, т.е. скорость
пропорциональна расстоянию "у" от нижней пластины и выражается
формулой
y
υ (y) = υ.
h
Для того чтобы существовало такое состояние движения, к жидкости со
стороны верхней пластины должна быть приложена касательная сила в
19
направлении движения, уравновешивающая силы трения жидкости. На
основании результатов опыта эта сила (отнесенная к единице площади
пластины) пропорциональна скорости υ верхней пластины и обратно
пропорциональна расстоянию h между пластинами. Следовательно, сила
трения τ, отнесенная к единице площади, т.е. касательное напряжение,
пропорционально отношению υ/h, вместо которого можно взять отношение
dυ/dy. Множитель пропорциональности между τ и dυ/dy, обозначенный
через μ, зависит от природы жидкости. Он мал для так называемых мало-
вязких жидкостей, например для воды и спирта, и напротив велик для очень
вязких жидкостей, например для масла и глицерина. Таким образом, имеем
элементарный закон трения жидкости в следующем виде:
τ = μ dυ .
dy
Величина μ[Па⋅с] называется динамическим коэффициентом вязкости и
представляет собой физическую характеристику жидкости. Закон трения,
выражаемый вышеприведенным равенством, называют законом Ньютона.
Необходимо подчеркнуть, что рассмотренное нами движение
представляет очень простой, частный случай. Течение, изображенное на
рис.1, называется движением чистого сдвига.
Во многих движениях жидкости, где наряду с силами вязкости
действуют также силы инерции, важную роль играет отношение вязкости μ к
плотности ρ, называемое кинематическим коэффициентом вязкости:
μ м 2 ⎡ cм 2
ν= , − С т о к с⎤ .
ρ ⎢
c ⎣ c ⎥
⎦
Необходимо отметить, что динамическая вязкость сильно зависит от
температуры, причем для жидкостей при повышении температуры она
уменьшается, а для газов - возрастает. Давление мало влияет на значения μ.
Аэрогидромеханика в своей общей части строится на двух основных
свойствах жидких и газообразных сред: непрерывности и текучести.
Свойства эти являются следствием внутренних процессов в действительных
жидкостях и газах и обусловлены особенностям их молекулярной структуры.
Механика жидкости и газа отвлекается от этих явлений, изучением
внутренних (молекулярных) движений жидкостей и газов занимается
специальный раздел физики - кинетическая теория жидкости и газа.
Основываясь на свойстве непрерывности распределения физических
(механических, термодинамических и др.) характеристик состояния и
движения в сплошной среде, аэрогидромеханика с целью упрощения рас-
смотрения некоторых специальных явлений допускает в ряде случаев
существование особых точек, линий и поверхностей, где непрерывность
может нарушаться. Таковы, например, ударные волны, схематизированные в
идеальных газах поверхностями разрыва параметров состояния и движения
газа. К числу такого рода исключений относятся вихревые слои,
представляющие поверхности скачкообразного изменения скорости в потоке,
и другие поверхности разрыва.
Принцип обращения движения. Метод Лагранжа изучения движения среды.


 .
. .
. .
. ,
, .
.
 .
.
 ,
, .
. .
.
 .
. .
. .
. .
. .
. .
. ,
, .
. .
. .
.