
- •Оксидиметрия.Перманганатометрия
- •1.Сколько граммов кристаллогидрата щавелевой кислоты нужно взять для приготовления 250 мл раствора с молярной концентрацией эквивалента 0,01 моль/дм3?
- •2.Рассчитать молярную концентрацию эквивалента раствора щавелевой кислоты, если для его приготовления навеску 3,2576 г h2c2o4*2h2o растворили в воде в мерной колбе объёмом 500 мл?
- •1.Рассчитать навеску перманганата калия, которая потребуется для приготовления 500 мл раствора с молярной концентрацией эквивалента 0,01 моль/дм3 для титрования в кислой среде?
- •2.Рассчитать молярную концентрацию эквивалента раствора перманганата калия, если для его приготовления навеску 1,67 г перманганата калия растворили в мерной колбе объёмом 500 мл (среда кислая)?
- •3.Рассчитать объём раствора kMnO4 с молярной концентрацией эквивалента 0,1 моль/дм3, который потребуется для приготовления 500 мл раствора с молярной концентрацией эквивалента 0,05 моль/дм3?
1.Рассчитать навеску перманганата калия, которая потребуется для приготовления 500 мл раствора с молярной концентрацией эквивалента 0,01 моль/дм3 для титрования в кислой среде?
-
Дано:
Решение:
V=500 мл=0,5 л
Сf=0,01 моль/дм3
m=?
1.Рассчитать молярную массу перманганата калия:
М = 39,09+54,94+16•4=158,03 г/моль
2. Рассчитать молярную массу эквивалента КМnО4:
f = 1/5
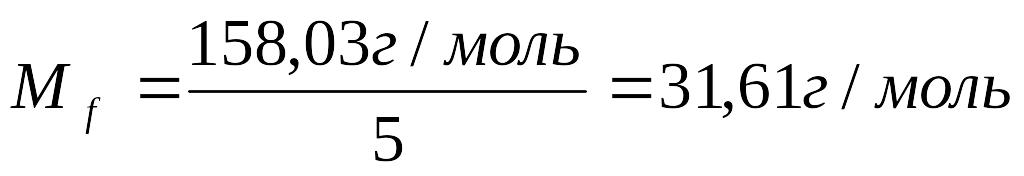
3.Рассчитать навеску, необходимую для приготовления раствора KMnO4:
m= Сf •Mf •V
m=0,01 моль/дм3 ∙ 31.61г/моль ∙ 0,5л =0,16 г.
Ответ: Для приготовления 500 мл раствора перманганата калия с Сf=0,01 моль/дм3 потребуется навеска m=0,16 г.
2.Рассчитать молярную концентрацию эквивалента раствора перманганата калия, если для его приготовления навеску 1,67 г перманганата калия растворили в мерной колбе объёмом 500 мл (среда кислая)?
-
Дано:
Решение:
m=1,67 г
V=500 мл
Сf=?
1.Записать молярную массу эквивалента перманганата калия:
М = 158.03 г/моль
f = 1/5
Mf = 31.61г/моль
2.Рассчитать число моль эквивалентов KMnO4 в навеске:
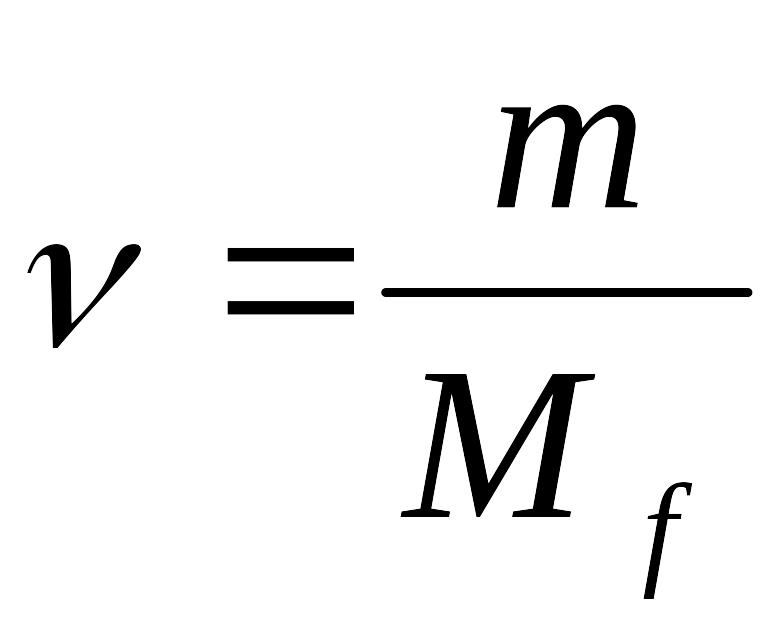

3.Рассчитать молярную концентрацию эквивалента KMnO4:
0,05 моль ____ 500 мл
Х моль ____ 1000 мл
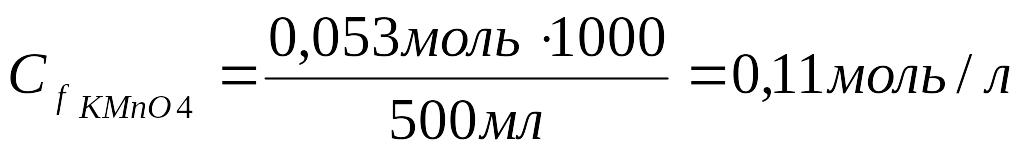
Ответ: : Молярная концентрация эквивалента раствора перманганата калия равна 0,11 моль/л.
3.Рассчитать объём раствора kMnO4 с молярной концентрацией эквивалента 0,1 моль/дм3, который потребуется для приготовления 500 мл раствора с молярной концентрацией эквивалента 0,05 моль/дм3?
-
Дано:
Решение:
Сfконц=0,1 моль/дм3
V разб =500 мл
Сf разб. =0,05моль/дм3
Vконц=?
I способ:
1.Рассчитать объём раствора:
Сfконц ∙ Vконц= Сf разб ∙ V разб
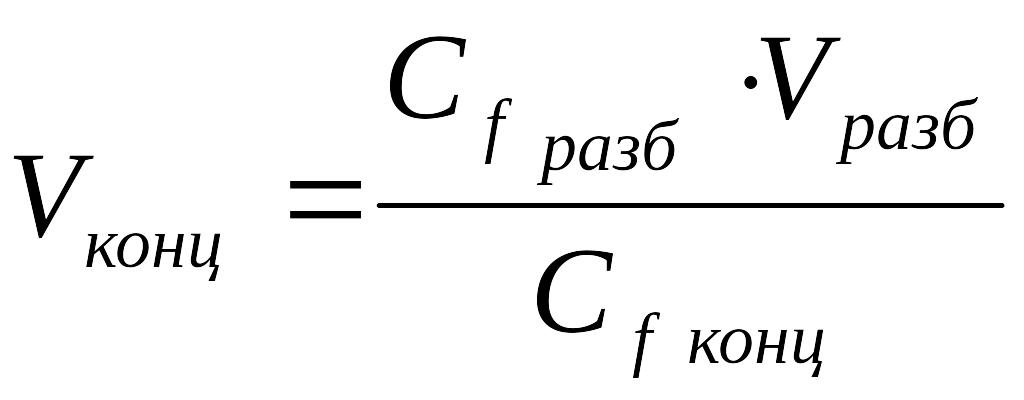

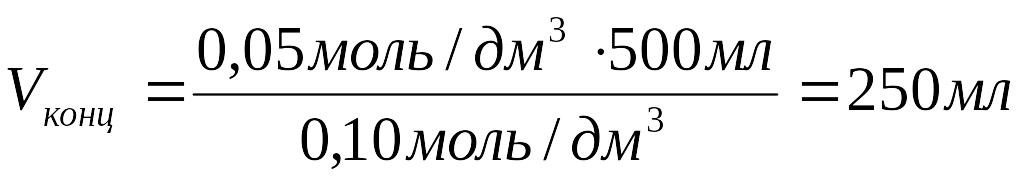
Ответ: Объём концентрированного раствора перманганата калия равен 250 мл.
II способ:
1.Рассчитать коэффициент разведения:
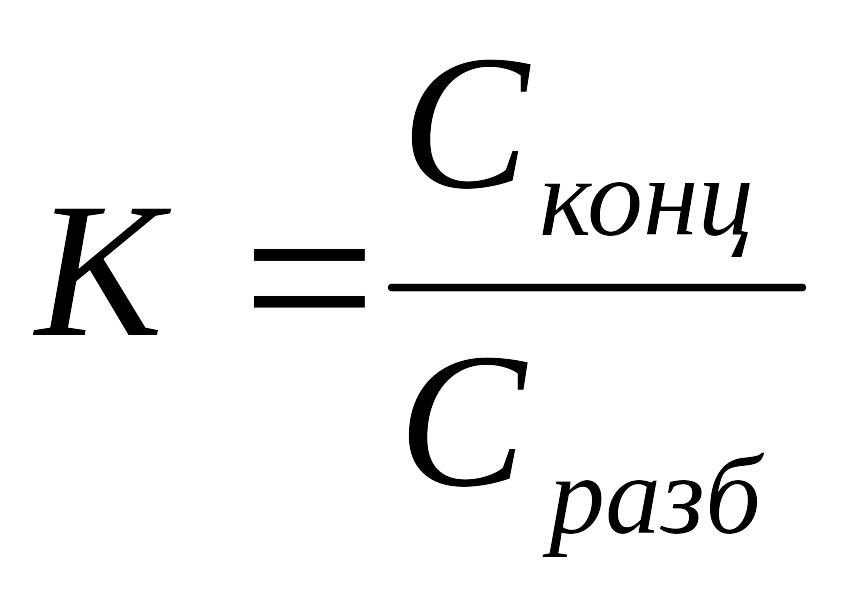
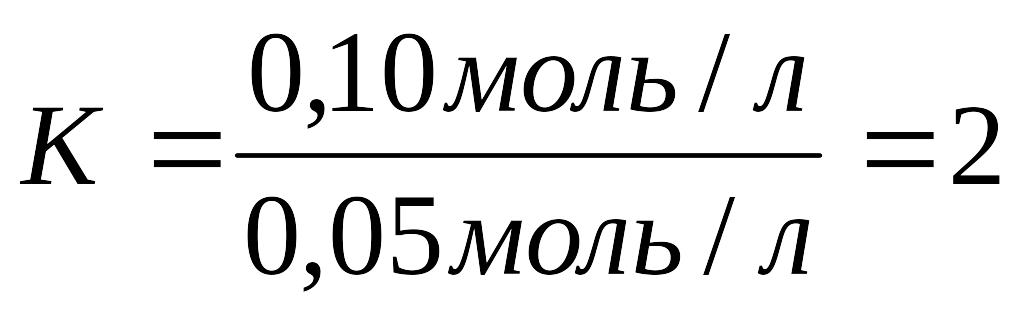
2. Рассчитать объём раствора:
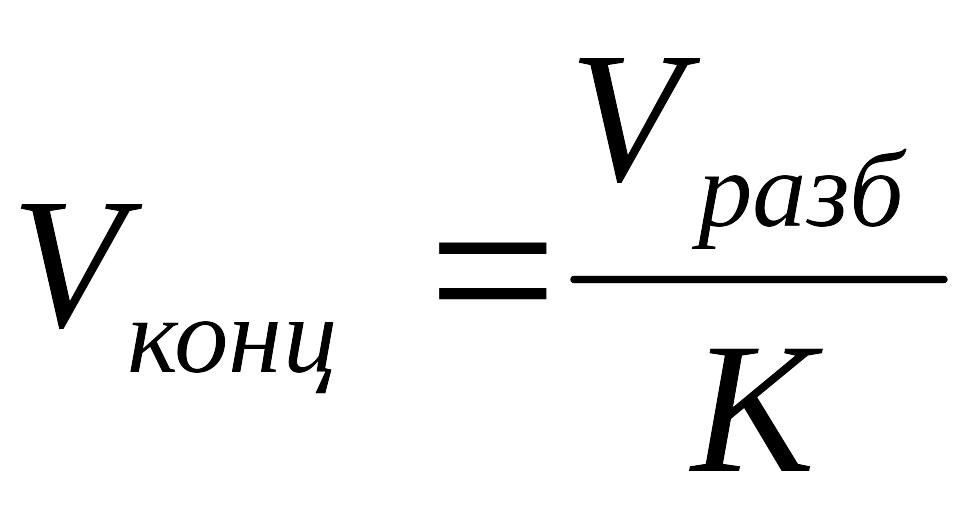
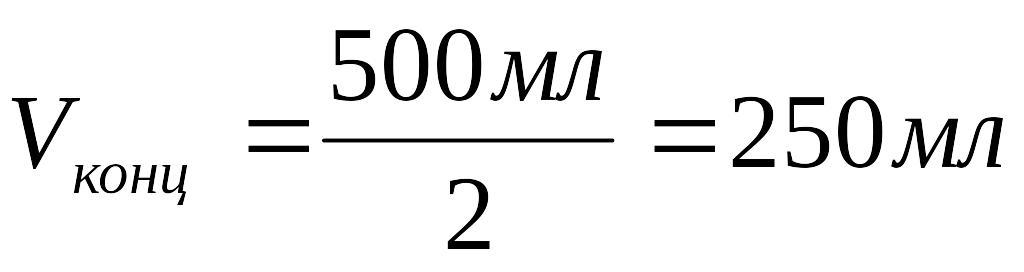
Ответ: Объём концентрированного раствора перманганата калия равен 250 мл.
Задачи для самостоятельного решения.
1.Рассчитать фактор эквивалентности и молярную массу эквивалента KMnO4 в среде:
а) кислой; б) нейтральной; в) щелочной?
2.Сколько граммов KMnO4 потребуется для приготовления 1000 мл раствора с молярной концентрацией эквивалента
0,05 моль/дм3 для титрования в кислой среде?
3.Рассчитать молярную концентрацию эквивалента раствора перманганата калия, если для его приготовления навеску
0,78 г KMnO4 растворили в воде в мерной колбе объёмом 250 мл? На каких весах нужно производить взвешивание?
4.Рассчитать объём раствора перманганата калия с молярной концентрацией эквивалента 0,1 моль/дм3, необходимого для приготовления 25 мл раствора с молярной концентрацией эквивалента 0,005 моль/дм3 для титрования в кислой среде?
5.Для анализа взяли 10 мл раствора перманганата калия с молярной концентрацией эквивалента 0,1 моль/дм3 и развели в воде в мерной колбе объёмом 200 мл. Определить концентрацию приготовленного раствора?
6.Рассчитать навеску KMnO4, которая потребуется для приготовления 2,5 л раствора с молярной концентрацией эквивалента 0,1 моль/дм3 для титрования в кислой среде?
7.Рассчитать молярную концентрацию эквивалента раствора перманганата калия, если для его приготовления навеску
0,81 г KMnO4 растворили в воде в мерной колбе объёмом 500 мл? На каких весах нужно производить взвешивание?
8.Рассчитать объём раствора перманганата калия с молярной концентрацией эквивалента 1 моль/дм3, необходимого для приготовления 250 мл раствора с молярной концентрацией эквивалента 0,02 моль/дм3 для титрования в кислой среде?
9.Для анализа взяли 2,5 мл раствора перманганата калия с молярной концентрацией эквивалента 1 моль/дм3 и развели в воде в мерной колбе объёмом 50 мл. Определить концентрацию приготовленного раствора?
10.Сколько граммов KMnO4 потребуется для приготовления 500 мл раствора с молярной концентрацией эквивалента
0,02 моль/дм3 для титрования в кислой среде?
11.Рассчитать молярную концентрацию эквивалента раствора перманганата калия, если для его приготовления навеску 0,34 г KMnO4 растворили в воде в мерной колбе объёмом 500 мл?
12.Рассчитать объём раствора перманганата калия с молярной концентрацией эквивалента 0,1 моль/дм3, необходимого для приготовления 50 мл раствора с молярной концентрацией эквивалента 0,02 моль/дм3 для титрования в кислой среде?
13.Для анализа взяли 5 мл раствора перманганата калия с молярной концентрацией эквивалента 1 моль/дм3 и развели в воде в мерной колбе объёмом 250 мл. Определить концентрацию приготовленного раствора?
14.Рассчитать навеску KMnO4, которая потребуется для приготовления 200 мл раствора с молярной концентрацией эквивалента 1 моль/дм3 для титрования в кислой среде?
15.Рассчитать молярную концентрацию эквивалента раствора перманганата калия, если для его приготовления навеску 1,60 г KMnO4 растворили в воде в мерной колбе объёмом 1000 мл? На каких весах нужно производить взвешивание?
16.Рассчитать молярную массу эквивалента в реакциях с KMnO4 в кислой среде: а)H2C2O4*2H2O; б)* Fe2+?
3.Определение концентрации рабочего раствора. |
Обучающие задачи |
1.При проведении анализа на титрование в кислой среде на 10,00 мл раствора кристаллогидрата щавелевой кислоты (Сf=0,1 моль/л; К=0,9876) израсходовали 10,15 мл рабочего раствора перманганата калия. Рассчитать молярную концентрацию эквивалента и титр рабочего раствора?
-
Дано:
Решение:
Vкислоты=10,00 мл
Сf кислоты=0,1 моль/л
К=0,9876
V KMnO4=10,15 мл
Т=?; Сf=?
1. Рассчитать молярную концентрацию эквивалента KMnO4 (Спрактич.):
Сf кислоты ∙ Vкислоты= Сf KMnO4∙ V KMnO4
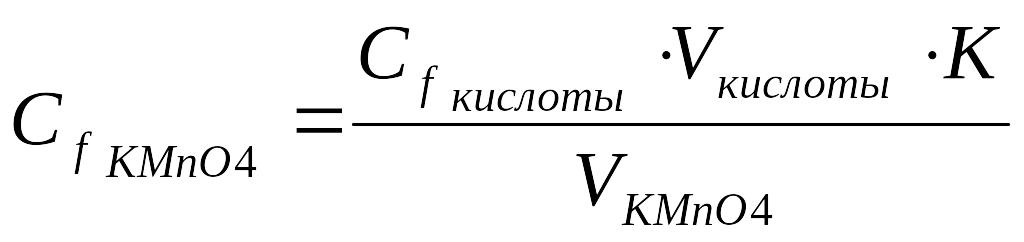
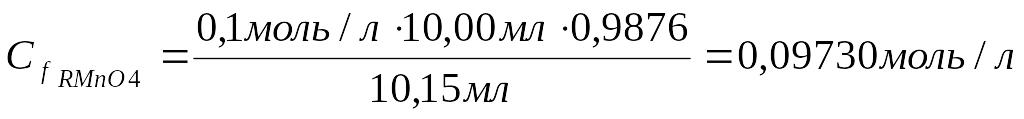
2. Записать молярную массу эквивалента KMnO4:
М = 158.03 г/моль
f = 1/5
Mf = 31.61г/моль
3. Рассчитать титр перманганата калия:
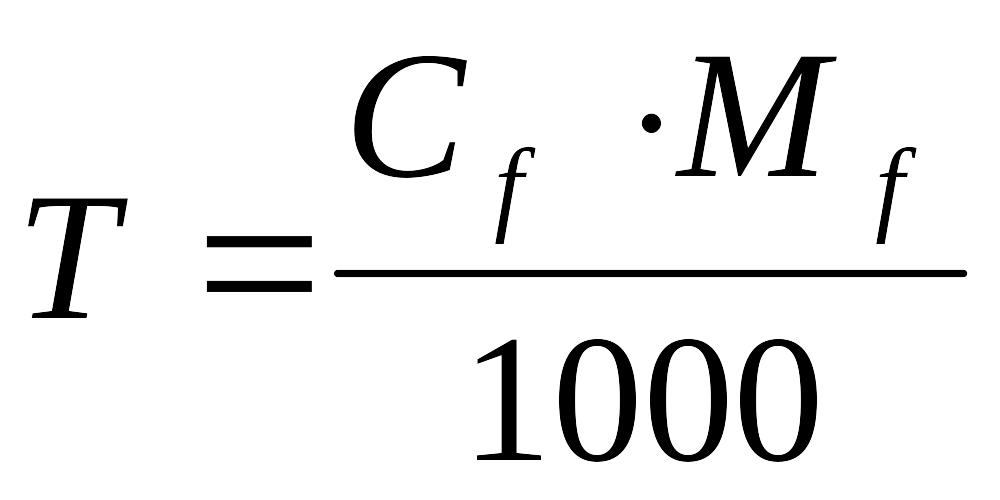
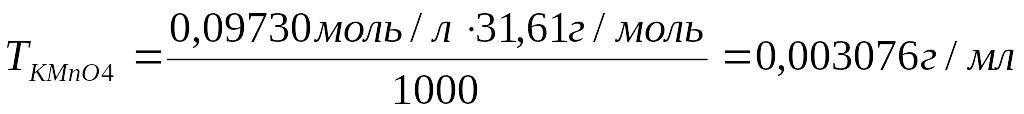
Ответ: Титр рабочего раствора равен 0,003076 г/мл; молярная концентрация эквивалента рабочего раствора равна 0,0973моль/л.
2.На титрование в кислой среде на 5,00 мл раствора кристаллогидрата щавелевой кислоты (Т=0,006789 г/мл) израсходовали 4,75 мл раствора перманганата калия. Рассчитать титр и молярную концентрацию эквивалента рабочего раствора?
-
Дано:
Решение:
Vкислоты= 5,00 мл
Ткислоты=0,006789 г/мл
V KMnO4.= 4,75 мл
Т=?; Сf=?
1. Записать молярную массу эквивалента H2C2O4*2H2O:
М = 126.06 г/моль
f = 1/2
Mf = 63.03 г/моль
2.Рассчитать молярную концентрацию эквивалента щавелевой кислоты:
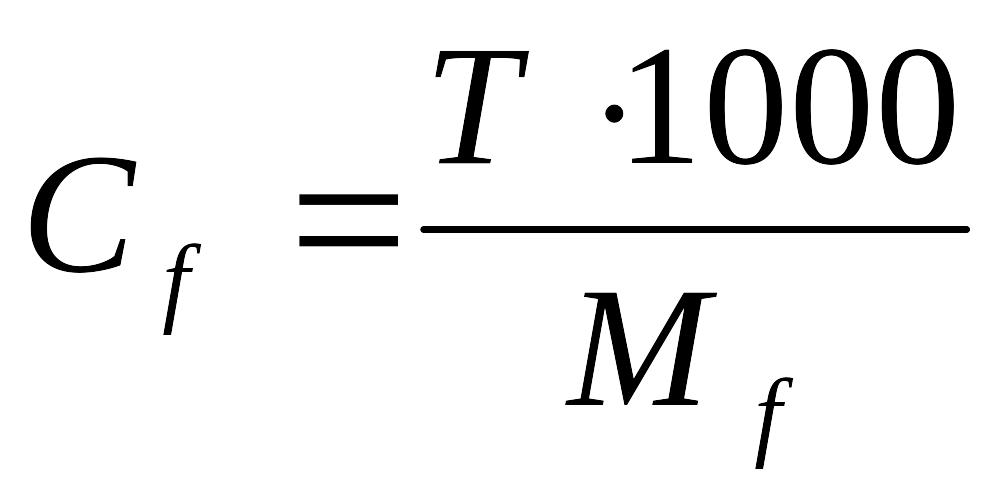
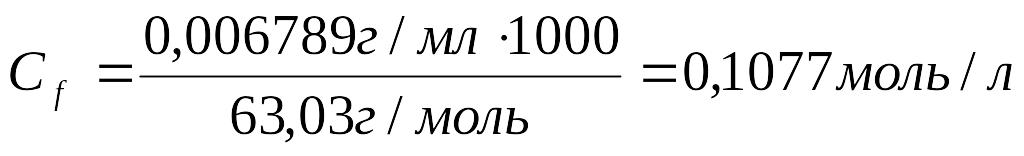
3.Рассчитать молярную концентрацию эквивалента KMnO4:
Сf кислоты ∙ Vкислоты= Сf KMnO4 ∙ V KMnO4

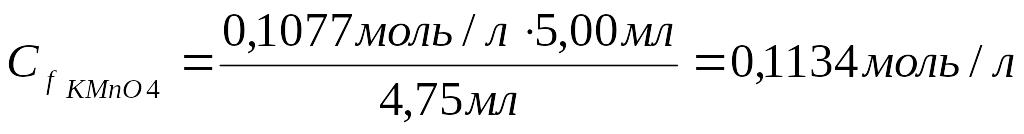
4.Записать молярную массу эквивалента KMnO4:
М = 158,03 г/моль
f = 1/5
Mf = 31,61г/моль
5.Рассчитать титр перманганата калия:
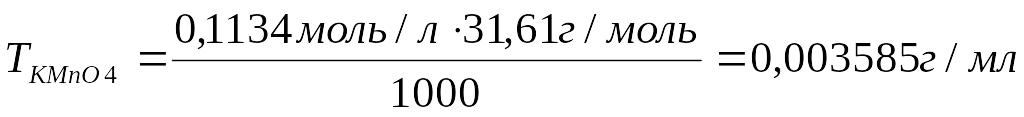
Ответ: Титр рабочего раствора равен 0,003585 г/мл; молярная концентрация эквивалента рабочего раствора равна 0,1134моль/л.
3.Для приготовления исходного раствора навеска кристаллогидрата щавелевой кислоты 0,7798 г растворена в воде в мерной колбе объёмом 250 мл. На титрование 10,00 мл этого раствора израсходовали 9,90 мл рабочего раствора KMnO4. Рассчитать молярную концентрацию эквивалента и титр раствора перманганата калия?
-
Дано:
Решение:
m=0,7798 г
Vколбы=250 мл
Vкислоты=10,00 мл
V KMnO4=9,90 мл
Т=?; Сf=?
1. Рассчитать титр щавелевой кислоты:
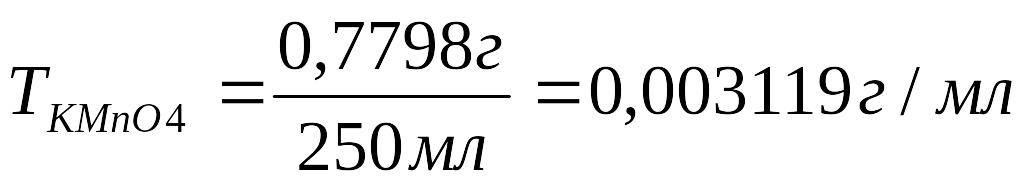
2.Записать молярную массу эквивалента щавелевой кислоты:
М = 126.06 г/моль
f = 1/2
Mf = 63.03 г/моль
3. Рассчитать молярную концентрацию эквивалента щавелевой кислоты:
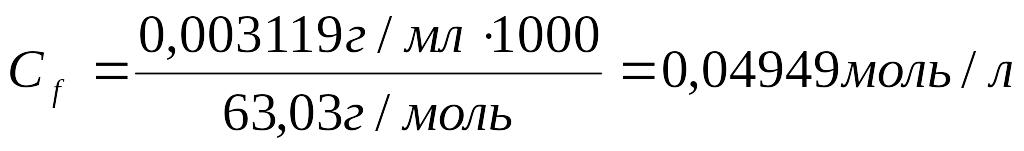
4. Рассчитать молярную концентрацию эквивалента KMnO4 по закону эквивалентов:
Сf кислоты ∙ Vкислоты= Сf KMnO4∙ V KMnO4
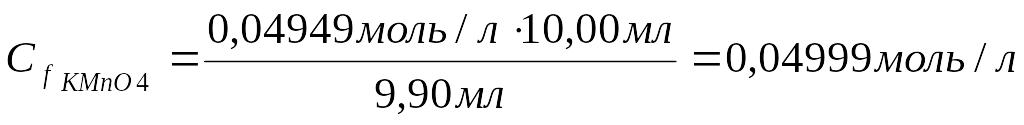
5.Записать молярную массу эквивалента KMnO4:
М = 158.03 г/моль
f = 1/5
Mf = 31.61г/моль
6. Рассчитать титр перманганата калия:
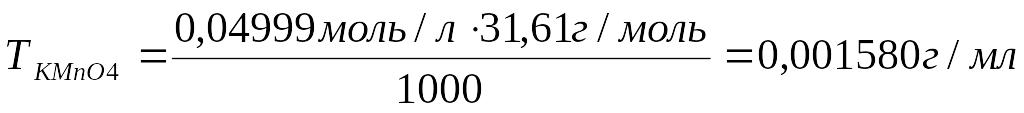
Ответ: Титр раствора перманганата калия равен 0,001580 г/мл; молярная концентрация эквивалента раствора перманганата калия равна 0,04999 моль/л.
Задачи для самостоятельного решения.
1.На титрование в кислой среде на 5,00 мл раствора кристаллогидрата щавелевой кислоты (Сf=0,05 моль/дм3; К=0,9789) израсходовали 4,90 мл раствора KMnO4. Рассчитать титр и молярную концентрацию эквивалента раствора перманганата калия?
2.На титрование в кислой среде на 10,00 мл раствора кристаллогидрата щавелевой кислоты (Т=0,006239 г/мл) израсходовали 9,95 мл раствора KMnO4. Рассчитать титр и молярную концентрацию эквивалента раствора перманганата калия?
3.Для приготовления исходного раствора, навеска кристаллогидрата щавелевой кислоты 0,7896 г растворена в воде в мерной колбе объёмом 250 мл. На 20.00 мл приготовленного раствора при титровании в кислой среде расходуется 21,20 мл раствора перманганата калия. Определить молярную концентрацию эквивалента и титр рабочего раствора?
4.При проведении анализа на титрование 10,00 мл раствора кристаллогидрата оксалата аммония (Сf =0,5 моль/дм3;К=0,9748) израсходовали 9,75 мл раствора перманганата калия (среда кислая). Рассчитать молярную концентрацию эквивалента и титр рабочего раствора?
5.При титровании 5,00 мл исходного раствора (NH4)2C2O4•H2O (Т=0,007015 г/мл) израсходовали 4,75 мл рабочего раствора (среда кислая). Рассчитать титр и молярную концентрацию эквивалента раствора перманганата калия?
6.Навеска 1,2875 г оксалата натрия растворена в воде в мерной колбе объёмом 200 мл. На титрование в кислой среде на 20,00 мл этого раствора расходуется 22,40 мл раствора перманганата калия. Рассчитать молярную концентрацию эквивалента и титр рабочего раствора?
7.На титрование в кислой среде на 20,00 мл раствора оксалата натрия (Сf=0,1 моль/дм3; К=0,9856) израсходовали 19,75 мл раствора KMnO4. Рассчитать титр и молярную концентрацию эквивалента раствора перманганата калия?
8.На титрование в кислой среде на 10,00 мл раствора оксалата натрия (Т=0,003415 г/мл) израсходовали 10,35 мл раствора KMnO4. Рассчитать титр и молярную концентрацию эквивалента раствора перманганата калия?
9.Для приготовления исходного раствора, навеска кристаллогидрата оксалата аммония 1,7610иг растворена в воде в мерной колбе объёмом 500 мл. На 5,00 мл приготовленного раствора при титровании в кислой среде расходуется 5,25 мл раствора перманганата калия. Определить молярную концентрацию эквивалента и титр рабочего раствора?
10.При проведении анализа на титрование 10,00 мл раствора кристаллогидрата щавелевой кислоты (Сf =0,25 моль/дм3;К=0,9983) израсходовали 10,45 мл раствора перманганата калия (среда кислая). Рассчитать молярную концентрацию эквивалента и титр рабочего раствора?
11.При титровании 20,00 мл исходного раствора кристаллогидрата оксалата аммония (Т=0,01712 г/мл) израсходовали 19,90 мл рабочего раствора (среда кислая). Рассчитать титр и молярную концентрацию эквивалента раствора перманганата калия?
12.Навеска 6,3595 г кристаллогидрата щавелевой кислоты растворена в воде в мерной колбе объёмом 1000 мл. На титрование в кислой среде на 10,00 мл этого раствора расходуется 10,70 мл раствора перманганата калия. Рассчитать молярную концентрацию эквивалента и титр рабочего раствора?
13.На титрование в кислой среде на 5,00 мл раствора оксалата аммония (Сf=0,05 моль/дм3; К=0,9952) израсходовали
5,35 мл раствора KMnO4. Рассчитать титр и молярную концентрацию эквивалента раствора перманганата калия?
14.На титрование в кислой среде на 5,00 мл раствора кристаллогидрата щавелевой кислоты (Т=0,003342 г/мл) израсходовали 4,65 мл раствора KMnO4. Рассчитать титр и молярную концентрацию эквивалента раствора перманганата калия?
15.Для приготовления исходного раствора, навеска оксалата натрия 0,8545 г растворена в воде в мерной колбе объёмом 250 мл. На 20,00 мл приготовленного раствора при титровании в кислой среде расходуется 19,80 мл раствора перманганата калия. Определить молярную концентрацию эквивалента и титр рабочего раствора?
*16.Навеска оксалата натрия, марки «хч», 0,1349 г растворена в воде в мерной колбе объёмом 200 мл. При титровании в кислой среде на 10,00 мл приготовленного раствора расходуется 9,57 мл раствора перманганата калия (Сf=0,01 моль/л; К=0,9943). Рассчитать: 1) молярную концентрацию эквивалента оксалата натрия в растворе? 2) массовую долю оксалата натрия в растворе?
4. Определение концентрации вещества в пробе. |
Обучающие задачи |
1.Для проведения анализа лаборант взял 10,00 мл пробы воды и оттитровал в кислой среде раствором перманганата калия. На титрование пробы пошло 10,25 мл рабочего раствора (Т=0,00160 г/мл). Рассчитать массовую концентрацию железа (II) в пробе: мг/л; г/л?
-
Дано:
Решение:
Vпробы=10,00 мл
V KMnO4.=10,25 мл
ТKMnO4.=0,00160 г/мл
Сf (Fe2+)=?; мг/л, г/л?
1. Записать молярную массу эквивалента KMnO4:
М = 158.03 г/моль
f = 1/5
Mf = 31.61г/моль
2.Рассчитать молярную концентрацию эквивалента KMnO4:
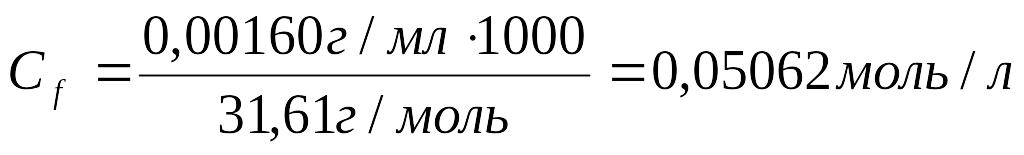
3. Рассчитать молярную концентрацию эквивалента железа (II) по закону эквивалентов:
Сf Fe2+ ∙ V Fe2+.= Сf KMnO4 ∙ V KMnO4
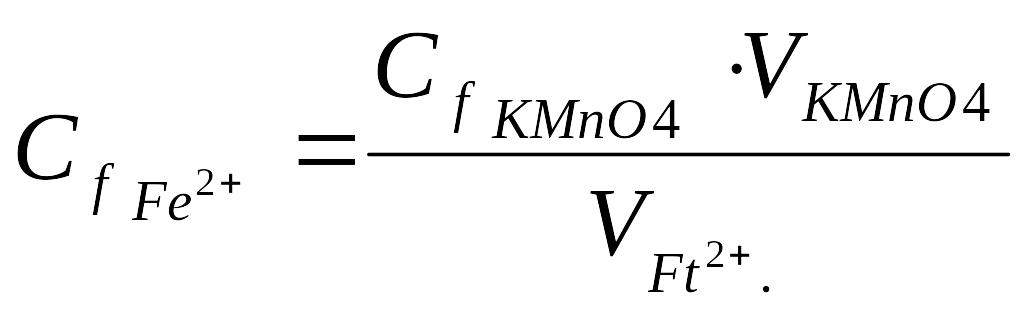
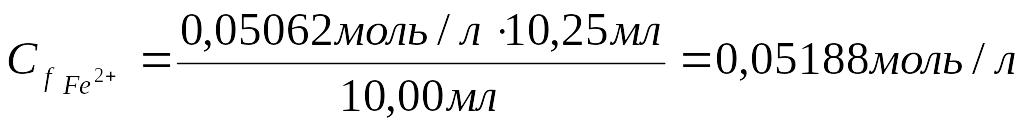
4.Записать молярную массу эквивалента железа (II):
М = 55,85 г/моль
f = 1
Mf = 55,85 г/моль
5. Рассчитать массовую концентрацию железа (II) (мг/л; г/л):
Сm = Сf ∙ Mf
Сm(Fe2+).= 0,05188 моль/л ∙ 55,85 г/моль=2,898 г/л
2,8986 г/л ∙ 1000=2898 мг/л
Ответ: массовая концентрация железа (II) в пробе равна Сm(Fe2+).= 2,898 г/л;
2898 мг/л
2.Поступила проба сточной воды, содержащая нитрит калия. На титрование в кислой среде на 5,00 мл этой пробы израсходовано 4,85 мл раствора перманганата калия (Сf=0,05 моль/л; К=1,0457). Рассчитать массовую концентрацию нитрита калия в пробе: мг/мл, г/л, мг/мл?
-
Дано:
Решение:
Vпробы=15,00 мл
V KMnO4.=14,85 мл
СfKMnO4.=0,05 моль/л;
К=1,0457
Сf нитрита =?; мг/мл, г/л, мг/мл.
1. Рассчитать молярную концентрацию эквивалента нитрита калия (Спрактич.):
Сf нитрита ∙ V нитрита = Сf KMnO4. ∙ V KMnO4
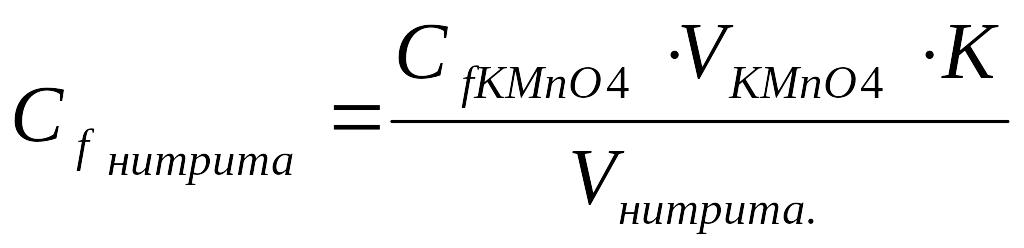
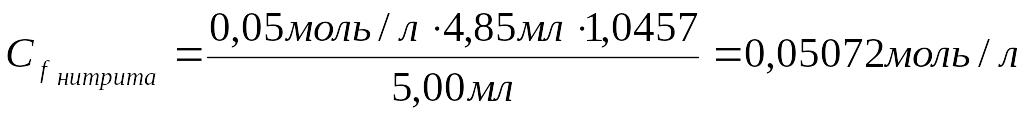
2. Записать молярную массу эквивалента нитрита калия:
М = 85,11 г/моль
f = 1
Mf = 85,11 г/моль
3. Рассчитать массовую концентрацию нитрита калия (мг/л; г/л; мг/мл):
Сm = Сf ∙ Mf
Сm нитрита = 0,05072 моль/л ∙ 85,11 г/моль=4,317 г/л
4,317 г/л ∙ 1000=4317мг/л
4,317 мг/мл
Ответ: массовая концентрация нитрита калия в пробе равна : Сm нитрита = 4,317 г/л
4317мг/л
4,317 мг/мл
Задачи для самостоятельного решения.
1.Для проведения анализа взяли 10,00 мл пробы сточной воды, поместили в мерную колбу объёмом 250 мл и довели до метки дистиллированной водой. На титрование в кислой среде на 10,00 мл этого раствора израсходовали 9,80 мл раствора KMnO4 (К=0,9967;Сf=0,05 моль/дм3).Рассчитать массовую концентрацию железа (II) в пробе сточной воды: г/л, мг/мл,?
2.Для анализа взяли 5,00 мл сточной воды. На титрование в кислой среде на 5,00 мл этой пробы израсходовано 4,75 мл раствора KMnO4 (Т= 0,003164 г/мл). Рассчитать массовую концентрацию железа (II) в пробе: мг/л, г/л, мг/мл?
3.Поступила проба сточной воды, содержащая перекись водорода. На титрование в кислой среде на 10,00 мл этой пробы израсходовано 5,15 мл раствора перманганата калия (Сf=0,1 моль/дм3;К=0,9743).Рассчитать массовую концентрацию перекиси водорода в пробе: мг/л, г/л, мг/мл?
4.На титрование в кислой среде на 20,00 мл пробы израсходовали 19,85 мл KMnO4 (Т=0,0003243 г/мл). Рассчитать титр и массовую концентрацию нитрита калия в пробе: мг/мл; г/л
5.Для проведения анализа взяли 20,00 мл пробы сточной воды, поместили в мерную колбу объёмом 200 мл и довели до метки дистиллированной водой. На титрование в кислой среде на 5,00 мл этого раствора израсходовали 5,30 мл раствора KMnO4 (К=0,9876; Сf=0,25 моль/дм3).Рассчитать массовую концентрацию нитрита калия в пробе сточной воды: г/л, мг/мл?
6.Для анализа взяли 1000 мл сточной воды. На титрование в кислой среде на 10,00 мл этой пробы израсходовано 9,95 мл раствора KMnO4 (Т= 0,001613 г/мл). Рассчитать массовую концентрацию перекиси водорода в пробе: мг/л, г/л, мг/мл?
7.Поступила проба сточной воды, содержащая железо (II). На титрование в кислой среде на 20,00 мл этой пробы израсходовано 20,45 мл раствора перманганата калия (Сf=0,01моль/дм3;К=0,9879).Рассчитать массовую концентрацию железа (II) в пробе: мг/л, г/л, мг/мл?
8.На титрование в кислой среде на 5,00 мл пробы израсходовали 5,20 мл KMnO4 (Т=0,007798 г/мл) Рассчитать титр и массовую концентрацию нитрита калия в пробе: мг/мл; г/л?
9.Для проведения анализа взяли 5,00 мл пробы сточной воды, поместили в мерную колбу объёмом 50 мл и довели до метки дистиллированной водой. На титрование в кислой среде на 10,00 мл этого раствора израсходовали 10,55 мл раствора KMnO4 (К=1,0098;Сf=0,05 моль/дм3).Рассчитать массовую концентрацию перекиси водорода в пробе сточной воды: г/л, мг/мл,?
10.Для анализа взяли 250 мл сточной воды. На титрование в кислой среде на 20,00 мл этой пробы израсходовано 20,75 мл раствора KMnO4 (Т= 0,003257 г/мл). Рассчитать массовую концентрацию железа (II) в пробе: мг/л, г/л, мг/мл?
11.Поступила проба сточной воды, содержащая нитрит калия. На титрование в кислой среде на 5,00 мл этой пробы израсходовано 4,90 мл раствора перманганата калия (Сf=0,1 моль/дм3;К=0,9989).Рассчитать массовую концентрацию нитрита калия в пробе: мг/л, г/л, мг/мл?
12.На титрование в кислой среде на 10,00 мл пробы израсходовали 9,65 мл KMnO4 (Т=0,001564 г/мл) Рассчитать титр и массовую концентрацию перекиси водорода в пробе: мг/мл; г/л?
13Для проведения анализа лаборант взял 5 мл рабочего раствора (Сf=1 моль/дм3) и развёл его в колбе объёмом 100 мл. Полученным раствором он оттитровал пробу воды на содержание нитрита калия. На титрование 5,00 мл пробы израсходовали 5,25 мл раствора перманганата калия. Рассчитать массовую концентрацию нитрита калия в пробе: мг/л, мг/мл, г/мл?
14.Для проведения анализа лаборант взял 2,5 мл рабочего раствора (Сf=0,1 моль/дм3) и развёл его в колбе объёмом 25 мл. Полученным раствором он оттитровал пробу воды на содержание перекиси водорода. На титрование 10,00 мл пробы израсходовали 9,75 мл раствора перманганата калия. Рассчитать массовую концентрацию перекиси водорода в пробе: мг/л, мг/мл,?
