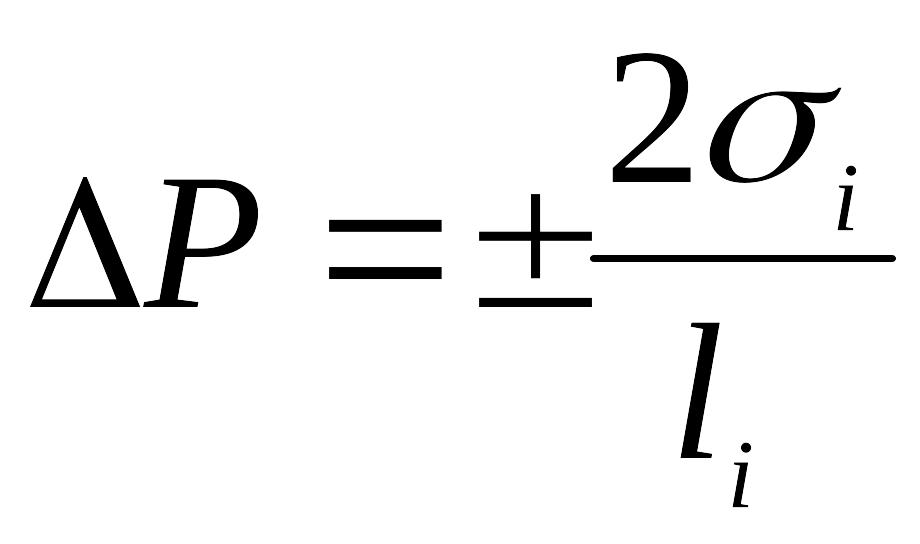Адсорбція
1. Розрізняють адсорбцію:
газів на твердих тілах
розчинених у рідині речовин на твердих тілах
твердих часток на твердій поверхні
газу на поверхні рідини
2. Ізотерма адсорбції це функція залежності
адсорбції від температури речовини в обємі при постійному тиску
концентрації речовини в обємі при постійній температурі
адсорбції від концентрації речовини в обємі при постійній температурі.
адсорбції від температури при постійній концентрації речовини в обємі
3. Рівняння Ленгмюра використовується у випадку
Адсорбції в мономолекулярному шарі
Адсорбції понад мономолекулярний шар
При малих концентраціях
4. Поверхні іонних кристалів добре адсорбують
Полярні молекули
Неполярні молекули
Воду
5. Адсорбцією називають
процес мимовільного перерозподілу компонентів системи між поверхневим шаром і об'ємною фазою
Процес перерозподілу компонентів між приведеними в контакт фазами, що відбувається внаслідок прагнення до зниження поверхневої енергії.
Процес проникнення газів або розчинених у рідині речовин у пористе середовище
Процес мимовільного перерозподілу речовин, що знаходяться на поверхні, унаслідок прагнення системи до зниження поверхневої енергії.
6. Фундаментальне адсорбційне рівняння Гіббса пов'язує
Збільшення абсорбції і збільшення хімічного потенціалу
Збільшення поверхневої енергії і збільшення хімічного потенціалу
Збільшення поверхневої енергії і збільшення концентрації
Збільшення поверхневої енергії і збільшення площі поверхні
7. Адсорбент це
Речовина, що здатна переходити з обєму фази на міжфазну поверхню під дією надлишкової енергії Гіббса
Пористе середовище з високою питомою поверхнею
Речовина, що здатна переходити з однієї фази в іншу під дією надлишкової енергії Гіббса
Більш щільна з двох фаз, на поверхні якої відбувається адсорбція.
8. Для кількісного опису величини адсорбції застосовують поняття:
Питома поверхня
Відношення кількості молей речовини адсорбата до одиниці маси або поверхні адсорбенту.
Відношення надлишку речовини в поверхневому шарі в порівнянні з його кількістю в такому ж обємі до одиниці маси або поверхні адсорбенту.
Кількість речовини в поверхневому шарі в залежності від концентрації або парціального тиску цього компонента в обємі
9. Адсорбат це
Речовина, здатна переходити з обєму рідкої або газоподібної фази на міжфазну поверхню задля зменшення енергії Гіббса
пористе середовище з високою питомою поверхнею, на поверхні якої можуть осідати молекули або атоми іншої речовини
речовина, що осідає або перерозподіляється на поверхні адсорбенту через дію надлишкової поверхневої енергії.
більш щільна з двох дотичних фаз, на поверхні якої відбувається адсорбція.
10. Рівняння адсорбції БЭТ використовується у випадку
відсутності адсорбції понад мономолекулярний шар
адсорбції понад мономолекулярний шар
при малих концентраціях
11. ізотерма адсорбції це функція залежності
адсорбції від температури речовини в об'ємі при постійному тиску
концентрації речовини на поверхні від тиску при постійній температурі
адсорбції від концентрації речовини в об'ємі при постійній температурі.
адсорбції від температури при постійній концентрації речовини в об'ємі
12. На поверхні оксидів добре втримується
вода
спирти
аміни
13. Адсорбційні характеристики адсорбенту поліпшуються при
Підвищенні тиску
Збільшенні питомої поверхні
Зменшенні питомої поверхні
Збільшенні дисперсності
14. Ізопікною є залежність
15. Ізостера адсорбції це функція залежності
адсорбції від температури речовини в об'ємі при постійному тиску
концентрації речовини в об'ємі від температури при постійній адсорбції
адсорбції від концентрації речовини в об'ємі при постійній температурі.
17 У адсорбційному рівнянні Гіббса адсорбція
- пропорційна концентрації й похідній від поверхневої енергії по концентрації
- зворотно пропорційна температурі
- пропорційна концентрації
- зворотно - пропорційна температурі й похідній від поверхневої енергії по концентрації
- пропорційна концентрації й поверхневій енергії
18 Умові, що концентрація розчиненої речовини на поверхні нижче, ніж у самому розчині відповідає вираз
Рівняння Кельвіна – Томсона, Лапласовський тиск, дисперсні системи
1. Вибрати правильні вирази рівняння Кельвіна - Томсона
![]()
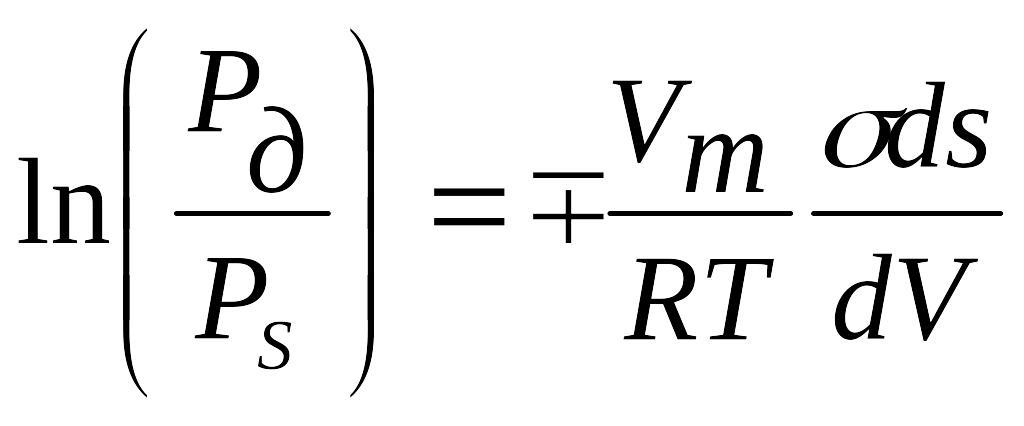
![]()

2. Вибрати правильний варіант руху речовини через газову фазу усередині пори при нагріванні (Відповідно до рівняння капілярної конденсації)


4. Зі збільшенням дисперсності вільно-дисперсної системи кривизна поверхні часток
Не змінюється
Зменшується
Зростає
5. Вибрати правильні вирази для визначення Лапласівського тиску
![]()
![]()
![]()
![]()
6. Виберіть логічні напрямки випару-конденсації речовини
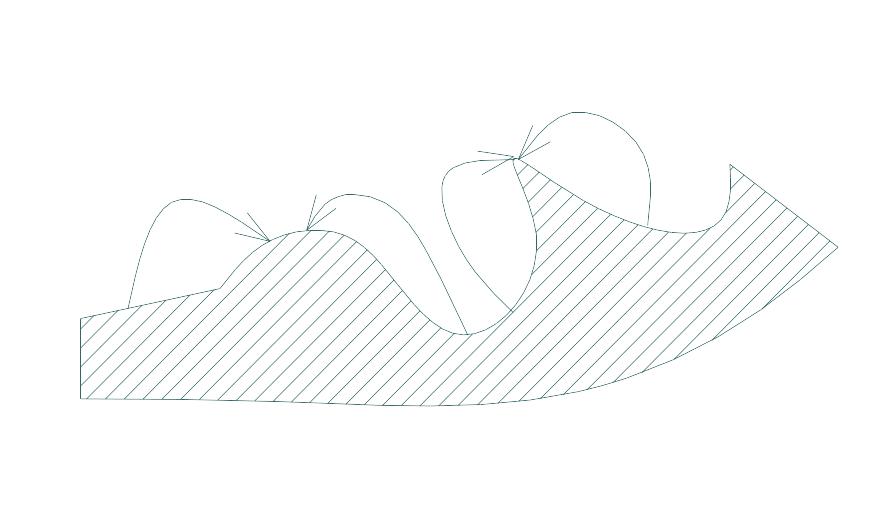
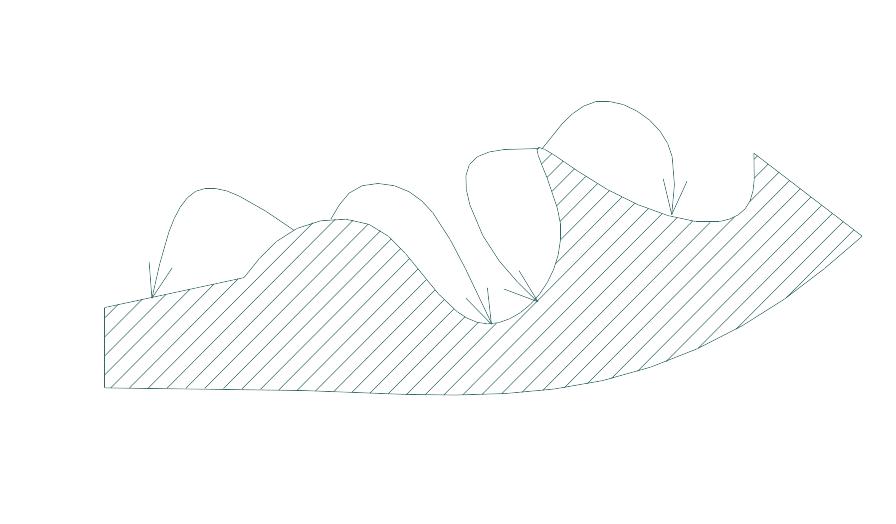
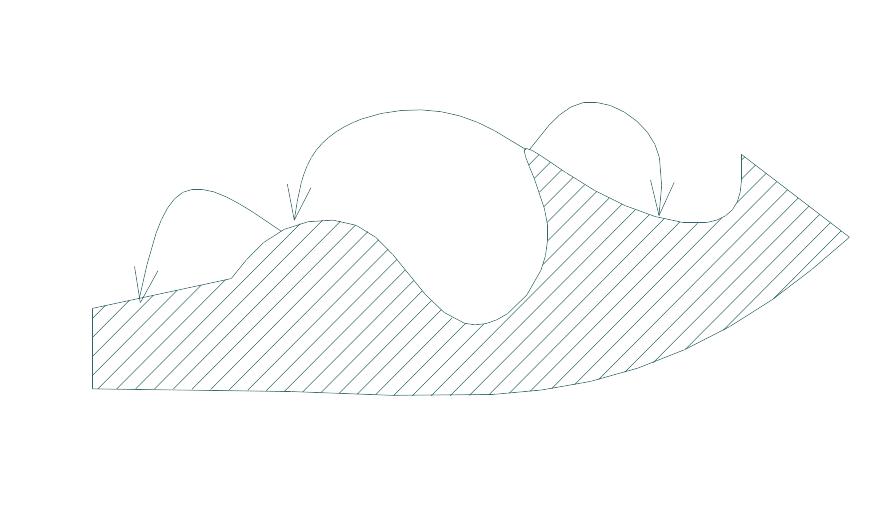
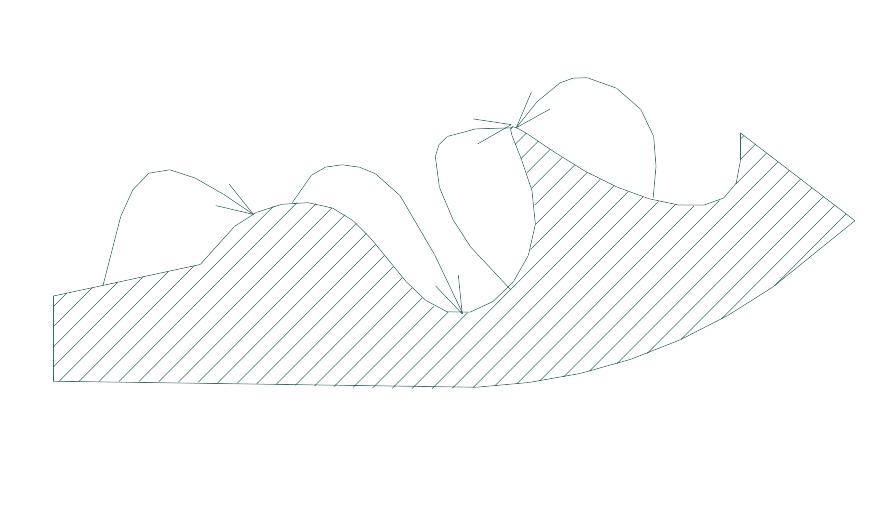
7. Вказати правильну формулу для визначення критичного ступеня пересичення
![]()
![]()
![]()
![]()
8. При якій умові для утворення зародка не потрібне пересичення
при наявності домішок з кутом змочування зародком рівним 900
при наявності домішок з кутом змочування зародком рівним 00
при малих концентраціях зародків
при наявності домішок з кутом змочування зародком рівним 1800
при наявності поверхнево-активних речовин
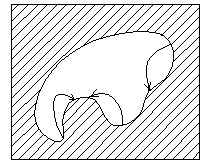
10. Вкажіть правильні напрямки руху речовини під дією Лапласівського тиску

Напрямок 1
Напрямок 2
Напрямок 3
Напрямок4
Напрямок 5
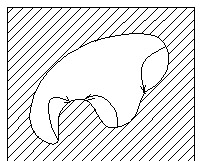
1 1.
Вкажіть
крапку на поверхні з максимальним
внутрішнім Лапласівським тиском
1.
Вкажіть
крапку на поверхні з максимальним
внутрішнім Лапласівським тиском
Крапка 1
Крапка 2
Крапка 3
Крапка 4
12. Температура плавлення дисперсної частки залежить від
мольного об’єму
розміру частки
густини речовини
поверхневої енергії
питомої поверхні
13. Для визначення яких параметрів можна використати Формулу Жюрена
Діаметра капіляра
В'язкості рідини
поверхневого натягу
питомої поверхні
розмірів пор
14. Приклади вільно-дисперсних систем
Суспензії.
Аерозолі
Порошки
Пінопласти
Газові емульсії
розчини
15. Розходження температури плавлення дисперсної мікрочастинки й макрочастки з одного матеріалу залежить від
мольного об'єму
розміру частки
густини речовини
поверхневої енергії
питомої поверхні
16. При малій швидкості утворення зародків і великій швидкості їхнього росту
утвориться аморфна структура
виникає мале число великих зародків
виникає велика кількість дрібних зародків
виникає мале число дрібних зародків
17 Які вирази є законом Вульфа
18 Розставити сферичні частки в порядку зростання в їхньої поверхні Лапласівського тиску
Пора діаметром 1 мкм
Частка діаметром 1 мкм
Пора діаметром 10 мкм
Частка діаметром 10 мкм
19. Збільшенню інтенсивності конденсації рідини в капілярній системі при її змочуванні сприяють
зниження поверхневого натягу
збільшення дисперсності
збільшення мольного об'єму рідини
20. Механізм перетікання рідини відбувається завдяки
Різниці лапласовського капілярного тиску на різних ділянках системи із двох сфер і перемички.
Різниці концентрації вакансій.
Механізму випару - конденсації
Переміщенню легко рухливих атомів, що перебувають у стані адсорбції (адатоми) у тонкому приповерхньому шарі, де у зв'язку з наявністю дефектів структури дифузійна рухливість атомів перевершує їхня рухливість в об'ємі
21. Рівняння Кельвіна - Томсона визначає
залежність реакційної здатності від дисперсності
залежність швидкості випару від дисперсності
залежність швидкості розчинення від дисперсності
залежність поверхневої енергії від дисперсності
22. Рівняння Кельвіна - Томсона
Визначає спрямованість процесу ізотермічної перегонки
Визначає закономірності зміни розчинності при зміні дисперсності
Визначає закономірності адсорбції при зміні дисперсності
Визначає вплив дисперсності на температуру фазового переходу
23. Критичний радіус зародка збільшується при
Збільшенні поверхневого натягу
Збільшенні мольного об'єму
Збільшенні температури
Збільшенні ступеня пересичення
24. Переходу речовини в аморфний стан сприяють
швидке охолодження
повільне охолодження
малі пересичення
високі пересичення