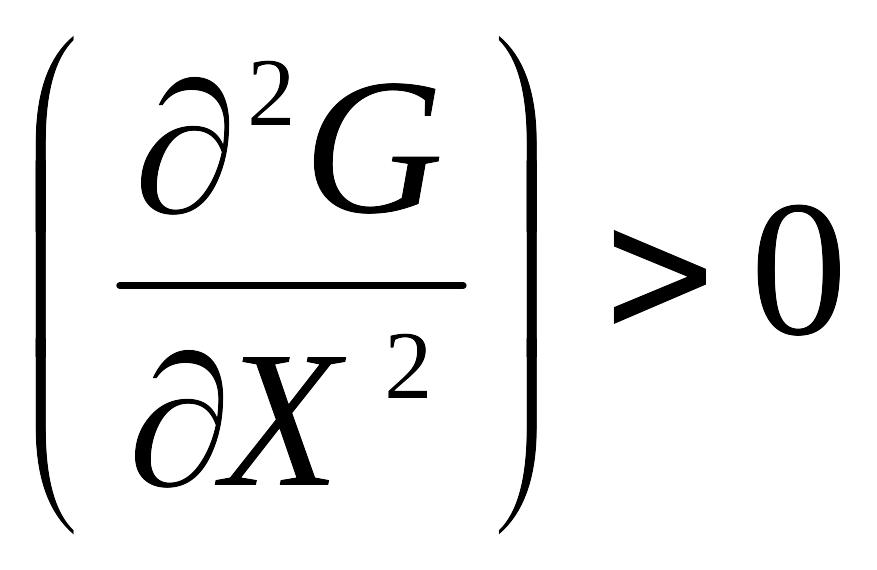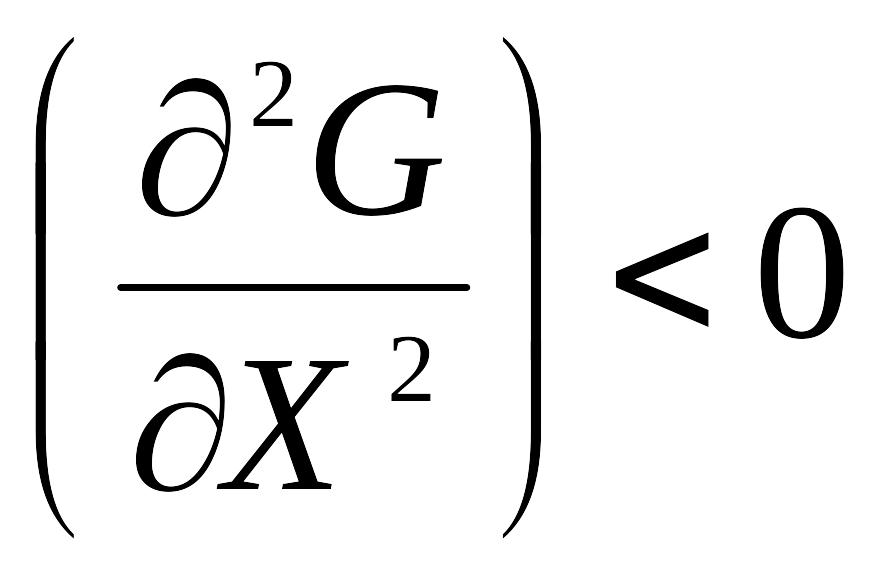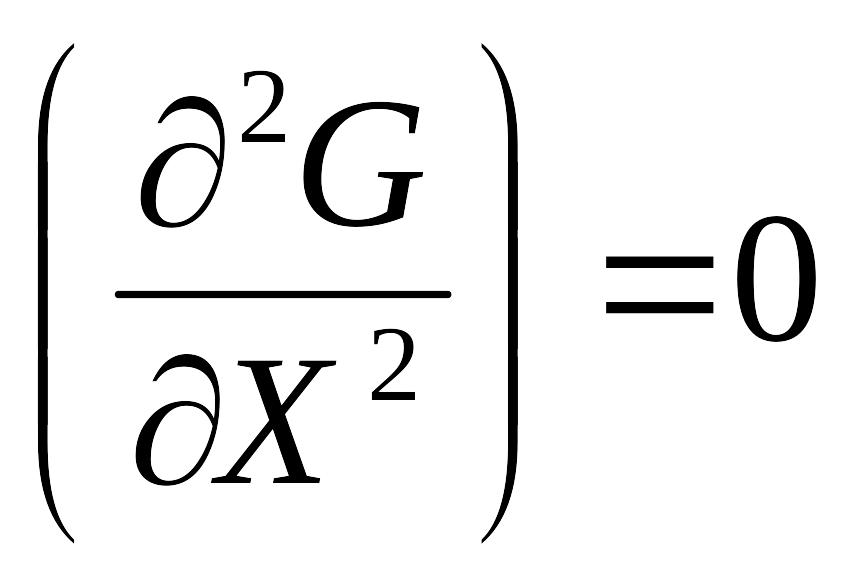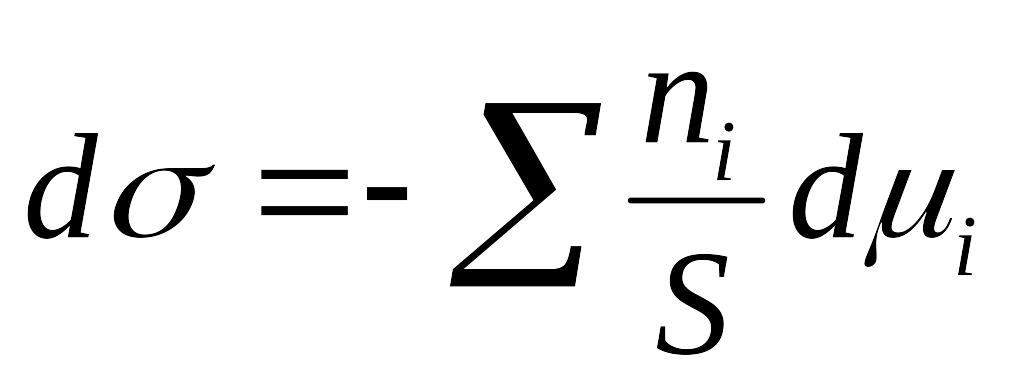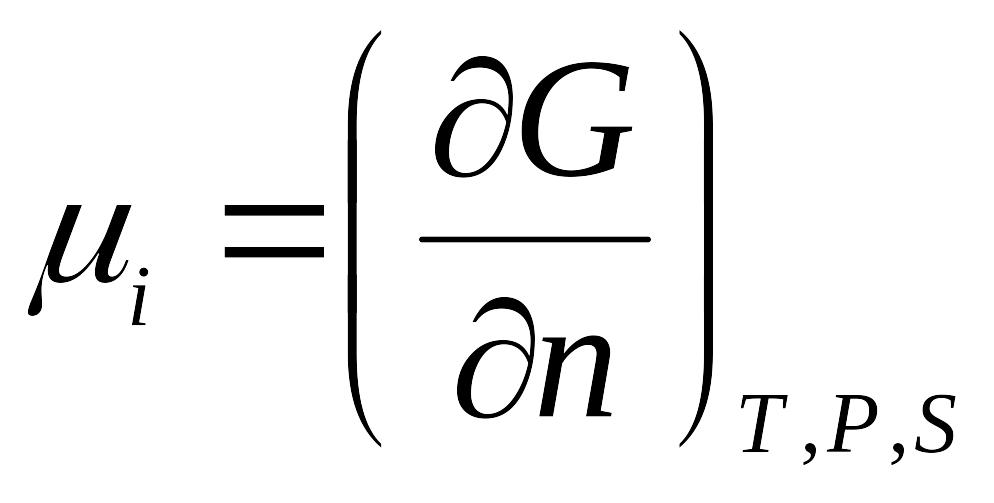Основні поняття й визначення
1. Композиційні матеріали відносяться до систем
тверда дисперсна фаза і рідке дисперсне середовище
тверде дисперсне середовище і тверда дисперсна фаза
газоподібна дисперсна фаза і тверде дисперсне середовище
тверда дисперсна фаза і газоподібне дисперсне середовище
2. Питома поверхня це
відношення площі поверхні частки до її об’єму.
відношення площі поверхні частки до її маси.
відношення площі поверхні частки до поверхневого натягу
відношення об’єму частки до площі її поверхні.
3. Мимовільно можу протікати тільки процеси
що не змінюють повну енергію
що супроводжуються збільшенням ентропії
які йдуть з виділенням енергії
що супроводжуються зменшенням повної енергії
4. Яке визначення застосовне до поняття "Дисперсна фаза"
Частка речовини в дисперсному середовищі
Речовина, що оточує дисперсні частки
Речовина, що дискретно розподілена в дисперсному середовищі
Частина гетерогенного середовища з характерним розміром, малим у порівнянні з розміром тіла
5. Яке визначення застосовне до поняття "Дисперсне середовище"
Відособлене границею розділу речовина в складі гетерогенної системи
Індивідуальна речовина, у якому розподілена дисперсна фаза
Речовина, дискретно розподілене в дисперсній системі
Частина гетерогенної системи з характерним розміром, малим у порівнянні з розміром тіла
6. Перший закон термодинаміки стверджує що
Усі явища при відсутності зовнішніх впливів відбуваються зі зменшенням ентропії
Усі явища, при відсутності зовнішніх впливів відбуваються зі збільшенням ентропії
У системах, що знаходяться при постійних T і P мимовільно можуть протікати тільки ті процеси, що супроводжуються зменшенням енергії Гіббса.
7. Умова термодинамічної рівноваги
Мінімальні значення енергії Гіббса ( Гельмгольца) в ізобарно (ізохорно)- ізотермічних умовах.
Незмінність стану при незмінності зовнішніх умов
Похідна від енергії Гіббса по параметрах дорівнює нулю
Мимовільне відновлення рівноваги системи після припинення зовнішніх впливів.
8. Стійкі рівноваги характеризуються наступними ознаками
їхня зміна в якому або процесі залежить тільки від початкового і кінцевого стану системи
незмінність рівноважного стану при збереженні зовнішніх умов
максимальні значення енергії Гіббса і Гельмгольца в ізобарно (ізохорно) ізотермічних умовах.
мимовільне відновлення рівноваги системи після припинення зовнішніх впливів.
9. Термодинамічні функції це функції
Значення яких залежать від температури, тиску й ентропії
Функції, що є складовими повної внутрішньої енергії
що їхня зміна в будь якому процесі залежить тільки від початкового і кінцевого стану системи
Функції, що характеризують агрегатний стан
10. Зі збільшенням дисперсності вільно-дисперсної системи кривизна поверхні часток
Не змінюється
Зменшується
Зростає
11. Визначення гетерогенної системи
Системи, які не мають змоги до обміну енергією з навколишнім середовищем.
Системи, що складаються із часток, що мають один з розмірів на багато менше розмірів тіла.
Системи, що мають у своїй сполуці дві або більше фази, розділені міжфазною поверхнею.
це тіло або група тіл, що знаходяться у взаємодії й відокремлюються подумки від навколишнього середовища й другорядних зовнішніх впливів.
12. Вибрати правильний вираз для енергії Гельмгольца
13. Визначення ізольованої системи
Системи, які не мають змоги обміну енергією з навколишнім середовищем .
Системи, що складаються із часток, що мають один з розмірів набагато менше розмірів тіла.
Системи, що мають у своїй сполуці дві або більше фази, розділених міжфазною поверхнею.
14. Вибрати правильний вираз для енергії Гіббса
15. Вибрати правильний вираз для диференціала енергії Гіббса
16. На величину питомої поверхні дисперсної системи впливають
Дисперсність
Розмір часток
кривизна поверхні
Поверхнева енергія
Масова концентрація часток
17. Які із систем є емульсіями
Фарби
Суспензії
епоксидні смоли
розплави термопластів
18. Умови стійкої рівноваги
19. Питома поверхня дисперсної системи збільшується в наступних систем (розставити в порядку зростання)
Наночастка
Ліозоль
пил
дим
20. Рухливість рівноваги означає
Мимовільне відновлення рівноваги системи після припинення зовнішніх впливів.
Можливість підходу до стану рівноваги із двох протилежних сторін
Незмінність рівноважного стану при збереженні зовнішніх умов
Рівність швидкостей прямого й зворотного процесів.
21 Які закономірності і явища можна використати для оцінки питомої поверхні
Закономірності седиментації
Ізотерми адсорбції
Осмос
Капілярні явища
Змочування
адгезія
Поверхневий натяг поверхнева енергія
1. Якими методами принципово можливо визначити поверхневий натяг рідини
Зважування маси краплі, що відривається від капіляра
Визначенням зусилля відриву кільця від поверхні досліджуваної рідини
Визначенням величини по відомому крайовому куті змочування і поверхневої енергії поверхні, що змочується
Визначенням висоти капілярного підняття
2. Поверхневий натяг виміряється в
Дж/кв.м
Н/м
Н/кв.м
Па/с
3. Поверхневий натяг рідини при її нагріванні
Зменшується,
Збільшується
Не змінюється.
4. Поверхневий натяг і поверхнева енергія характеризується
Як робота перенесення молекул з обєму на поверхню
Силою, спрямованою паралельно до поверхні, що доводиться на одиницю довжини периметра, що обмежує поверхню
Роботою утворення одиниці поверхні.
Енергію Гіббса, що доводиться на одиницю площі поверхні
5. Розставити речовини по величині поверхневої енергії, починаючи з низького
Скло
Термопласти
Реактопласти
6. Повна поверхнева енергія
не залежить від температури
Збільшується зі збільшенням температури
Зменшується зі збільшенням температури
7. Вибрати правильні залежності поверхневого натягу і Гіббсівскої адсорбції від концентрації для поверхово - активних речовин
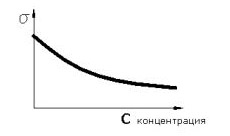
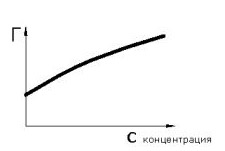

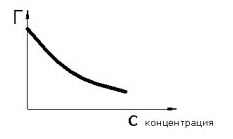
8. Рівняння Гіббса - Гельмгольца
пов'язує поверхневий натяг з температурою.
пов'язує повну енергію з поверхневим натягом і температурою.
пов'язує повну енергію з тиском і температурою.
пов'язує поверхневий натяг з тиском і температурою.
9. Речовина називається поверхнево-активною якщо
Зі збільшенням його концентрації в обємі, його концентрація в поверхневому шарі росте повільніше
при адсорбції концентрація його на поверхні нижче, ніж у самому розчині
малі його концентрації сильно знижують поверхневий натяг рідини
зі збільшенням концентрації речовини в обємі надлишкова поверхнева енергія на границі розділу фаз знижується
10. Хімічний потенціал речовини залежить від
Температури
Поверхневої енергії речовини
Концентрації даного елемента
Природи середовища, у якій воно знаходиться
11. Хімічний потенціал характеризується як
добуток концентрації речовини на коефіцієнт активності.
величина, що характеризує здатність даного компонента до виходу з даної фази (шляхом випару, розчинення, кристалізації, хімічної взаємодії).
збільшення ізобарного потенціалу даної фази при введенні додаткової кількості даного компонента при постійних T,P,S.
схильність речовини до визначеного роду взаємодіям
12. Якщо зі збільшенням концентрації речовини в обємі поверхнева енергія зменшується то
Розчинена речовина називається поверхнево-активною
Випадок називається позитивною адсорбцією.
Випадок називається негативною адсорбцією.
Розчинена речовина називається поверхнево-інактивною
13. Дифузійний шар зарядів подвійного електричного шару характеризується
загасанням електричного потенціалу по експоненті в міру видалення від поверхні
зв'язаністю адсорбційною взаємодією з поверхнею
розподілом у мономолекулярному шарі
14. Надлишкова поверхнева енергія породжується
Некомпенсованою енергією взаємодії молекул, що перебувають на поверхні речовини, і атомів
Адсорбцією молекул і атомів з об'єму на поверхню тіла
Впливом на поверхню тіла часток сусідньої фази
Наявністю в поверхні вільних реакційно-здатних груп
15. Якими методами принципово можливо визначити поверхневий натяг рідини
Використовуючи рівняння Жюрена
Визначенням зусилля відриву кільця від поверхні досліджуваної рідини
Визначенням шуканої величини по відомому крайовому куті змочування й поверхневої енергії змочує поверхні
Визначенням висоти капілярного підняття
16. Визначення поверхневого натягу методом сталлагмометра припускає
Зважування маси краплі, що відривається від капіляра
Визначення зусилля відриву кільця від поверхні досліджуваної рідини
Визначення висоти капілярного підняття
Визначення шуканої величини по відомому крайовому куті змочування
17 Яка крива характеризує поверхнево-активну речовину

Крива 1
Крива 2
Жодна
18. Яким чином компенсується надлишкова поверхнева енергія в рідин
Змочуванням
Адгезією
Поверхневим натягом
Адсорбцією
Подвійним електричним шаром
19. Тверді тіла зменшують свою поверхневу енергію за рахунок
Адсорбції
адгезії
змочування
коагуляції
пептизації
2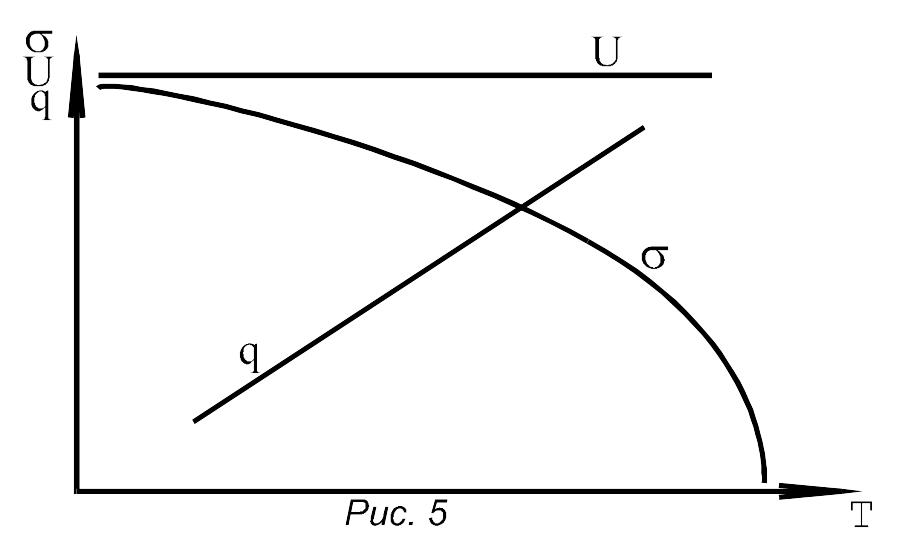 0.
Визначити
відповідність кривих для залежностей
повної енергії поверхні рідини,
ентропії й поверхневого натягу від
температури
0.
Визначити
відповідність кривих для залежностей
повної енергії поверхні рідини,
ентропії й поверхневого натягу від
температури
1 поверхневого натягу
2 ентропії
3 повної енергії поверхні
21. Вибрати низько-енергетичні поверхні
Скло
Залізо
Поліетилен
Кераміка
Затверділа епоксидна смола
22. Поверхневий натяг зі збільшенням температури
знижується
підвищується
не змінюється
23. Ентропія поверхні при підвищенні температури
Збільшується
зменшується
не змінюється
24. Який висновок випливає з даного виразу
![]()
поверхнева енергія Гіббса при адсорбції або робота створення одиниці поверхні, крім поверхневого натягу, включає роботу ущільнення речовини
поверхнева енергія Гіббса при адсорбції або робота створення одиниці поверхні, крім поверхневого натягу, включає роботу адгезії
поверхнева енергія Гіббса при адсорбції або робота створення одиниці поверхні, крім поверхневого натягу, включає роботу змочування
25. Формула Етвеша
пов'язує поверхневий натяг з температурою.
пов'язує повну енергію з поверхневим натягом і температурою.
пов'язує повну енергію поверхні з тиском і температурою.
пов'язує поверхневий натяг з тиском і температурою.
26. Неорганічні солі стосовно води є
Поверхнево активними речовинами 1 типу
Поверхнево активними речовинами 2 типи
Поверхнево активними речовинами 3 типи
27. Надлишкова поверхнева енергія зростає в (розставити порядку зростання)
частки кремнію діаметром 10 мікронів
частки кремнію діаметром 20 мікронів
частки поліетилену діаметром 20 мікронів
частки поліетилену діаметром 1 мікронів
28. Ентропійна складова поверхневої енергії рідини зі збільшенням температури
Зростає
Зменшується
Не змінюється
29. Критичний поверхневий натяг одержують
Екстраполяцією залежності поверхневого натягу від косинуса кута змочування на косинус кута змочування дорівнює одиниці
Екстраполяцією залежності поверхневого натягу від косинуса кута змочування на косинус кута змочування дорівнює нулю
Екстраполяцією залежності поверхневого натягу від кута змочування на кут змочування дорівнює нулю
Екстраполяцією залежності поверхневого натягу від кута змочування на кут змочування рівний 180 градусів
30. Рівняння Гіббса для міжфазної поверхні (вибрати правильні вирази)
31. Яким визначенням характеризується переміщення речовини під дією градієнта хімічного потенціалу
речовина може мимовільно переходити з фази в якій її хімічний потенціал більше у фазу, у якій її хімічний потенціал менше
рівновазі відповідає рівність хімічних потенціалів кожної з речовин у всіх фазах системи
речовина може мимовільно переходити з фази в якій іі хімічний потенціал менше у фазу, у якій її хімічний потенціал більше
32. Хімічний потенціал визначається
збільшенням ізобарного потенціалу даної фази при введенні додаткової кількості даного компонента при постійних температурі, тиску, ентропії
збільшенням поверхневої енергії при введенні додаткової кількості даного компонента при постійних температурі, тиску, концентрації
збільшенням ізобарного потенціалу даної фази при введенні додаткової кількості даного компонента при постійних температурі, тиску, концентрації речовини в об'ємі
від температури при постійній концентрації речовини в об'ємі
33. Вказати на вирази для визначення хімічного потенціалу