
Радиационно-химическая технология.
Синтез бромистого этила
Синтез бромистого этила первым получил промышленное внедрение. Синтез проводят в газовой и жидкой фазе, идет с высоким РХВ G=104 – 105. Процесс протекает по радикально-цепному механизму с квадратичным обрывом цепи; механизм процесса зависит от избытка одного из реагентов и от фазового состояния.
При избытке HBr в жидкой фазе:
![]()
![]()
![]()

В жидкой фазе не наблюдается линейной зависимости скорости реакции от мощности поглощенной дозы – эта зависимость наблюдается только в газовой фазе.
линейный обрыв:
При избытке этилена в жидкой фазе:
![]()
![]()
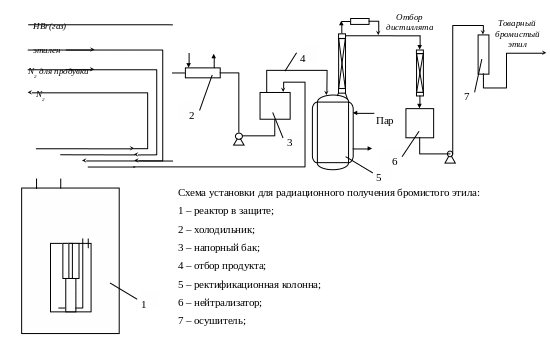
Объем реактора – 150 л; выполнен из никеля; расположен в бетонной камере на глубине 1,2 метра под землей. Облучатель кассета с источником ( 60Со ) в двойной ампулировке, расположен на оси цилиндрического аппарата.
Биологическая защита выполнена из бетона, сверху реактор закрыт стальными плитами толщиной 450 мм. Над источником находится свинцовая защита толщиной 20см.
Технологическая схема представляет собой систему с циркуляцией и непрерывной отгонгой продукта. Бромистый этил перекачивают циркуляционным насосом со скоростью 80л/мин через внешний теплообменник и реактор. Исходные HBr и C2H4 добавляют к бромистому этилу и пропускают через зону облучения. Избыточный бромэтил стекает из напорного бака в колонну и затем очищенный броиэтил направляют в скруббер, где его нейтрализуют раствором NaOH для удаления остатков HBr. Затем осушивают и отправляют потребителю.
Теломеризация олефинов с помощью ССl4
![]()
n=1÷3
механизм реакции:
![]()
![]()
![]()
![]()
CCl4 насыщают этиленом в сатураторе и подают в реактор при температуре 1000С; этилен в реактор поступает через барботер после облучения реакционную смесь выводят в сепаратор и этилен из сепаратора выводят в сатуратор.
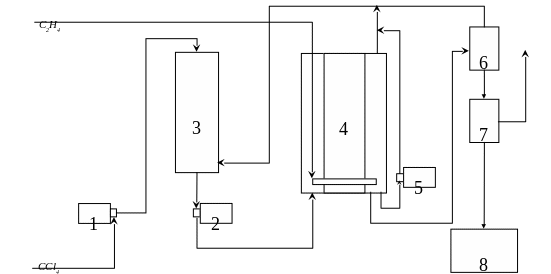
Принципиальная схема получения тетрахлоралканов на промышленной установке: 1,2 – насосы, 3 – сатуратор; 4 –радиационно-химический реактор; 5 – циркуляционный насос; 6 – сепаратор высокого давления; 7 – сепаратор низкого давления; 8 – сборник.
Хлорирование парафинов
Продукты хлорирования низкомолекулярных парафинов являются растворителями, а высокомолекулярных пластификаторы, антипирены и поверхностно-активные вещества, использующимися для получения моющих средств. Эти процессы проводят под действием -излучения, УФ-излучения и при высоких температурах.
УФ-излучение образуются побочные продукты, загрязняющие целевой, происходит значительное загрязнение поверхности УФ-ламп, что приводит к необходимостиостановки процесса для их очистки. На эффективность процесса оказывает влияние окраска раствора (обуславливается наличием примесей) – при ее наличии эффективность снижается.
Термическое инициирование. Образуется большое количество побочных продуктов загрязняющих целевой продукт, кроме того, необходимо решение проблемы теплосъема.
γ-излучение позволяет проводить процесс в мягких температурных условиях с высоким выходом целевого продукта и практически полным отсутствием побочных продуктов.
1. Хлорирование метана
Продукты хлорирования – органические растворители; процесс хлорирования CH4 реализован как при повышенных температурах, так и под действием γ-излучения. В случае термического процесса необходимая температура лежит в интервале от 300 до 500˚С, при этом образуются непредельные примеси, которые легко окисляются загрязняя целевой продукт. Как и было указанно выше необходимо решать в этом случае проблему теплосъема.
В случае радиационного инициирования процесса реакция идет при температуре 25÷30˚С, при этом непредельных продуктов не образуется и целевой продукт обладает высокой чистотой.
2. Хлорирование этана
процесс идет при температуре 400÷500˚С – образуется сильно загрязненный непредельными соединениями продукт. В случае радиационно-инициированного процесса реакция проводится при температуре 20÷60˚С при этом непредельных продуктов не образуется, а глубина хлорирования определяется временем облучения.
В процессе облучения образуются следующие продукты:
![]()
![]()
зависимость концентрации веществ от времени проведения процесса показана на рисунке:
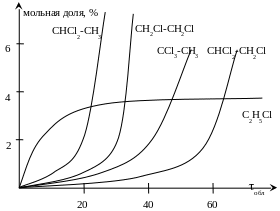
Максимальная скорость процесса достигается при температуре 40˚С изменение давления практически не влияет на скорость реакции. Снятие тепла осуществляетяс артезианской водой либо графитовым теплообменником. NaOH для нейтрализации HCl
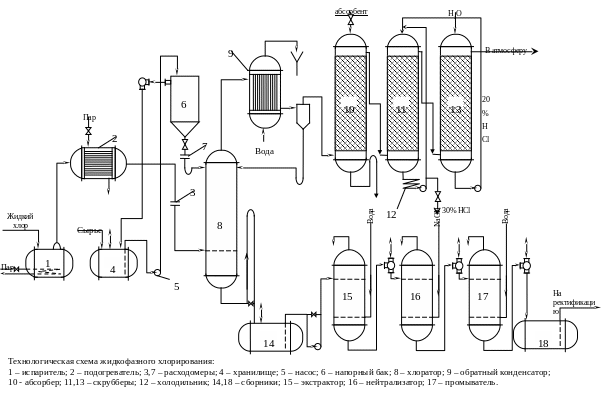
Описание технологической схемы жидкофазного хлорирования
Подготовка исходных веществ. Жидкий хлор испаряется в испарителе 1, проходит подогреватель 2 и расходомер 3 и поступает на реакцию. Исходное органическое сырье из емкости хранилища 4 насосом 5 подается в напорный бак 6, в котором поддерживается постоянный уровень жидкости с целью сохранения одинаковой скорости ее истечения в реактор 8. соотношение исходных реагентов регулируют с помощью расходомеров 3 и 7 и проверяют периодическим анализом реакционной массы. При хлорировании в присутствии инициатора раствор последнего в исходном веществе готовят в емкости 4 при перемешивании. Реактор вытеснения 8 работает по принципу противотока.
Обработка отходящих газов. Отходящий из реактора 8 газ содержит главным образом хлористый водород с захваченныим им парами органических веществ. Последние конденсируются в обратном холодильнике 9 и возвращаются в реактор. Дальнейшая задача состоит обычно в улавливании достаточно летучих соединений (хлориды метана, дихлорэтан и тд.). Для этого газ в насадочном абсорбере 10 промывают каким либо высококипящем растворителем (например, побочными продуктами ректификации целевого продукта). После очистки от летучих органических веществ газ поступает в скруббер 11, орошаемый 20%-ной соляной кислотой с целью получения концентрированной кислоты. Последняя стекает с низа аппарата и охлождается в графитовом холдильнике 12; часть ее вновь направляют на орошение скруббера 11, предварительно разбавив слабой кислотой, образующейся в скруббере 13. Этот скруббер орошается водой и предназначен для очистки газов от остатков хлористого водорода. Очищенный остаточный газ сбрасывают в атмосферу.
Переработка реакционной массы. Сырая реакционная масса всегда содержит растворенный хлористый водород, и нейтрализация его необходима во избежание коррозии последующей аппаратуры и получения продукта надлежащего качества. Для нейтрализации реакционная смесь из промежуточной емкости 14 непрерывно поступает в систему противоточных колон, где она промывается вначале водой (ап. 15), затем раствором щелочи или соды (ап. 16) и в заключении – снова водой (ап. 17). Промытая смесь собирается в емкости 18, откуда ее направляют на разделительную установку, работающую по схеме непрерывной ректификации.
Хлорирование высших алканов
Процессы хлорирования высших алканов делят на неглубокое заключающиеся в замещении 1-2 атомов водорода на атом Cl, и глубокое при котором содержание атомов хлора в конечном продукте составляет 70% по массе. Продукты неглубокого хлорирования для углеводородов С8 – С18 используются для получения ПАВ и синтетических моющих средств – сульфонаты.
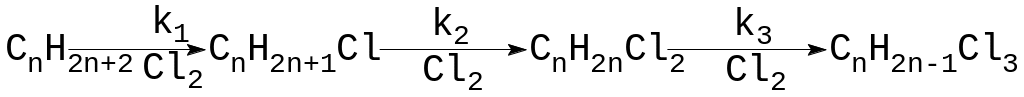
n = 8÷18
Концентрации компонентов можем рассчитать:
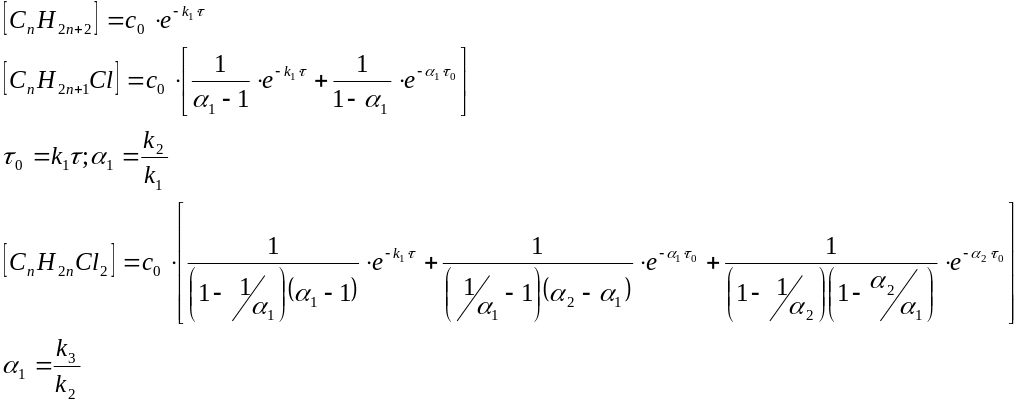 реакция
протекает по закону первого порядка:
реакция
протекает по закону первого порядка:
![]() ,
k = 1÷1.25
,
k = 1÷1.25
Если 1=1, 2=1:

где:
x – степень хлорирования число атомов хлора которые заместили атомы водорода в алкане
m – число атомов хлора в соответствующем производном.
Полихлориды при получении ПАВ являются побочными продуктами выход которых сводят к минимуму.
Процесс гетрофазный (хотя возможно проведение гомофазного процесса), поэтому кинетика осложнена процессом массопередачи. Согласно теории массопередачи элементы объема жидкости непрерывно подходят к границе раздела фаз и находятся там время , которое называется периодом обновления поверхности и рассчитывается из уравнения Фика:
![]()
– коэффициент массоотдачи по хлору
D – коэффициент диффузии
Наиболее эффективен аппарат, процесс в котором протекает при перемешивании с барботажем хлора.
Условия проведения радиационно-химического синтеза
Мощность дозы = 5 рад/с, температура 200С. При этом реакция протекает в диффузионном режиме, который определяется процессом диффузии. Зона реакции находится вблизи поверхности раздела фаз. Перемешивание с барботажем приводит к увеличению коэффициента массоотдачи и уменьшению вероятности повторного хлорирования алкана.
Для характеристики процесса вводят коэффициент использования сырья:
![]() ,
где
,
где
с0 – концентрация алкана, с1 – концентрация монохлорпроизводного после окончания реакции; – потеря сырья в %.
Глубокое хлорирование алканов
Глубокое хлорирование алканов достигается в том случае, когда массовая концентрация хлора составляет порядка 70% в конечном продукте. Продукты используются в качестве огнезащитных добавок к горючим полимерам. Как сам глубоко хлорированных продукт ХП-70 так и сырье из которого он получается является твердым веществом в нормальных условиях поэтому процесс хлорирования целесообразно проводить в растворителе инертном по отношению к хлору – это может быть CCl4
Реакция протекает вначале в диффузионном режиме, а при 60-70% хлорировании лимитирующей становиться стадия химической реакции. Радиационно-химический выход хлорирования составляет 104-105 молекул хлора на 100эв.
Производительность рассчитывается по уравнению:
![]()
где:
b= 1.2*10-7 – коэффициент размерности
V – объем реактора [м3]
Сульфохлорирование углеводородов
Сульфохлорирование углеводородов протекает по радикально-цепному механизму, являеся тгетерофазным процессом, в котором кинетика химической реакции осложнена ещё и кинетикой растворения двух газообразных реагентов: SO2 и Cl2; кроме того осложнена ещё и кинетикой деструкции полученого хлороводорода как побочного продукта. Конечные соединения – натриевые соли алкилсульфоновых кислот – синтетические моющие средства.
Образование основного продукта монохлорсульфоновой кислоты описывается следующей реакцией:
![]()
Побочные реакции:
Образование дихлоралкилсульфоновой к-ты:
хлорирование углеводорода:
 ,
кроме этой реакции к образованию
хлорпроизводного приводит реакция
десульфирования сульфохлорида:
,
кроме этой реакции к образованию
хлорпроизводного приводит реакция
десульфирования сульфохлорида:

Механизм процесса
![]()
![]()

Е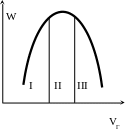 сли
реакция идет в кинетическом режиме, то
для Р<2∙103рад/с, W~P0.5
на самом деле в истинно кинетической
области процесс не идет, так как на
процесс действует массопередача и
процесс смещается либо в диффузионную,
либо в переходную область.
сли
реакция идет в кинетическом режиме, то
для Р<2∙103рад/с, W~P0.5
на самом деле в истинно кинетической
области процесс не идет, так как на
процесс действует массопередача и
процесс смещается либо в диффузионную,
либо в переходную область.
VГ скорость расходования газа
I – расход газа мал, W~WГ – диффузионная область, скорость определяется поверхностью массопередачи
I I I – кинетическая область, скорость процесса уменьшается за счет побочных реакций возникающих в следствии высокой концентрации SO2 и Cl2
Побочные реакции:
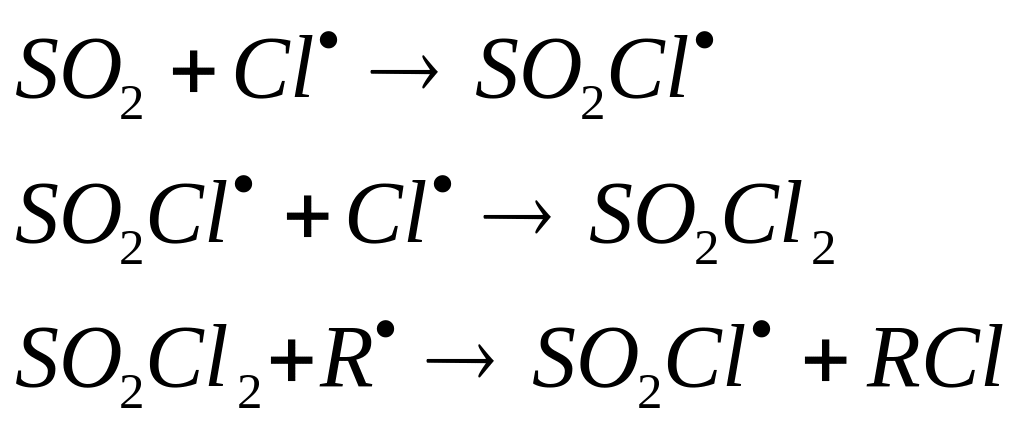
Селективность процесса характеризуется отношением:
![]()
WCX – скорость сульфохлорирования
WОК – скорость окисления (замещения атомов водорода на какие либо группы)
WХЛ – скорость хлорирования
Селективность процесса увеличивается с увеличением давления и с уменьшением расхода газа, при этом процесс смещается в диффузионную область, что уменьшает стационарную концентрацию газов, причем концентрация хлора уменьшается быстрее чем стационарная концентрация SO2. В следствии чего лучше всего процесс проводить в промежуточной области, где скорость реакции максимальна.
Процесс проводится при непрерывном
барбатаже при следующем расходе газов
![]()
Описание технологической схемы
Углеводороды подаются в верхнюю часть радиационно-химического сульфохлоратора (1), а SO2 и Cl2 в его нижнюю часть через барботер. Основным узлом СХ – это цилиндрический реактор с центральным осевым облучателем высотой 4.5м и диаметром 0.8м, который выполнен из нержавеющей стали толщиной 5мм с рубашкой для водного охлаждения. Внутри реактора поверхность освинцована. По оси реактора находится облучатель с двойными стенками из нержавеющей стали. Между стенками облучателя циркулирует вода для охлаждения источников. Вокруг реактора находится биологическая защита выполненная из чугунных колец. Хранилище заполнено чугунной дробью, в котором расположен канал для перемещения активных и неактивных шаров и распределительное устройство.
Образующийся в результате реакции HCl и непрореагировавшие SO2 и Cl2 попадают в расширитель (2) после чего с помощью систем разделения и очистки HCl утилизируется а SO2 и Cl2 направляются обратно в реактор (1).
Продукты с растворенными веществами сливаются через низ реактора (1) в приемник (3) откуда перекачиваются центробежным насосом в разделительную ёмкость (4) где в основном выделяется сульфохлорид (SO2Cl2) а основные продукты через приемник (5) попадают в омылитель (6) где смешиваются с раствором гидроксида натрия в результате чего образуется сульфонат натрия. Затем образовавшийся продукт поступает в отстойник (7) где смешивается с водой и некоторое время выдерживается для расслоения. При этом растворима в воде фракция отделяется от углеводорода, и углеводород поступает через сепаратор (11) обратно в реактор (1) Вода из сепаратора утилизируется.
Нижняя фракция полученная в отстойнике (7) (смесь сульфоната и хлорида натрия в воде) поступает через холодильник (8) и отстойник (9) в разбавитель (10) в котром опять смешивается с водой в результате чего образуются два слоя: верхний слой (хлорид натрия) поступает в сепаратор, а оставшаяся органическая фракция через теплообменник (12) попадает в экспанзер (13), в котором остатки неомыляемых веществ отделяются от сульфоната (путем перевода их в паровую фазу) и возвращаются в реактор после прохождения конденсатора (14), отстойника (15) и сепаратора (17). Омыленные углеводороды поступают в кристаллизатор (16) где идет разделение концентрированного раствора сульфоната натрия на чистый сульфонат первого сорта и сульфонат с неотделившимися примесями (второго сорта).
Сульфоокисление
