
Молекула бутадиена
Молекуле бутадиена
соответствует структурная формула
СН
=СН-СН=СН
.
Две двойные углерод-углеродных связи
в ней разделены простой связью С
-С![]() ,
длина которой (0,146 нм) значительно меньше
обычной длины ординарной связи С—С
0,154 нм. Удивительно, но метод Хюккеля,
вообще не учитывая длины связей в
расчете, позволяет объяснить эту
аномалию.
,
длина которой (0,146 нм) значительно меньше
обычной длины ординарной связи С—С
0,154 нм. Удивительно, но метод Хюккеля,
вообще не учитывая длины связей в
расчете, позволяет объяснить эту
аномалию.
В результате расчета по методу Хюккеля из четырех 2р АО получаются четыре МО:

В основном состоянии
заняты только две МО
и
,
при этом π-электронная энергия
составляет 4α + 4,48β. Энергия двух
изолированных двойных связей равна
удвоенной энергии π-электронов молекулы
этилена 4α + 4β. Полученная нами для
бутадиена энергия на 0,48β ниже, что
свидетельствует о дополнительной
стабилизации этой молекулы. Причины
такой стабилизации становятся понятными
при анализе вида занятых МО (рис. 5).
Обращает на себя внимание сосредоточение
~70% электронной плотности низшей из
занятых МО на фрагменте С
-С
,
причем эта МО имеет связывающий характер
относительно всех четырех углеродных
атомов. Орбиталь
,
верхняя занятая МО, обеспечивает
связывание С
—С
и С
—
С![]() и является разрыхляющей для связи С
-С
.
При этом вклады от АО 2-го и 3-го атомов
углерода в МО
меньше, чем вклады от этих же АО в МО
(коэффициенты
и
и является разрыхляющей для связи С
-С
.
При этом вклады от АО 2-го и 3-го атомов
углерода в МО
меньше, чем вклады от этих же АО в МО
(коэффициенты
и
![]() меньше, чем
меньше, чем
![]() и
и
![]() ),
поэтому связывание С
-С
за
),
поэтому связывание С
-С
за
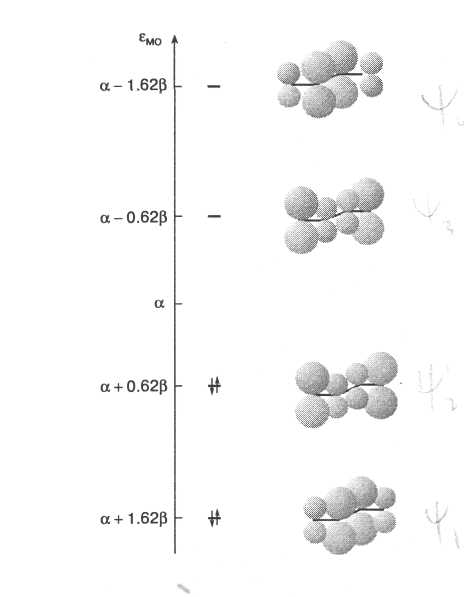
Рис. 5. π-МО в молекуле бутадиена.
счет
,
больше, чем ослабление связи, вносимое
.
Формально простая связь в молекуле
бутадиена приобретает частично двойной
характер. Используя коэффициенты
![]() ,
можно рассчитать так называемые порядки
связей — π-электронную плотность в
области между двумя атомами.
,
можно рассчитать так называемые порядки
связей — π-электронную плотность в
области между двумя атомами.
Для связи С -С эта величина составляет 0,447, а для связей С —С и С — С равна 0,894. Порядок изолированной π-связи, например, в молекуле этилена в точности равен 1. Очевидно, что уменьшение длины связи С -С и дополнительная стабилизация сопряженной π-системы связаны с делокализацией π-электронов по всей молекуле. Величина 0,48β, характеризующая повышение стабильности сопряженной системы по сравнению с системой изолированных двойных связей, носит название энергии делокализации.
Полиены
В предыдущих
разделах мы научились вычислять энергию
молекулярных орбиталей этилена и
бутадиена. Теперь мы обратимся к полиенам,
т. е. углеводородам с открытой цепью
общей формулы
![]() .
Полиен, в котором n
— нечетное число, является свободным
радикалом. Например, при n
= 3 мы имеем
.
Полиен, в котором n
— нечетное число, является свободным
радикалом. Например, при n
= 3 мы имеем
![]() —
радикал аллил.
—
радикал аллил.
Пронумеруем атомы
углерода вдоль цепи от 1-го до n-го
и обозначим соответствующие АО символами
![]() .
Вековое уравнение имеет следующий вид:
.
Вековое уравнение имеет следующий вид:
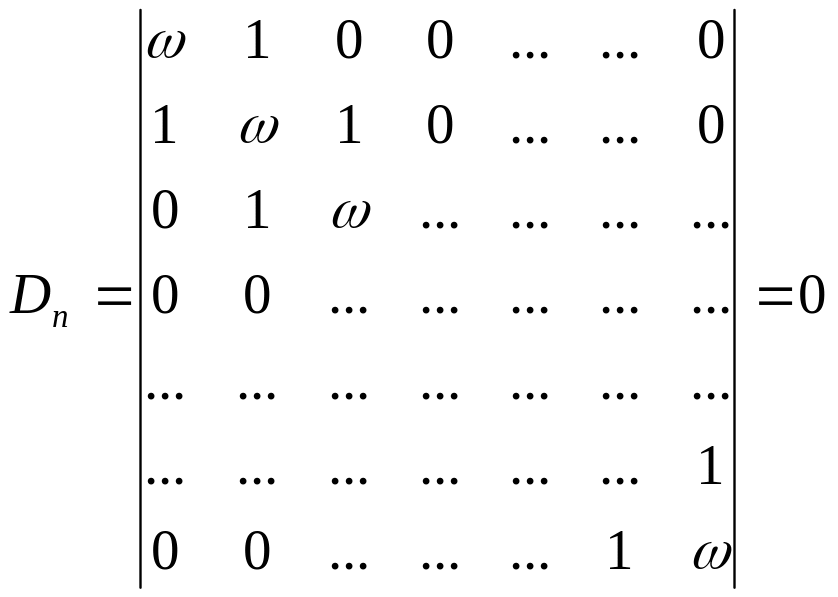 (25)
(25)
В этом детерминанте
параллельно большой диагонали, содержащей
члены
![]() ,
идут две малые диагонали, состоящие из
единиц. Все остальные члены равны нулю.
Понижение порядка для детерминанта
такого типа в случае, когда
,
идут две малые диагонали, состоящие из
единиц. Все остальные члены равны нулю.
Понижение порядка для детерминанта
такого типа в случае, когда
![]() ,
производится по формуле
,
производится по формуле
![]() (26)
(26)
Мы имеем
![]()
и
![]()
Далее, по формуле (26) получаем
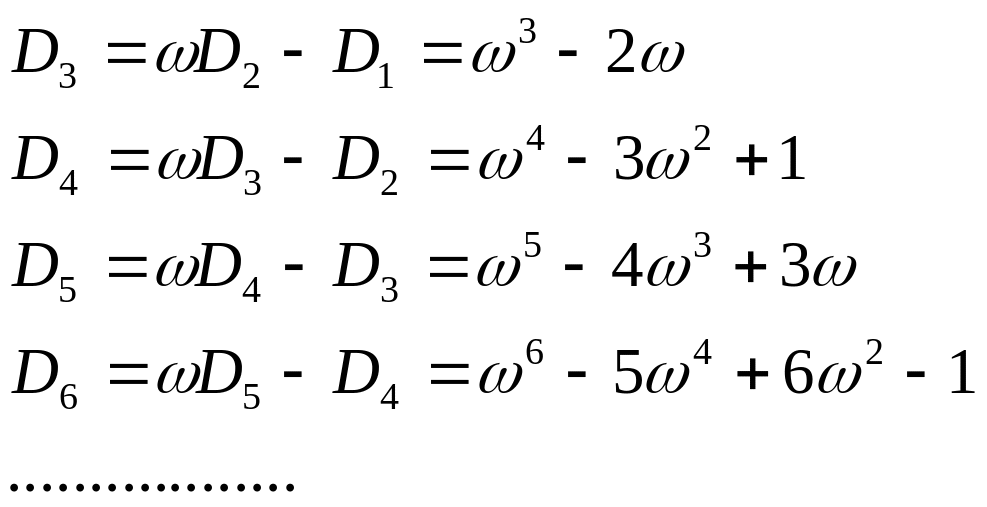 (27)
(27)
Интересно отметить,
что
![]() и
и
![]() можно разделить на
,
что соответствует решению
можно разделить на
,
что соответствует решению
![]() .
Аналогично все полиены с нечетным числом
атомов углерода в цепи имеют решение
,
поэтому у них существует уровень, энергия
которого не зависит от
:
.
Аналогично все полиены с нечетным числом
атомов углерода в цепи имеют решение
,
поэтому у них существует уровень, энергия
которого не зависит от
:
![]() (28)
(28)
Уравнение (25)
решается таким же образом, как и в случае
бутадиена. В результате можно определить
значения
и
![]() и т. д. и, следовательно, значения всех
коэффициентов при АО, входящих в МО
и т. д. и, следовательно, значения всех
коэффициентов при АО, входящих в МО
![]() .Нет
необходимости подробно приводить
результаты этих вычислений. Однако
интересно указать простые соотношения,
полученные Коулсоном для значений
энергии и коэффициентов при АО:
.Нет
необходимости подробно приводить
результаты этих вычислений. Однако
интересно указать простые соотношения,
полученные Коулсоном для значений
энергии и коэффициентов при АО:
 (29)
(29)
где
![]() — коэффициент при r-й
АО, входящей в МО
— коэффициент при r-й
АО, входящей в МО
![]() .
.
