
Метод Хюккеля
Метод МО ЛКАО в варианте Хюккеля был разработан для расчета вполне определенного класса соединений - ненасыщенных углеводородов, обладающих системой сопряженных двойных связей. Несмотря на очевидную грубость использованных приближений, в рамках этого метода удалось уже в 1931 году, задолго до появления первых ЭВМ, описать электронное строение полиенов и сформулировать известное правило Хюккеля.
Специфика строения сопряженных непредельных углеводородов позволяет предположить, что многие их химические свойства определяются электронами π-системы, то есть электронами на орбиталях, антисимметричных относительно плоскости молекулы. Можно строго показать, что электроны связей, расположенных в плоскости молекулы, на вид π МО не влияют, и задача нахождения вида и энергий π МО может быть решена отдельно от описания σ-электронов. В таком случае можно считать, что каждый углеродный атом может быть представлен одной-единственной 2р АО, располагающейся перпендикулярно плоскости молекулы, и исключить из рассмотрения атомы водорода. Это приближение (σ-π-приближение) позволяет сильно упростить задачу. Например, для молекулы бензола в σ-π-приближении достаточно рассмотреть 6 МО, построенных из 6 АО, и разместить на них 6 электронов. Полный же расчет этой молекулы должен включать 36 АО, из которых следует построить 36 МО и заполнить их 42 электронами.
Следующее приближение заключается во введении в теорию двух параметров: параметра α описывающего взаимодействие электрона 2р АО атома углерода со своим ядром, и параметра β характеризующего взаимодействие между двумя соседними атомами углерода, представленными своими 2р АО. Оба эти параметра имеют размерность энергии и отрицательны по величине. Взаимодействием между не связанными непосредственно атомами углерода пренебрегают.
Введенные приближения
позволяют свести уравнение Шредингера
для молекулы, содержащей n
углеродных атомов, к системе n+1
уравнений, неизвестными в которых
являются n
коэффициентов
,
квадраты которых
![]() определяют вклад АО
определяют вклад АО
![]() в МО
в МО
![]() ,
и энергия МО
,
и энергия МО
![]() .
Полная энергия молекулы в приближении
Хюккеля определяется как суммарная
энергия всех π-электронов, энергия
каждого из π-электронов соответствует
энергии занимаемой им МО.
.
Полная энергия молекулы в приближении
Хюккеля определяется как суммарная
энергия всех π-электронов, энергия
каждого из π-электронов соответствует
энергии занимаемой им МО.
Молекула этилена
Рассмотрим применение этого для расчета энергетических характеристик молекулы этилена (риc. 2, а).
В молекуле этилена имеется двенадцать валентных электронов. Из них десять образуют пять σ-связей, т.е. одну связь С-С и четыре связи С-Н. Рассмотрим два π-электрона, которые образуют одну π-связь (риc. 2, б).
Молекулярную
орбиталь φ можно представить в виде
линейной комбинации двух атомных
2p![]() -орбиталей
χ
-орбиталей
χ![]() и χ
и χ
![]() :
:
φ = c χ + c χ (4)
Коэффициенты с и c можно определить, используя вариационный принцип
 = Минимум
(5)
= Минимум
(5)
где Е — энергия молекулярной орбитали; Н — эффективный одно-электронный гамильтониан. Н, φ и Е относятся к одному π-электрону (одноэлектронное приближение).
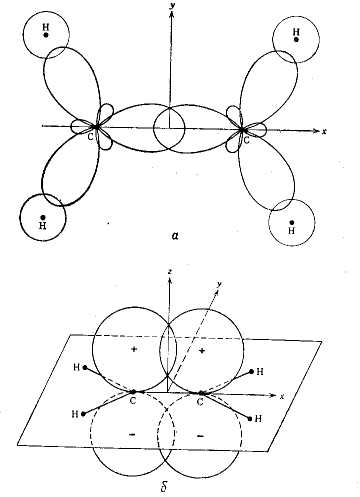
Рис. 2. Изображение σ- и π-связей в молекуле этилена.
Уравнения (4) и (5) по форме совершенно идентичны уравнениям (*) и (**).
![]() (*)
(*)
W=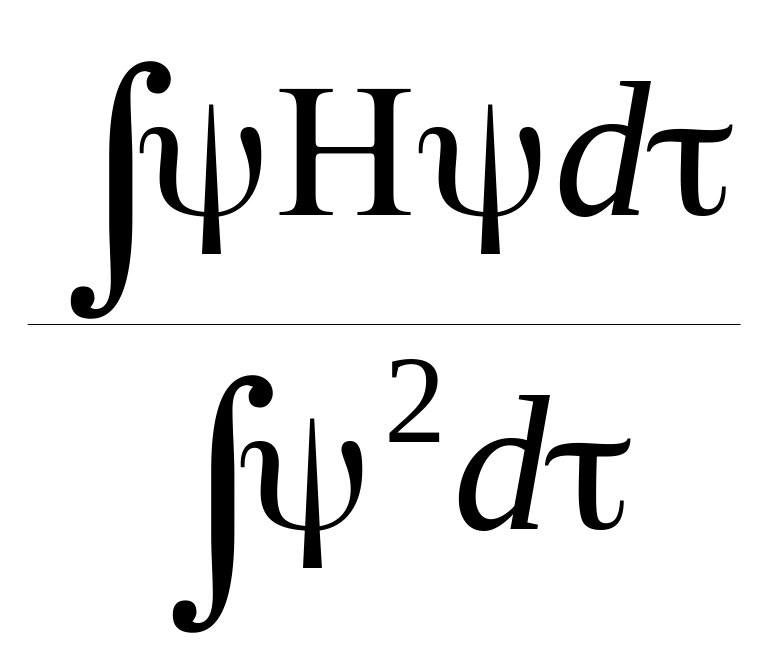
![]() =минимум(**)
=минимум(**)
(Символы H,W и Ψ, входящие в уравнения относятся не к одному электрону, а ко всей π-электронной системе молекулы).
Вследствие математической идентичности указанных выражений можно записать следующее, полагая, что обе АО нормированы, т. е
![]()
![]() (6)
(6)
введем следующие обозначения:
Кулоновские интегралы:
![]()
![]() (7)
(7)
Резонансные интегралы:
![]()
![]() (8)
(8)
Интеграл перекрывания:
![]() (9)
(9)
Кулоновский
интеграл
![]() ,
равен энергии одного электрона,
принадлежащего атому углерода 1. Эта
энергия обусловлена в основном силой
притяжения между электроном и ядерным
остовом атома углерода 1. При бесконечном
удалении электрона от атома углерода
эту энергию принимают равной нулю. Таким
образом, при конечном расстоянии от
атома
,
равен энергии одного электрона,
принадлежащего атому углерода 1. Эта
энергия обусловлена в основном силой
притяжения между электроном и ядерным
остовом атома углерода 1. При бесконечном
удалении электрона от атома углерода
эту энергию принимают равной нулю. Таким
образом, при конечном расстоянии от
атома
<0
и
![]() <0
<0
Поскольку оба атома углерода в этилене эквивалентны, разумно предположить, что
![]() (10)
(10)
Резонансный, или обменный, интеграл, впервые введенный в квантовой механике, играет очень важную роль в теории химической связи. В отношении знака резонансных интегралов можно предположить, что
![]() <0
и
<0
и
![]() <0
<0
Кроме того, можно показать, что
![]() (11)
(11)
Условие (5.8) не
ограничивается случаем двух эквивалентных
атомов, а является общим соотношением
[ср. с уравнением (1![]() )].
)].
![]() (1
)
(1
)
Интеграл перекрывания S отражает степень перекрывания двух
атомных орбиталей
![]() и
и
![]() ,
а его величина может находиться в
пределах от 0 до 1. Значение S,
равное единице, отвечает условию полного
совпадения двух АО, т. е.
,
а его величина может находиться в
пределах от 0 до 1. Значение S,
равное единице, отвечает условию полного
совпадения двух АО, т. е.
![]() =
[уравнение
(6)]
. Для соседних атомов углерода в молекуле
бензола S
равен приблизительно 0,25, но при увеличении
расстояния между атомами интеграл
перекрывания очень быстро уменьшается.
=
[уравнение
(6)]
. Для соседних атомов углерода в молекуле
бензола S
равен приблизительно 0,25, но при увеличении
расстояния между атомами интеграл
перекрывания очень быстро уменьшается.
Как мы видели, при
соответствующей замене символов
уравнение (4) превращается в уравнение
(*), а уравнение (5) — в уравнение (**).
Сравним теперь условие нормировки (6) с
условием (2
)
[![]() ],а
также обозначения уравнений (7) и (8) с
уравнением (3
)
[
],а
также обозначения уравнений (7) и (8) с
уравнением (3
)
[![]() ;
;![]() ;
;![]() ;
;![]() ]
и уравнение (9) с уравнением (2
).
Из сравнения становится ясно, что решение
должно дать ряд уравнений, аналогичных
уравнениям (4
)
[
]
и уравнение (9) с уравнением (2
).
Из сравнения становится ясно, что решение
должно дать ряд уравнений, аналогичных
уравнениям (4
)
[![]() ]
и (5
)
[
]
и (5
)
[![]() ],
а именно:
],
а именно:
с
(![]() )+с
)+с
![]() =0
=0
с +c ( )=0 (12)
Первое равенство
(12) получено заменой C
,C
H![]() ,H
,H![]() и W
в уравнении (4
)
величинами с
,с
,
и W
в уравнении (4
)
величинами с
,с
,![]() ,
,![]() и Е. Аналогично из уравнения (5
)
получают второе равенство (12).
и Е. Аналогично из уравнения (5
)
получают второе равенство (12).
Предположим для простоты, что
S = 0 (13)
В этом случае равенства (12) упрощаются:
c ( )+c =0
c +c ( )=0 (14)
При условии, что коэффициенты с и с не равны нулю, система (14) имеет решение, которое находят с помощью выражения:
![]() =0
(15)
=0
(15)
Уравнение (15), называемое вековым уравнением, легко решить:
![]() =
0
=
0
или
(![]() )(
)(![]() )=0
)=0
Следовательно,
это уравнение имеет два корня —![]() и
и
![]() :
:
![]()
![]() (16)
(16)
После подстановки значения в уравнение (14) получим
с
(![]() )
+ с
=0
)
+ с
=0
при
![]() ,
c
=с
(17)
,
c
=с
(17)
Теперь раскроем условие нормировки для МО φ:
![]()
или
![]()
Каждая АО также нормирована [уравнение (6)], поэтому
![]() (18)
(18)
и в предположении, что S = 0,
![]() =
1
(19)
=
1
(19)
Поскольку
![]() ,
,
=![]()
Молекулярную
орбиталь, для которой
,обозначим
![]() .Следовательно,
.Следовательно,
![]() (20)
(20)
Для молекулярной
орбитали
![]() ,
энергия которой равна
,
аналогичным путем получают выражение
,
энергия которой равна
,
аналогичным путем получают выражение
=![]() (21)
(21)
Итак, мы нашли две молекулярные орбитали и , определяемые уравнениями (20) и (21), со значениями энергии и соответственно, которые можно вычислить по уравнению (16).
МО
более устойчива, чем МО
.
Поскольку резонансный интеграл
отрицателен,
состояние с наинизшей энергией отвечает
сумме
![]() .
Следовательно,
.
Следовательно,
<
<
![]() =
(22)
=
(22)
На рис. 3. схематически
изображены МО
и
.
Между функциями
и
или
их квадратами
![]() и
и
![]() имеется
заметное различие. В точке на середине
расстояния между атомами углерода
и
,
равны нулю, т. е. электрон в центре связи
отсутствует. Это соответствует
утверждению, что
не может участвовать в образовании
связи. В отличие от
для МО
характерна высокая электронная плотность
в центре связи, так что орбиталь способна
к образованию связи. Поэтому часто
называют связывающей орбиталью, а
-
разрыхляющей орбиталью.
имеется
заметное различие. В точке на середине
расстояния между атомами углерода
и
,
равны нулю, т. е. электрон в центре связи
отсутствует. Это соответствует
утверждению, что
не может участвовать в образовании
связи. В отличие от
для МО
характерна высокая электронная плотность
в центре связи, так что орбиталь способна
к образованию связи. Поэтому часто
называют связывающей орбиталью, а
-
разрыхляющей орбиталью.
Молекула этилена имеет два π-электрона. В основном состоянии молекулы эти электроны должны занимать самую низкую
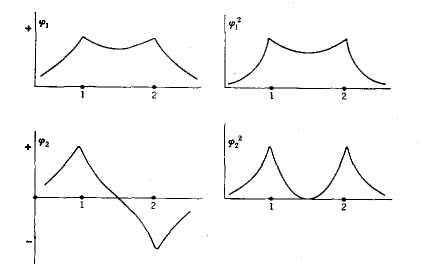
Рис. 3. Молекулярные орбитали и распределение зарядов в молекуле этилена.
по энергии МО . Полная энергия этого состояния равна
W=![]() =
=![]() 2
(23)
2
(23)
При возбуждении один или два электрона могут промотироваться на МО .Поэтому возможны два состояния с энергиями
W=![]() =
=![]()
и
W=![]() =
=![]() (24)
(24)
Исходными для этой
молекулы являются
,
и
2р АО углеродных атомов, на каждой из
которых расположено по одному электрону
с энергией α (в теории Хюккеля нет
необходимости использовать численные
значения параметров, все энергетические
характеристики принято выражать через
α и β). В результате расчета (рис. 4)
получены две МО: π — связывающая
![]() с энергией
с энергией
![]() и π* — разрыхляющая
и π* — разрыхляющая
![]() с энергией
с энергией
![]() .
Отрицательному знаку при
.
Отрицательному знаку при
![]() на схеме (рис. 4) соответствует изменение
знаков у лепестков p
АО на противоположные. В основном
состоянии молекулы этилена оба электрона
занимают нижнюю МО
на схеме (рис. 4) соответствует изменение
знаков у лепестков p
АО на противоположные. В основном
состоянии молекулы этилена оба электрона
занимают нижнюю МО
![]() и π-электронная энергия
и π-электронная энергия
![]() составляет 2α+2β. Энергия π-связи в
этилене, таким образом, равна 2β. Другая
экспериментальная характеристика,
которая может быть оценена в расчете,
— энергия перехода электрона с орбитали
на
составляет 2α+2β. Энергия π-связи в
этилене, таким образом, равна 2β. Другая
экспериментальная характеристика,
которая может быть оценена в расчете,
— энергия перехода электрона с орбитали
на
![]() ,
также равная
,
также равная
![]() .
.
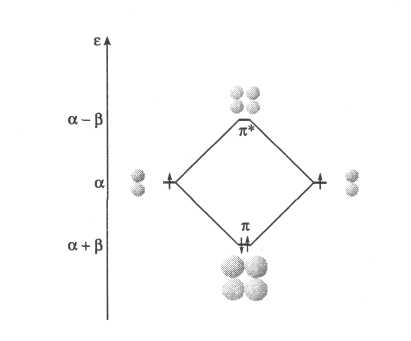
Рис. 4. π-МО в молекуле этилена.
