- •Оглавление
- •Введение
- •Основной закон светопоглощения (закон Бугера-Ламберта-Бера)
- •Ограничения и условия применимости закона Бугера — Ламберта — Бера
- •Спектры поглощения
- •Происхождение спектров поглощения
- •Основные узлы приборов абсорбционной спектроскопии
- •Качественный анализ
- •Количественный анализ
- •Оптимальные условия фотометрического определения
- •Основные приемы фотометрических измерений
- •Определение меди в виде аммиакатов дифференциально-фотометрическим методом
- •Практическое применение
- •Задачи по фхма
- •Список литературы
Практическое применение
Фотометрические и спектрофотометрические методы анализа применяются для определения многих (более 50) элементов периодической системы, главным образом металлов. Методами абсорбционной спектроскопии анализируются руды, минералы и иные природные объекты, продукты переработки обогатительных и гидрометаллургических предприятий. Эффективно используются эти методы в металлургической, электронной, химической и других отраслях промышленности, в медицине, биологии и т. д. Большое значение они имеют в аналитическом контроле загрязнений окружающей среды и решении экологических проблем. Значительно расширились области практического применения методов абсорбционной спектроскопии благодаря более широкому использованию инфракрасной области спектра и приборов со встроенной ЭВМ. Это позволило разработать методы анализа сложных многокомпонентных систем без их химического разделения. Методы абсорбционной спектроскопии продолжают успешно развиваться и совершенствоваться.
Вывод
Методы абсорбционной спектроскопии имеют высокую чувствительность (низкий предел обнаружения), они избирательны и точны. Методы могут быть применены для анализа больших и малых содержаний, но особенно ценной их особенностью является возможность определения примесей (до 10-5...l0-6%). Большое значение имеет избирательность многих фотометрических методов, позволяющая проводить определения элементов в сложных пробах без химического разделения компонентов. Погрешность фотометрических методов обычно составляет 3...5%, уменьшаясь в благоприятных случаях до 1. 2 % и нередко до 0/,...1,0%. Методы абсорбционной спектроскопии используют в химической, металлургической, металлообрабатывающей и других отраслях промышленности, горном деле, сельском хозяйстве, медицине и т. д.
Простые, быстрые и точные фонометрические методы анализа применяются для контроля производства, определения примесей и решения многих других важных вопросов в заводских и научно-исследовательских лабораториях. Большое значение имеют эти методы для исследования различных реакций, установления состава и устойчивости образующихся соединений. Успехи химии координационных соединений и достижения приборостроения дают все основания ожидать дальнейшего повышения точности и чувствительности этих методов.
Задачи по фхма
Задача1 (Потенциометрия)
Вычислить потенциал металлического электрода относительно электрода сравнения без учета и с учетом ионной силы раствора при следующих условиях:
№ варианта |
Электрод |
Объем электролита, см3 |
Растворенное вещество |
Температура, t°C |
Электрод сравнения |
2 |
Fe |
100 |
FeSO4·7H20, 0,5г |
30 |
Каломельный (0,1Н НКЭ) |
Решение.
Рассчитаем молярную концентрацию раствора:

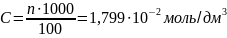 .
.
-
FeSO4·7H20
- Fe
1 моль
- 1 моль
1,799·10-2 моль/дм3
- 1,799·10-2 моль/дм3
Рассчитаем потенциал железного электрода при условиях задачи
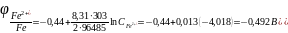 .
.
Электродом сравнения служит каломельный.
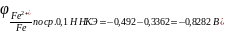 .
.
Рассчитаем потенциал железного электрода с учетом активности
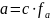 ,
,
где fa – фактор активности с учетом ионной силы раствора.
 ;
;
Рассчитаем по формуле Хюккеля-Дюбая fa или определим fa по справочной таблице.
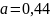 ;
;
Подставим значение a в формулу Нернста и получим:
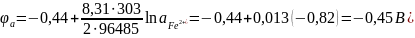 .
.
Задача 2
Вычислить pH раствора и С(Н+) по следующим данным:
№ варианта |
Электроды |
|
Δ |
|
Индикаторный |
Сравнения |
|||
2 |
Водородный |
Каломельный (0,1Н KCl) |
30 |
0,624 |
Решение.
Потенциал водородного электрода φН связан с концентрацией ионов водорода и рН в уравнении:
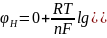 .
.
ЭДС элемента, состоящего из водородного каломельного электродов:
 ;
;
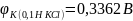 ;
;
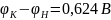 ;
;
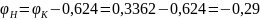 B.
B.
Следовательно:
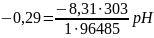 ;
;
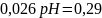 ;
;
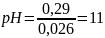 .
.
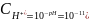 .
.
Ответ: pH
= 11;
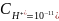 .
.
Задача 3(Рефрактометрия)
Вычислить молярную рефракцию вещества В (…), если показатель преломления n=… , а плотность раствора ρ=… , г/см3. Сравнить найденную рефракцию с вычисленной по таблице атомных рефракций.
№ варианта |
Вещество В |
n |
ρ, г/см3 |
2 |
Йодистый метил |
1,5257 |
2,279 |
Решение.
Вычисляем молярную рефракцию по формуле
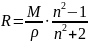 .
.
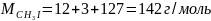 .
.
Подставляя приведенные в задаче величины получаем:
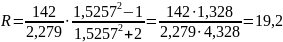 .
.
По таблице атомных рефракций находим:
RC=2,418;
RH=1, 100;
RI=13, 900;
отсюда
 .
.
Сходимость результатов удовлетворительная.
Задача 4 (фотометрия)
Навески образцов (mнав), содержащих определяемый металл, растворили в подходящих растворителях. Получили раствор объемом Vр(см3). Аликвоты полученного раствора Vал(см3) перенесли в мерные колбы объемом Vк(см3). При необходимости к одной из аликвот добавили известную массу определяемого металла m(Ме)ст (мг). В мерные колбы добавили необходимые реагенты для получения окрашенного соединения определяемого металла. Растворы в мерных колбах разбавили водой до метки и измерили оптические плотности полученных растворов (Ax, Ax+ст). Воспользовавшись уравнением Бугера –Ламберта –Бера, определить параметры, обозначенные «х».
Вариант |
Ме |
Навеска mнав, г |
Vр, см3 |
Vк, см3 |
Vал, см3 |
m(Ме)ст, мг |
ε |
l, см |
С(Ме)ал, моль/дм3 |
Содержание Ме, % |
Ax |
Ax+ст |
2 |
Cu |
0,3510 |
250 |
25 |
10 |
- |
4660 |
2 |
x |
x |
0,14 |
- |
Решение.
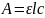 ,
отсюда
,
отсюда
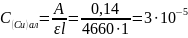 моль/дм3.
моль/дм3.
Масса меди в аликвоте:
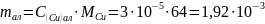 г.
г.
Определим массу меди в первоначальном растворе:
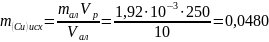 г.
г.
Вычислим содержание металла
-
mнав = 100%
m(Сu)исх = x%
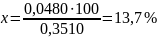 .
.
Задача 5(Кондуктометрия. Высокочастотное титрование)
5.1 Раствор вещества CaCl2 титруют раствором вещества (NH4)2C2O4. Составить уравнение химической реакции и, пользуясь таблицей подвижности ионов, определить вид кривой кондуктометрического титрования.
Решение.
CaCl2+(NH4)2C2O4=CaC2O4↓+2HNO3
Ион |
Подвижность λ∞, (Ом-1·см-1) |
½ Ca2+ |
59,5 |
Cl- |
76,4 |
NH4+ |
73,6 |
½ C2O42- |
74,0 |
По уравнению реакции катион Ca2+ и анион C2O42- выходят из раствора в осадок.
До точки эквивалентности катион Ca2+ связан и замещен на катион NH4+. Сравним подвижности ½Са2+ и NH4+: 59,5 и 73,6 Ом-1·см-1 соответственно. До точки эквивалентности кривая будет несколько возрастать по подвижности катион Са2+ связывается с анионом NH4+ и кривая резко возрастает, т.к. в растворе остаются только ионы Н+ и NO3-