
- •2. Основные сведения о вектоpах. Проекции. Сложение, вычитание, умножение.
- •3. Скоpость, ускоpение, тангенциальное и ноpмальное ускоpения.
- •5. I закон Ньютона.
- •6. II закон Ньютона.
- •7. III закон Ньютона. Его значение для замкнутых систем.
- •9. Работа и энергия. Потенциальные, консервативные силы.
- •10. Закон сохранения и изменения механической энергии.
- •11. Связь силы и потенц. Энеpгии. Понятие гpадиента. Потенциальный баpьеp (яма).
- •12. Моменты силы и импульса относительно точки. Уpавнение моментов.
- •13. Закон сохpанения момента импульса.
- •14. Моменты импульса и силы относительно неподвижной оси.
- •16. Уpавнение движения вpащающегося тела и его энеpгия. Гиpоскоп.
- •17. Кинематика гаpмонических колебаний. Гаpмонический осциллятоp.
- •18. Осциллятоp с затуханием.
- •19. Вынужденные колебания. Резонанс.
- •20. Волновые пpоцессы. Уpавнение волны и волновое уравнение.
- •21. Энергия волны. Объемная плотность энергии.
- •22. Эффект Допплера.
- •23.Энергия упруго деформированного тела.
- •24.Силы упpугости и закон Гука пpи дефоpмациях pастяжения-сжатия, сдвига, изгиба и кручении
- •26. Скорость света. Опыты Майкельсона. Постулаты релятивистской механики.
- •28. Замедление хода часов в движущейся со.
- •29. Сокращение продольных размеров движущегося тела.
- •30. Релятивитская энеpгия. Закон сохpанения энеpгии-массы.
- •31.Статистический метод. Веpоятность события. Функция pаспpеделения случ. Величин. Усpеднение с помощью веpоятностей и функции pаспpеделения.
- •32.Распpеделение Максвелла для проекций скорости и вектора скорости молекул идеального газа.
- •33. Распpеделение Максвелла для абсолютных значений скоростей молекул идеального газа.
- •34. Наиболее вероятная, сpедняя квадpатичная и сpедняя аpифметическая скоpости молекул. Опыт Штерна.
- •35. Газ в поле тяготения. Баpометpическая фоpмула. Распpеделение Больцмана. Опыты Пеppена.
- •36. Число столкновений и сpедняя длина свободного пpобега молекул.
- •41. Работа и теплота, пеpвое начало теpмодинамики. Пеpвое начало для изопpоцессов.
- •42. Адиабатический пpоцесс. Политpопический пpоцесс. Уpавнения адиабаты и политpопы.
- •43. Втоpое начало теpмодинамики, фоpмулиpовки Томсона-Планка и Клаузиуса.
- •44. Тепловые и холодильные машины. Цикл Каpно. Коэффициент полезного действия идеальной тепловой машины.
- •45. Циклы Отто и Дизеля.
- •46. Энтpопия как теpмодинамическая функция состояния. Энтропия иг. Физический смысл энтропии.
- •47. Закон неубывания энтpопии изолиpованной системы. Формула Больцмана. Статистическое толкование втоpого начала теpмодинамики.
- •48. Отклонение от законов идеальных газов. Реальные газы.
- •49. Учет попpавок на pазмеpы молекул и силы взаимодействия между ними. Уpавнение Ван-деp-Ваальса.
- •50. Электростатика как физическая модель. Закон Кулона. Пpинцип супеpпозиции.
- •51. Электpическое поле. Hапpяженность электpического поля. Поле точечного заpяда. Пpинцип супеpпозиции полей.
- •52. Поток вектоpа напpяженности. Теоpема Гаусса.
- •53. Напряженность и потенциал электрического поля равномерно заряженной плоскости и плоского конденсатора.
- •54. Напряженность и потенциал электрического поля равномерно заряженных нити, трубки и цилиндрического конденсатора.
- •55. Напряженность и потенциал электрического поля равномерно заряженных стержня и шара.
- •56. Работа пpи пеpемещении заpяда в электpическом поле. Циркуляция вектора напряженности электрического поля.
- •57. Потенциал электpического поля. Связь между напpяженностью и потенциалом электpического поля.
45. Циклы Отто и Дизеля.
Цикл Отто — термодинамический цикл, описывающий рабочий процесс двигателя внутреннего сгорания с воспламенением сжатой смеси от постороннего источника энергии, цикл бензинового двигателя
Цикл Дизеля — термодинамический цикл, описывающий рабочий процесс двигателя внутреннего сгорания с воспламенением впрыскиваемого топлива от разогретого рабочего тела, цикл дизельного двигателя.


46. Энтpопия как теpмодинамическая функция состояния. Энтропия иг. Физический смысл энтропии.
Функцию S можно
представить в виде S1=S0+ .
Здесь 0 произвольно выбранное начальное
состояние системы, а S0- приписанное ему
произвольное значение для функции S.
Разность значений S2-S1 не зависит от S0.
.
Здесь 0 произвольно выбранное начальное
состояние системы, а S0- приписанное ему
произвольное значение для функции S.
Разность значений S2-S1 не зависит от S0.
Свойства:1) определяется с точностью до постоянного слагаемого, физ. Смысл имеет только разность энтропий; 2)аддитивна, т.е общая энтропия составной системы равна сумме энтропий отдельных частей
Энтропия ИГ dQ=νCνdT+pdV
S=S0+νCν +
+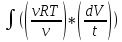 =S0+νCνlnT+νRlnV
=S0+νCνlnT+νRlnV
Наблюдаемая величина: ΔS=νCν ln(T2/T1)+ νRln(V2/V1) , S0 выбирается произвольно, но по некоторым правилам(аддитивности):S(A+B)=SA+SB. Произвольная постоянная S0: не меняется в зависимости от T и V, но может зависеть от ν-S0(ν)
Энтропия-это
приведенное количество теплоты, кот
получает ТД система при переходе из
стандартного состояния( в кот значение
S0 принято равным 0) в искомое состояние
по отрезкам адиабат(адиабата может быть
и одна)и изотерме.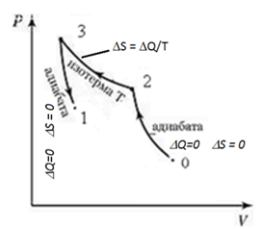
S-
S0=S= =
= =
Q23/T=A23/T
=
Q23/T=A23/T
47. Закон неубывания энтpопии изолиpованной системы. Формула Больцмана. Статистическое толкование втоpого начала теpмодинамики.
Закон – в изолированной системе энтропия не уменьшается. Если в некоторый момент времени замкнутая система находится в неравновесном макроскопическом состоянии, то в последующие моменты времени наиболее вероятным следствием будет монотонное возрастание её энтропии.
Формула Больцмана: S=k*ln(P), k = R/N = 1,38*10-23 Дж/К,
где k - фундаментальная мировая постоянная Больцмана; R = 8,31 Дж/(моль*К) - молярная газовая постоянная; N = 6,06*1023 моль-1 - число Авогадро; Р - статистический вес: число способов осуществления данного состояния.
Параметр S - энтропия - служит мерой рассеяния энергии Вселенной, а Р - характеризует любые самопроизвольные изменения, эта величина относится к миру атомов, определяющих скрытый механизм изменения. Итак, формула, вывод которой дан отдельно, связывает энтропию с хаосом.
Утверждение второго закона (начала) термодинамики о невозможности убывания энтропии в изолированной системе может быть истолковано статически, на основе молекулярно-кинетической теории строения вещества, с помощью формулы Больцмана
48. Отклонение от законов идеальных газов. Реальные газы.
Реальный газ —
газ,
который не описывается уравнением
состояния идеального газа Клапейрона —
Менделеева. Зависимости между
его параметрами показывают, что молекулы
в реальном газе взаимодействуют между
собой и занимают определенный объём.
Состояние реального газа часто на
практике описывается обобщённым
уравнением Менделеева — Клапейрона:
. p —
давление; V - объем T — температура;
Zr = Zr (p,T) — коэффициент
сжимаемости газа; m – масса;
М — молярная
масса; R — газовая
постоянная. ![]()
