Использование в промышленности
Первая в мире электростанция, использующая для выработки электричества явление осмоса, открылась 24 ноября 2009 года в Норвегии. Солёная морская и пресная вода на электростанции разделены мембраной; так как концентрация солей в морской воде выше, между солёной и пресной водой развивается явление осмоса, в результате чего давление солёной воды самопроизвольно возрастает. Так как давление солёной воды подвергшейся осмосу больше, чем атмосферное давление, возникает мощный поток воды, который и приводит в действие гидротурбину, вырабатывающую энергию.
Значение осмоса в природе
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворенных в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворенном состоянии внутри клетки она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Осмос широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко минерализованной воды методом "обратного" осмоса жидкостей.
Клетки растений используют осмос также для увеличения объёма вакуоли, чтобы она распирала стенки клетки. Клетки растений делают это путём запасания сахарозы. Увеличивая или уменьшая концентрацию сахарозы в цитоплазме, клетки могут регулировать осмос. За счёт этого повышается упругость растения в целом. С изменениями тургорного давления связаны многие движения растений (например, движения усов гороха и других лазающих растений). Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для поддержания постоянной концентрации растворённых в ней веществ.
Осмос также играет большую роль в экологии водоёмов. Если концентрация соли и других веществ в воде поднимется или упадёт, то обитатели этих вод погибнут из-за пагубного воздействия осмоса.
Экологическое значение осмоса
У растений разных местообитаний при повышении концентрации клеточного сока растет потенциальное осмотическое давление, т. е. снижается гидратура, уменьшается степень гидратации клетки, что влияет на протекание жизненных функций, на процессы роста. Способность видов расти в разных местообитаниях во многом определяется той сосущей силой, которую они могут развить. Гидратура гомойогидрических высших растений может поддерживаться в константном состоянии только в том случае, если потеря ими воды на транспирацию будет покрываться получением ее из почвы.
При оптимальной влажности почвы и (воздуха поддержание гидратуры не составляет труда.
Но при неблагоприятном водном режиме, особенно при недостатке воды в почве, потери на транспирацию начинают превышать количество получаемой растением воды. Поскольку вода в растении в основном содержится в составе клеточного сока вакуолей, то при снижении поступления воды повышается концентрация клеточного сока, что ведет к повышению осмотического давления и снижению гидратуры растения. Таково прямое воздействие недостатка воды в почве.
Осмотическое давление
диффузное
давление, термодинамический параметр,
характеризующий стремление раствора
к понижению концентрации при соприкосновении
с чистым растворителем вследствие
встречной диффузии молекул растворённого
вещества и растворителя.
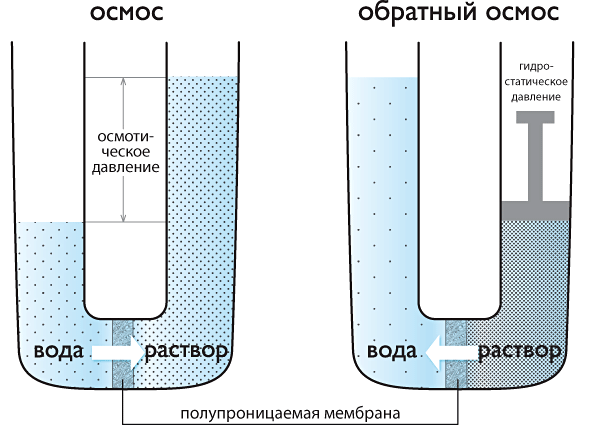
Если раствор отделен от чистого растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия ? осмотическое всасывание растворителя через мембрану в раствор. В этом случае О. д. становится доступной для прямого измерения величиной, равной избыточному давлению, приложенному со стороны раствора при осмотическом равновесии. О. д. обусловлено понижением химического потенциала растворителя в присутствии растворённого вещества. Тенденция системы выравнивать химические потенциалы во всех частях своего объёма и перейти в состояние с более низким уровнем свободной энергии вызывает осмотическое (диффузионный) перенос вещества.
О. д. в идеальных и предельно разбавленных растворах не зависит от природы растворителя и растворённых веществ; при постоянной температуре оно определяется только числом «кинетических элементов» ? ионов, молекул, ассоциатов или коллоидных частиц ? в единице объёма раствора.
Первые измерения О. д. произвёл В. Пфеффер (1877), исследуя водные растворы тростникового сахара. Его данные позволили Я. X. Вант-Гоффу установить (1887) зависимость О. д. от концентрации растворённого вещества, совпадающую по форме с Бойля ? Мариотта законом для идеальных газов. Оказалось, что О. д. (p) численно равно давлению, которое оказало бы растворённое вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объём, равный объёму раствора.
Для весьма разбавленных растворов недиссоциирующих веществ найденная закономерность с достаточной точностью описывается уравнением: pV = nRT, где n ? число молей растворённого вещества в объёме раствора V; R ? универсальная газовая постоянная; Т ? абсолютная температура. В случае диссоциации вещества в растворе на ионы в правую часть уравнения вводится множительi > 1, коэффициент Вант-Гоффа; при ассоциации растворённого вещества i < 1. О. д. реального раствора (p?) всегда выше, чем идеального (p??), причём отношение p?/ p?? = g, называемое осмотическим коэффициентом, увеличивается с ростом концентрации.
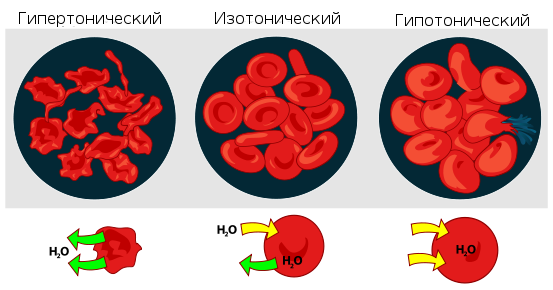
Растворы с одинаковым О. д. называется изотоническими или изоосмотическими. Так, различные кровезаменители и физиологические растворы изотоничны относительно внутренних жидкостей организма. Если один раствор в сравнении с другим имеет более высокое О. д., его называют гипертоническим, а имеющий более низкое О. д. ? гипотоническим.
Изотонические растворы (изоосмотические растворы) — растворы, имеющие одинаковое осмотическое давление. Если два раствора не изотоничны, то раствор с большим осмотическим давлением (см.) называют гипертоническим, а раствор с меньшим осмотическим давлением — гипотоническим. В физиологии и медицине изотонические растворы принято называть растворы, осмотическое давление которых равно осмотическому давлению крови, лимфы. Попадая в организм, изотонические растворы не нарушают нормального функционирования клеток и тканей. Для человека изотонические растворы будут, например, 0,9% раствор хлорида натрия, 5% раствор глюкозы. Изотонические растворы хлорида натрия вводят внутривенно для увеличения кровяного давления после больших кровопотерь, для возмещения объема жидкости в организме при сильном обезвоживании (ожоговая болезнь, обильные рвоты и т. п.). Изотонические растворы, приближающиеся по составу, величине рН, буферным и другим свойствам к сыворотке крови, называемые физиологическими растворами, используются в качестве кровезаменителей.
Гипотонические растворы (греч, hypo- + tonos напряжение) - растворы, осмотическое давление к-рых ниже осмотического давления плазмы крови. При прямом воздействии этих растворов на ткани вследствие разницы осмотического давления в системе раствор-ткань происходит перемещение воды в клетки, в результате чего клетки и ткани набухают. При введении в сосуды Г. р. могут вызвать гемолиз эритроцитов. В связи с этим при необходимости внутривенного введения Г. р. предварительно определяют осмотическую резистентность эритроцитов. При приеме внутрь Г. р. вызывают увеличение диуреза. В мед. практике Г. р. имеют ограниченное применение. Так, Г. р. натрия хлорида (0, 6%) иногда используется для приготовления р-ров местных анестетиков в целях уменьшения всасывания последних в кровь.
Гипертонические растворы, растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. В зависимости от функциональной, видовой и экологической специфики клеток осмотическое давление в них различно, и раствор, гипертоничный для одних клеток, может оказаться изотоничным или даже гипотоничным для др. При погружении растительных клеток в Гипертонические растворы он отсасывает воду из клеток, которые уменьшаются в объёме, а затем дальнейшее сжатие прекращается и протоплазма отстаёт от клеточных стенок (см. Плазмолиз). Эритроциты крови человека и животных в Гипертонические растворы также теряют воду и уменьшаются в объёме. Гипертонические растворы в сочетании с гипотоническими растворами и изотоническими растворами применяют для измерения осмотического давления в живых клетках и тканях.