- •34. Азотная кислота: состав, свойства, области применения. Технология производства азотной кислоты. Сорта азотной кислоты, условия хранения и транспортирования в соответствии с гост.
- •Азотная кислота
- •Физические и физико-химические свойства
- •1.Плотность азотной кислоты в зависимости от концентрации.
- •Химические свойства
- •Нитраты
- •Растворимость кислот, оснований и солей в воде[скрыть]
- •Гост 701-89 Кислота азотная концентрированная. Технические условия
34. Азотная кислота: состав, свойства, области применения. Технология производства азотной кислоты. Сорта азотной кислоты, условия хранения и транспортирования в соответствии с гост.
Азотная кислота
Азотная кислота |
|
|
|
|
|
Общие |
|
Систематическое наименование |
азотная кислота |
Химическая формула |
HNO3 |
Отн. молек. масса |
63.012 а. е. м. |
Молярная масса |
63.012 г/моль |
Физические свойства |
|
Состояние (ст. усл.) |
жидкость |
Плотность |
1,513 г/см³ |
Термические свойства |
|
Температура плавления |
-41,59 °C |
Температура кипения |
82,6 °C |
Молярная теплоёмкость (ст. усл.) |
109,9 Дж/(моль·К) |
Энтальпия образования (ст. усл.) |
-174,1 кДж/моль |
Удельная теплота испарения |
39,1 Дж/кг |
Удельная теплота плавления |
10,47 Дж/кг |
Давление пара |
56 гПА |
Химические свойства |
|
pKa |
-1,64 [1] |
Растворимость в воде |
смешивается г/100 мл |
Оптические свойства |
|
Показатель преломления |
1.397 |
Структура |
|
Дипольный момент |
2.17 ± 0.02 Д |
Классификация |
|
Рег. номер CAS |
7697-37-2 |
Рег. номер EINECS |
231-714-2 |
SMILES |
O[N+](=O)[O-] |
Регистрационный номер EC |
231-714-2 |
RTECS |
QU5775000 |
Токсикология |
|
ЛД50 |
430 мг/кг |
Токсичность |
0 4 0 OX
|
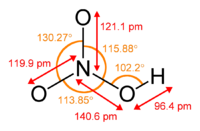
Азо́тная кислота́ (HNO3), — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O).
Содержание
|
Физические и физико-химические свойства
1.Плотность азотной кислоты в зависимости от концентрации.

Фазовая диаграмма водного раствора азотной кислоты.
Азот в азотной кислоте четырёхвалентен[2], степень окисления +5. Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C с частичным разложением. Растворимость азотной кислоты в воде не ограничена. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см, Tкип = 120,7 °C)
При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
моногидрат HNO3·H2O, Tпл = −37,62 °C
тригидрат HNO3·3H2O, Tпл = −18,47 °C
Твёрдая азотная кислота образует две кристаллические модификации:
моноклинная, пространственная группа P 21/a, a = 1,623 нм, b = 0,857 нм, c = 0,631, β = 90°, Z = 16;
ромбическая
Моногидрат образует кристаллы ромбической сингонии, пространственная группа P na2, a = 0,631 нм, b = 0,869 нм, c = 0,544, Z = 4;
Плотность водных растворов азотной кислоты как функция её концентрации описывается уравнением
d(c) = 0,9952 + 0,564c + 0,3005c2 − 0,359c3
где d — плотность в г/см³, с — массовая доля кислоты. Данная формула плохо описывает поведение плотности при концентрации более 97 %.