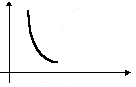
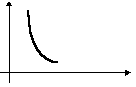
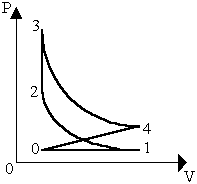
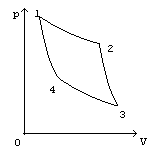Дополнительные графики.(температура измеряется по шкале Цельсия).
1 . Закон Гей-Люссака. V 2. Закон Шарля p
t0C t0C

Сравнение параметров по графику.
Т.к.
p1>p2
(по графику), а по закону Шарля (АВ -
изохора)
![]() ,
то Т1>T2.
,
то Т1>T2.
Чем выше лежит изотерма, тем выше температура.

Т.к. T1 < T2 , а по закону Шарля (АВ - изохора) , то р1<р2.
Чем ниже лежит изобара, тем больше давление.
Т .к.
T1
< T2
, а по закону Гей-Люссака (АВ - изобара)
.к.
T1
< T2
, а по закону Гей-Люссака (АВ - изобара)
![]() ,
то V1<V2.
,
то V1<V2.
Чем ниже лежит изохора, тем больше объем.
Коэффициенты
1.
Температурный коэффициент объемного
расширения. Обозначим V0
- объем газа при 00С
= 273 К. Тогда:
![]() .
Обозначим =1/273
К-1.
Следовательно: V=V0T
или V=V0(t0+273)=
V0(1+t0).
.
Обозначим =1/273
К-1.
Следовательно: V=V0T
или V=V0(t0+273)=
V0(1+t0).
2.
Температурный коэффициент давления.
Обозначим p0
- давление
газа при 00С
= 273 К. Тогда:
![]() .
Обозначим =1/273
К-1.
Следовательно: p=p0T
или p=p0(t0+273)=
p0(1+t0).
.
Обозначим =1/273
К-1.
Следовательно: p=p0T
или p=p0(t0+273)=
p0(1+t0).
|
§2.14. Внутренняя энергия 1-й закон термодинамики. |
|
|||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Сумма кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул, атомов) и потенциальных энергий их взаимодействия друг с другом называется внутренней энергией. |
|
|||||||||||||
|
Внимание! 1. Энергия упорядоченного движения частиц тела представляет собой механическую кинетическую энергию тела. 2. Вообще говоря, во внутреннюю энергию входят энергии внутриатомных частиц, но при не очень больших температурах эта энергия остается неизменной. Кинетическая энергия частиц определяется скоростью, а значит - температурой тела. Потенциальная - расстоянием между частицами, а значит - объемом. Следовательно: U=U(T,V) - внутренняя энергия зависит от объема и температуры. |
U=U(T,V) |
|||||||||||||
|
Для идеального
газа: U=U(T), т.к. взаимодействием
на расстоянии пренебрегаем.
Внутренняя энергия - однозначная функция состояния (с точностью до произвольной постоянной) и в замкнутой системе сохраняется. Обратное неверно(!) - одной и той же энергии могут соответствовать разные состояния. |
Идеальный газ:
|
|||||||||||||
|
Опыты Джоуля доказали эквивалентность работы и количества теплоты, т.е. и та и другая величины являются мерой изменения энергии, их можно измерять в одинаковых единицах: 1 кал = 4,1868 Дж 4,2 Дж. Эта величина наз. механическим эквивалентом теплоты. |
|
|||||||||||||
|
Р.Майер, Д.Джоуль, Г.Гельмгольц - закон сохранения энергии для тепловых процессов - 1-й закон термодинамики. |
|
|||||||||||||
|
Изменение
внутренней энергии системы при переходе
ее из одного состояния в другое равно
сумме работы внешних сил и количества
теплоты, переданного системе:
|
|
|||||||||||||
|
Изменений внутренней энергии не зависит от способа, которым осуществляется этот переход. Т.о. существует два способа изменения внутренней энергии: совершение механической работы и теплопередача (теплообмен). Работа и количество теплоты характеризуют процесс изменения внутренней энергии, но не саму внутреннюю энергию. |
|
|||||||||||||
|
Если А - работа внешних сил, а А' - работа газа, то А = - А' (в соответствии с 3-м законом Ньютона). Тогда:
|
|
|||||||||||||
|
Невозможность создания вечного двигателя 1-го рода. Вечный двигатель первого рода - устройство, которое могло бы совершать неограниченное количество работы без затраты энергии. Тогда Q=0. Следовательно: A'= - U. Т.е. такой двигатель должен совершать работу за счет убыли внутренней энергии. Но ее запасы конечны. После того, как запас энергии будет исчерпан, двигатель остановится. |
|
|||||||||||||
|
§2.15. ТЕПЛОПЕРЕДАЧА |
|
|||||||||||||
|
Теплопередача (теплообмен) - процесс изменения внутренней энергии без совершения работы. |
|
|||||||||||||
|
Количественная характеристика - количество теплоты - часть изменения внутренней энергии, происходящего в процессе теплопередачи. Обозначается Q. Единицы измерения: Дж, кал (калория). 1 кал = 4,19 Дж. |
1 кал = 4,19 Дж |
|||||||||||||
|
Виды теплопередачи: |
|
|||||||||||||
|
1. Теплопроводность - вид теплопередачи, при котором энергия передается от более нагретого участка тела к менее нагретому, благодаря движению и взаимодействию частиц тела. Характерна для твердых тел. 2. Конвекция - вид теплопередачи, при котором энергия передается потоками (струями) вещества. Характерна для жидкостей и газов. 3. Излучение - вид теплопередачи, при котором энергия передается с помощью электромагнитных волн (преимущественно инфракрасного диапазона). Может происходить в вакууме. |
|
|||||||||||||
|
§2.16. Расчет количества теплоты. |
|
|||||||||||||
|
1. Изменение температуры. Q = cm(Т2-Т1) = cmТ. Величина с наз. удельной теплоемкостью. Она характеризует тепловые свойства вещества по его способности к изменению температуры. Удельная теплоемкость показывает на сколько изменяется внутренняя энергия 1 кг данного вещества при изменении его температуры на 1 К. Единица измерения Дж/кг.К. Q=CT. Величина С называется теплоемкостью тела. С=сm. Q = cT. Величина c называется молярной теплоемкостью (теплоемкость 1 моля вещества). |
Изменение температуры:
Q = cm(t02-t01) Q = cmt0. |
|||||||||||||
|
2. Плавление и отвердевание вещества. Q=m. - удельная теплота плавления. Удельная теплота плавления показывает на сколько изменяется внутренняя энергия 1 кг данного вещества при его полном переходе из твердого состояния в жидкое (при температуре плавления). Зависит от внешних условий. Единица Дж/кг. При плавлении и отвердевании (кристаллизации) температура остается неизменной пока вещество не перейдет в одну фазу. Энергия при плавлении тратится на разрушение кристаллической решетки. При отвердевании Q = -m. |
Плавление и отвердевание вещества Q=m
|
|||||||||||||
|
3. Парообразование и конденсация вещества. Q = Lm = rm. L ( r ) - удельная теплота парообразования. Удельная теплота парообразования показывает, на сколько изменяется внутренняя энергия 1 кг данного вещества при полном превращении жидкости в пар (при температуре кипения). Зависит от внешних условий. Единица L ( r ) Дж/кг. При кипении температура остается постоянной. Энергия тратится на разрыв связей между молекулами. При конденсации Q = -Lm = -rm. |
Q = Lm = rm
|
|||||||||||||
|
I – нагревание твердого тела; II – плавление твердого тела; III – нагревание жидкости; IV – кипение; V – нагревание газа; VI – охлаждение газа; VII – конденсация; VIII – охлаждение жидкости; IX – кристаллизация (отвердевание); X – охлаждение твердого тела. |
|
|||||||||||||
|
4. Сгорание топлива. Q = qm. q - удельная теплота сгорания топлива. Дельная теплота сгорания топлива показывает сколько энергии выделяется при полном сгорании 1 кг данного вещества. Единица q Дж/кг. Сгорание - соединение с кислородом. При горении изменяется взаимное расположение частиц вещества, следовательно, меняется их потенциальная энергия, а значит, внутренняя энергия вещества. Вещества, при горении которых выделяется энергия, являются топливом. Qполученное>0, Qвыделенное<0 Согласно закону сохранения энергии алгебраическая сумма всех количеств теплоты равна нулю (все переданное количество теплоты равно по модулю всему полученному): Q1 + Q2 + Q3 +...= 0 - уравнение теплового баланса. С учетом потерь на нагревание окружающей среды: Qпереданное = Qполученное, где - кпд нагревательного прибора. |
Q = qm
|
|||||||||||||
|
Q1 + Q2 + Q3 +...= 0 - уравнение теплового баланса. |
||||||||||||||
|
Qпереданное = Qполученное |
||||||||||||||
|
§2.17. Теплоемкости газа при постоянном объеме и постоянном давлении. |
|
|||||||||||||
|
1.
Молярная теплоемкость при постоянном
объеме:
|
|
|||||||||||||
|
2.
Молярная теплоемкость при постоянном
давлении:
|
|
|||||||||||||
|
3. Связь между теплоемкостями при постоянном давлении и постоянном объеме:
|
уравнекние Майера |
|||||||||||||
|
4. Теплоемкость при изотермическом процессе: т.к. температура не меняется, то теплоемкость бесконечна. |
|
|||||||||||||
|
§2.18. АДИАБАТНЫЙ ПРОЦЕСС - процесс, происходящий без теплопередачи (Q=0). Запись первого з-на термодинамики для А.п. - U=A, где А - работа внешних сил. Для идеального газа U=U(T). Либо работа внешних сил идет на увеличение внутренней энергии, темп-ра возрастает. Либо газ совершает работу за счет уменьшения собственной внутренней энергии (темп-ра убывает).
Уравнение
адиабаты:
|
|
|||||||||||||
|
Для
идеального одноатомного газа:
Т.к.
|
|
|||||||||||||
|
Адиабатный процесс может быть осуществлен либо в теплоизолированной системе, либо очень быстро (чтобы не успеть передать тепло - взрыв). Используется для получения жидких газов. |
Облако мощного (ядерного) взрыва, облака |
|||||||||||||
§2.19. ПРИМЕНЕНИЕ 1 ЗАКОНА ТЕРМОДИНАМИКИ К ИЗОПРОЦЕССАМ. |
|
||||||||||||||
Процесс |
Постоянные |
График |
Изменение внутренней энергии |
Запись 1-го закона термодинамики |
Физический смысл |
|
|||||||||
Изотермическое расширение |
m=const M=const T=const pV=const |
|
U=const U=0 |
Q=A' |
Изотермический процесс не может происходить без теплопередачи. Все количество теплоты, переданное системе, расходуется на совершение этой системой механической работы. |
|
|||||||||
Изотермическое сжатие |
m=const M=const T=const pV=const |
|
U=const U=0 |
A=-Q |
Изотермический процесс не может происходить без теплопередачи. Вся работа внешних сил выделяется в виде тепла. |
|
|||||||||
Изохорное нагревание |
m=const M=const V=const
|
p
V |
p T U U>0 |
A=0 Q= U |
Все количество теплоты, переданное системе, расходуется на увеличение ее внутренней энергии. |
|
|||||||||
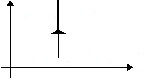
Изохорное охлаждение |
m=const M=const V=const
|
p
|
p T U U<0 |
A=0 Q= U<0 |
Система уменьшает свою внутреннюю энергию, отдавая тепло окружающим телам. |
|
|||||||||
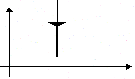
Изобарное расширение (нагревание) |
m=const M=const p=const
|
p
|
V T U U>0 |
Q=U+A' U=Q-А'>0 |
Количество теплоты, переданное системе, превышает совершенную ею механическую работу. Часть тепла расходуется на совершение работы, а часть – на увеличение внутр. энергии. |
|
|||||||||
Изобарное сжатие (охлаждение) |
m=const M=const p=const
|
P
V |
V T U U<0 |
U=Q+A<0 Q<0 |
Количество теплоты, отдаваемое системой, превышает работу внешних сил. Часть тепла система отдает за счет уменьшения внутр. энергии. |
|
|||||||||
Адиабатное Расширение |
m=const M=const
|
P
V |
U<0 U T |
Q=0 A' > 0 U=-A' < 0 A'=-U |
Система совершает механическую работу только за счет уменьшения своей внутренней энергии. |
|
|||||||||
Адиабатное сжатие |
m=const M=const
|
P V |
U>0 U T |
Q=0 A>0 U=A |
Внутренняя энергия системы увеличивается за счет работы внешних сил. |
|
|||||||||
|
§2.20. Второй закон термодинамики. Необратимость тепловых процессов. Закон сохранения энергии утверждает, что количество энергии при любых процессах остается неизменным. Но он ничего не говорит о том, какие энергетические превращения возможны. З-н сохранения энергии не запрещает, процессы, которые на опыте не происходят: - нагревание более нагретого тела более холодным; - самопроизвольное раскачивание маятника из состояния покоя; - собирание песка в камень и т.д. Процессы в природе имеют определенную направленность. В обратном направлении самопроизвольно они протекать не могут. Все процессы в природе необратимы (старение и смерть организмов). Необратимым процессом может быть назван такой процесс, обратный которому может протекать только как одно из звеньев более сложного процесса. Самопроизвольными называются такие процессы, которые происходят без воздействия внешних тел, а значит, без изменений в этих телах). Процессы перехода системы из одного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний, называются обратимыми. При этом сама система и окружающие тела полностью возвращаются к исходному состоянию. Второй з-н термодинамики указывает направление возможных энергетических превращений и тем самым выражает необратимость процессов в природе. Он установлен путем непосредственного обобщения опытных фактов. Формулировка Р. Клаузиуса: невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений в обеих системах или окружающих телах. Формулировка У. Кельвина: невозможно осуществить такой периодический процесс, единственным результатом которого было бы получение работы за счет теплоты, взятой от одного источника. Невозможнен тепловой вечный двигатель второго рода, т.е. двигатель, совершающий механическую работу за счет охлаждения какого-либо одного тела. Объяснение необратимости процессов в природе имеет статистическое (вероятностное) истолкование. Чисто механические процессы (без учета трения) обратимы, т.е. инвариантны (не изменяются) при замене t -t. Уравнения движения каждой отдельно взятой молекулы также инвариантны относительно преобразования времени, т.к. содержат только силы, зависящие от расстояния. Значит причина необратимости процессов в природе в том, что макроскопические тела содержат очень большое количество частиц. Макроскопическое состояние характеризуется несколькими термодинамическими параметрами (давление, объем, температура и т.д.). Микроскопическое состояние характеризуется заданием координат и скоростей (импульсов) всех частиц, составляющих систему. Одно макроскопическое состояние может быть реализовано огромным числом микросостояний.
Обозначим:
N-
полное число состояний системы, N1
- число микросостояний, которые
реализуют данное состояние, w
- вероятность данного состояния. Тогда
:
Энтропия - мера беспорядка. S - энтропия. Уравнение
Больцмана:
|
||||||||||||||
|
Энтропия
- функция состояния системы. В
термодинамике - это величина, определяемая
соотношением:
В этом смысле адиабатный процесс - это изоэнтропийный процесс. Из первого закона термодинамики:
Из
теоремы Карно следует:
|
|
|||||||||||||
|
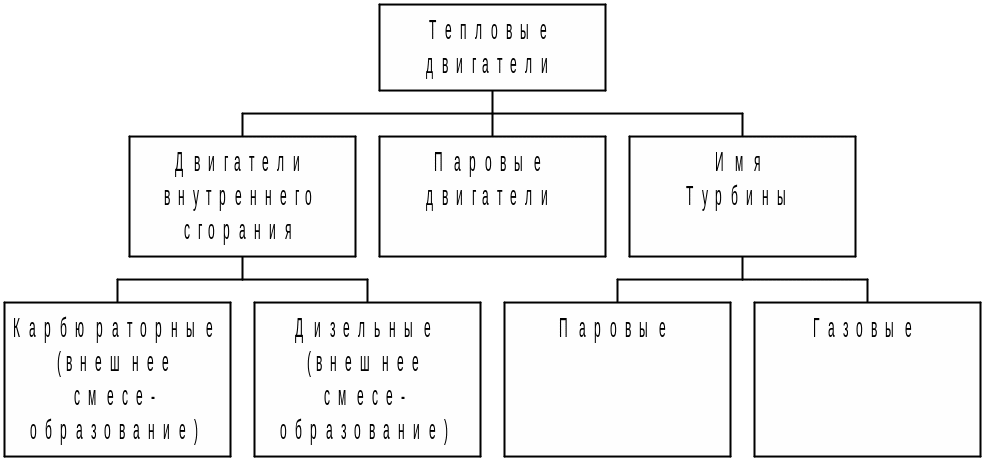
§2.21. Тепловые двигатели. Машины, преобразующие внутреннюю энергию механическую работу называют тепловыми двигателями |
||||||||||||||
|
|
||||||||||||||
|
Хронология изобретений: 1690 - пароатмосферная машина Д.Папена (Франция) - теоретически 1698 - пароатмосферная машина Т.Севери (Англия) 1705 - пароатмосферная машина Т.Ньюкомена (Англия) 1763 - паровая машина И.Ползунова (Россия) 1774 - паровая машина Д.Уатта (Англия) 1860 - двигатель внутреннего сгорания Ленуара (Франция) 1865 - двигатель внутреннего сгорания Н.Отто (Германия) 1871 - холодильная машина К.Линде (Германия) 1887 - паровая турбина К.Лаваля (Швеция) 1897 - двигатель внутреннего сгорания Р.Дизеля (Германия) |
|
|||||||||||||
|
Круговой (циклический) процесс - если в результате изменений система вернулась в исходное состояние, то говорят, что она совершила круговой процесс или цикл. А1а2>А1б2 - по модулю (из сравнения площадей). А1а2>0 А1б2<0 Суммарная работа за циклический процесс численно равна площади, ограниченной линией процесса. Из второго з-на термодинамики: ни один тепловой двигатель не может иметь кпд равный единице (100%).
|
|
|||||||||||||
|
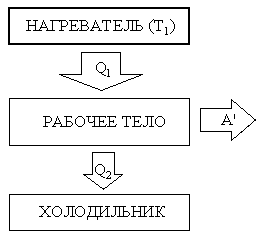
Принцип работы теплового двигателя: Q = A' + U - количество теплоты, переданное системе расходуется на совершение этой системой механической работы и на увеличение ее внутренней энергии (т.е. система должно отдать тепло в окружающее пространство) - 1-й з-н термодинамики. |
Q = A' + U |
|||||||||||||
|
Нагреватель передает тепло рабочему телу при температуре Т1. Рабочее тело совершает полезную механическую работу A'. Холодильник (охладитель) получает часть тепла, обеспечивая циклический процесс. A' = Q1 - Q2 Коэффициент полезного действия теплового двигателя:
|
|
|||||||||||||
|
Кпд реальных двигателей: турбореактивный - 20 -30%; карбюраторный - 25 -30%, дизельный - 35-45%. 0 - 1 - впуск горючей смеси (изобара) 1 - 2 - сжатие (адиабата) 2 - загорание горючей смеси 2 -3 -резкое возрастание давления (изохора) 3 -4 - рабочий ход (адиабата) 4 - 0 - выпуск |
|
|||||||||||||
|
Идеальная тепловая машина - машина Карно (Сади Карно, Франция, 1815). Машина работает на идеальном газе. 1 - 2 - при тепловом контакте с нагревателем газ расширяется изотермически. 2 -3 - газ расширяется адиабатно. После контакта с холодильником: 3 -4 - изотермическое сжатие; 4 -1 - адиабатное сжатие. |
|
|||||||||||||
|
КПД идеальной машины:
является функцией только двух температур, не зависит от устройства машины и вида топлива. |
|
|||||||||||||
|
Теорема Карно: кпд реальной тепловой машины не может быть больше кпд идеальной машины, работающей в том же интервале температур. |
|
|||||||||||||
|
Цикл Карно обратим. Машина, работающая по обратному циклу наз. холодильной машиной. |
|
|||||||||||||
|
§2.22. ИСПАРЕНИЕ И КОНДЕНСАЦИЯ. Парообразование - процесс превращения жидкости в пар. Конденсация - процесс превращения пара в жидкость. ИСПАРЕНИЕ
- процесс парообразования с поверхности
жидкости или твердого тела. Заключается
в вылетании частиц (молекул, атомов),
4. рода вещества. |
|
|||||||||||||
|
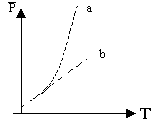
§2.23. НАСЫЩЕННЫЙ И НЕНАСЫЩЕННЫЙ ПАР. Вещество в газообразном состоянии, находящееся в динамическом равновесии со своей жидкостью, наз. насыщенным паром. Динамическое равновесие заключается в том, что процессы испарения и конденсации уравновешены. Давление насыщенного пара в зависимости от температуры (кривая а) растет быстрее, чем идеального газа (график b), т.к. с ростом температуры увеличивается концентрация, а p=nkT. |
|
|||||||||||||
|
Основное свойство насыщенного пара - давление пара при постоянной температуре не зависит от объема (см. изотерму).Участок ВС соответствует насыщенному пару. |
|
|||||||||||||
|
§2.24. КИПЕНИЕ - процесс активного парообразования во всем объеме жидкости. Сопровождается образованием и ростом пузырьков пара внутри жидкости. Пузырьки образуются около центров парообразования (примеси, микротрещины). Кипение происходит:
Температура кипения определяется
Условие роста пузырьков: pпара>pатм+gh - следовательно, с понижением атм. давления темп-ра кипения понижается. Условие подъема пузырька: FАрх mg. |
|
|||||||||||||
|
§2.25. ВЛАЖНОСТЬ. ВЛАЖНОСТЬ. ВОЗДУХА - величина, характеризующая содержание водяных паров в воздухе. АБСОЛЮТНУЮ
влажность
измеряют плотностью водяного пара в
воздухе (,
ОТНОСИТЕЛЬНАЯ
влажность
показывает, сколько процентов составляет
абсолютная влажность от необходимой
для насыщения воздуха при данной
температуре: |
|
|||||||||||||
|
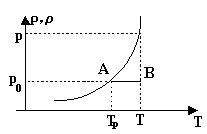
Температура, при которой воздух в процессе своего охлаждения становится насыщенным водяными парами, наз. точкой росы (см. рис.). |
|
|||||||||||||
|
Приборы для измерения влажности: волосной гигрометр, жидкостный (конденсационный) гигрометр, гигрометр психрометрический (психрометр). |
|
|||||||||||||
|
§2.26. КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ. |
|
|||||||||||||
|
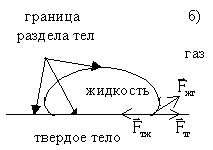
1. Явления смачивания и несмачивания. а) жидкость, которая растекается тонкой пленкой по твердому телу, называют смачивающей данное твердое тело. б) жидкость, которая не растекается по твердому телу, а стягивается в каплю, наз. несмачивающей данное твердое тело. Мерой смачивания является угол между смачиваемой поверхностью и касательной к поверхности жидкости. Этот угол называют углом смачивания или краевым углом.
2. Соотношения
между
При установлении равновесия на границе тел (жидкого, твердого и газообразного) на каждый элемент границы между ними будут действовать три силы: - между жидкостью и газом, - между твердым телом и жидкостью и - между твердым телом и газом.
Растекание
жидкости произойдет, если (в проекциях)
Из
условия равновесия:
=
Fжт+Fжгcos.
Отсюда cos= Если Fжт < Fтг, то соs>0, жидкость смачивающая. Если Fжт > Fтг, то соs<0, жидкость несмачивающая. Если Fтг-Fжт> Fжт, то равновесие не соблюдается. Такое состояние означает, что жидкость полностью смачивает твердое тело, отделяя его поверхность от газа. |
|
|||||||||||||
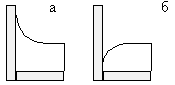
|
а) Жидкость находится в сосуде, стенки которого смачиваются. Жидкость поднимается по стенке вверх, т.к. силы взаимодействия молекул жидкости со стенками сосуда больше сил взаимодействия молекул жидкости между собой. б) Стенки сосуда несмачиваемы. Силы взаимодействия молекул жидкости со стенками сосуда меньше сил взаимодействия молекул жидкости между собой. Искривленную поверхность жидкости вблизи границы ее соприкосновения с твердым телом наз. мениском. |
|
|||||||||||||
|
4. Давление под искривленной поверхностью.
|
|
|||||||||||||
|
5. Капиллярные явления. Капилляры
- тонкие трубки, сосуды. Капиллярные
явления - подъем или опускание жидкости
в капиллярах.
|
|
|||||||||||||
|
§2.27. кристаллы Твердые тела делятся на кристаллические и аморфные. Кристаллическими (от греческого krystallos - лед) называются тела, частицы в которых (атомы, молекулы, ионы) расположены упорядочено (образуют кристаллическую решетку). Кристаллом называется тело определенной геометрической формы, ограниченное естественными плоскими гранями. Монокристаллами наз. одиночные кристаллы, имеющие макроскопическую упорядоченную кристаллическую решетку. Поликристаллами наз. совокупность хаотически сросшихся монокристаллов (зернистая структура поликристаллов - кристаллиты). Кристаллические тела одинакового химического состава могут существовать в двух или более разновидностях (модификациях) в зависимости от условий. Это свойство наз. полиморфизмом. Примеры: графит и алмаз. Они различаются типом кристаллической решетки и, следовательно, физическими свойствами. Кристаллы изучаются наукой кристаллографией. Существует 230 типов кристаллических решеток (32 класса симметрии), определяющих свойства кристаллов. Одним из наиболее существенных свойств монокристаллов является анизотропия - зависимость (неодинаковость) свойств кристалла от направления. Примеры:
Поликристаллы изотропны и могут не иметь правильной геометрической формы. Кристаллическая решетка. Частицы в кристалле колеблются около положений равновесия - узлов кристаллической решетки, расположенных на определенных расстояниях друг от друга в определенном порядке. Расстояния между самими частицами меняются вследствие теплового движения. Наименьший фрагмент, повторением которого можно образовать всю решетку наз. элементарной ячейкой. Длина ребра элементарной ячейки наз. периодом решетки. Выделяют четыре типа кристаллов:
|
||||||||||||||
|
Вопрос - ответ. 1. При выводе уравнений МКТ используется понятие средней квадратичной скорости. Зачем нужно такое сложное понятие? Почему нельзя просто пользоваться средней скоростью? Ответ: Вычисление средних величин в физике не простая задача. Например, среднее значение вектора скорости молекулы в газе равно нулю. Действительно, среднее значение вектора есть вектор. Но, куда может быть направлен этот вектор, если все направления в пространстве, занимаемом молекулярным газов эквивалентны (полем тяжести мы пренебрегаем)? Если на основе нулевого вектора средней скорости вычислить квадрат среднего вектора скорости, то это значение, естественно тоже будет равно нулю. Но среднее значение квадрата скорости уже не равно нулю, что следует уже из распределения. Используя закон распределения молекул по скоростям (см. рисунок на стр. ), можно вычислить среднее значение модуля скорости молекулы. Оказывается, это значение тоже не равно средней квадратичной скорости. Средняя квадратичная скорость просто получается при выводе уравнений МКТ. 2. Почему изменяются соотношения между кинетическими и потенциальными энергиями при переходе от газа к жидкости? Что при этом изменяется кинетическая энергия или потенциальная? Ответ: Кинетическая энергия движения частиц определяется температурой тела. По порядку величины эта энергия равна kT (см. вывод уравнения МКТ для газа). Потенциальная энергия в газе мала потому, что в среднем молекулы находятся на таких расстояниях друг от друга, что энергия притяжения очень мала. При переходе от газа к жидкости, а затем к твердому телу среднее расстояние между молекулами уменьшается и потенциальная энергия становится значительной (r на рисунке на стр. сравнимо с размерами молекулы). 3. Каковы ограничения модели идеального газа, и чем они обусловлены?
Ответ: При выводе
уравнений идеального газа пренебрегается
объемом молекул и потенциальной
энергией притяжения между молекулами.
Это допустимо только в случае, когда
в среднем молекулы находятся далеко
друг от друга. При уменьшении объема,
занимаемого газом среднее расстояние
между молекулами уменьшается. Но, в
соответствии с уравнением состояния
газа, V пропорционально
4. В таблице на стр. приведены время релаксации и время, необходимое для теплообмена. Чем они определяются и как соотносятся между собой. Ответ: Весь изложенный в данном разделе материал относится к равновесному состоянию газа. В природе, естественно существуют и неравновесные состояния. Например, если Вы откроете баллон со сжатым газом, газ начнет выходить из сосуда. При таком процессе состояние газа неравновесное, оно не может быть охарактеризовано такими параметрами, как температура, давление, объем плотность. Если Вы производите какие-то процессы над газом, например, сжимаете газ, то в первые моменты состояние также является не равновесным, но затем устанавливается равновесие. Время за которое устанавливается равновесие и называется временем релаксации. По порядку величины оно равно среднему времени между столкновениями молекул и, естественно, уменьшается с увеличением плотности газа. Время, необходимое для теплообмена есть время, за которое устанавливается равновесие между газом и внешней системой, то есть температура газа и температура внешней системы становятся равны. Это время зависит от толщины и теплопроводности стенок сосуда, в котором находится газ, и от того, что представляет собой внешняя система (во что помещен сосуд с газом). Как правило, это время много больше времени релаксации. Вы можете провести простой опыт, сжимая надутый воздушный шарик. При быстром сжатии Вы руками почувствуете тепло, процесс адиабатный. Если сжатие производить медленно, газ успевает отдать затраченную вами энергию окружающему воздуху, и температура газа в шарике практически не увеличивается, то есть процесс изотермический. 5. Что означает, что энтропия - функция состояния системы? Энтропия по Больцману и энтропия в термодинамике это одно и тоже? Ответ: То, что энтропия является функцией состояния, означает, что при изменении состояния газа энтропия изменяется на некоторую величину, зависящую только от начального и конечного состояния газа. В отличие от этого, например, работа, совершаемая газом при расширении зависит от того, каким путем происходит переход между состояниями. Как видно из рисунка на стр. работа (площадь под кривой) зависит от формы кривой, то есть от вида процесса перехода. Определение энтропии по Больцману называется статистическим определением энтропии. Оно связано с молекулярно-кинетической теорией. Термодинамическое определение энтропии не связано с современным пониманием температуры и теплоты (когда-то предполагалось, что при нагреве тела ему передается некоторая жидкость - теплород). В термодинамике закон возрастания энтропии рассматривается как опытный закон, и только развитие МКТ показало, что этот закон связан с тем, что вероятность нахождения замкнутой системы в менее упорядоченном состоянии больше, чем для более упорядоченного состояния. Именно в силу вероятностных законов и выполняется второе начало термодинамики. Естественно, что оба определения энтропии согласуются между собой. 6. 1-й закон термодинамики утверждает, что невозможна передача тепла от более нагретого тела к менее нагретому. Но ведь именно это происходит в холодильнике. Первый закон термодинамики в формулировке Клаузиуса утверждает, что невозможен такой термодинамический процесс единственным результатом которого будет передача тепла от более нагретого тела к менее нагретому. В холодильной машине это не единственный результат - работу совершает двигатель холодильника. |
||||||||||||||
|
ПРОВЕРЬ СЕБЯ
Изучив тему МКТ и термодинамика вы должны знать: 1. Три основных положения о строении вещества и их опытное обоснование. 2. Законы и закономерности:
3. Физические величины, их смысл и единицы измерения в СИ, способы их измерения и/или вычисления, связи между этими величинами:
4. Понятия:
5. Устройство, назначение и принцип действия приборов:
|
||||||||||||||
|
Изучив тему МКТ и термодинамика вы должны понимать: 1. Статистический характер законов молекулярной физики; 2. Сущность модели идеального газа и границы ее применения; 3. Характер движения и взаимодействия частиц вещества;
Изучив тему МКТ и термодинамика вы должны уметь: 1. Описывать опыты Перрена и Штерна; 2. Измерять: плотность, температуру, давление, влажность. 3. Строить графики:
4. Объяснять
|
||||||||||||||


 .
. .
.
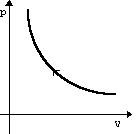
 V
V
 V
V