
Лекция 14
Комплексные соединения в биологи и медицине
1. Образование и реакции комплексных соединений.
Мы ограничимся рассмотрением реакций образования комплексных соединений в водных растворах. Следует учитывать, что молекулы воды представляют собой один из обычных лигандов в комплексных соединениях. Поэтому образование комплексов в водных растворах, по существу, представляет собой замещение молекул воды в аквакомплексах на другие молекулы и ионы.
Рассмотрим образование комплексных соединений меди в водном растворе сульфата меди CuSO4. Раствор имеет голубой цвет вследствие присутствия гидратированных ионов меди, представляющих собой аквакомплексы [Cu(H2O)4]2+ и [Cu(H2O)6]2+ Для ионов Cu2+ характерно координационное число 4, но оно может повышаться и до 6. Для дальнейших рассуждений это не имеет принципиального значения. Ион SO42– в составе соли связывается с ионом меди слабее, чем молекулы воды, и присутствует в растворе в свободном виде. При добавлении к этому раствору избытка аммиака окраска становится интенсивной сине-фиолетовой. Вода в аквакомплексе замещается на аммиак:
[Cu(H2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ + 4H2O
Легко доказать обратимость этой реакции. При добавлении раствора HCl избыток аммиака вступает в реакцию, комплекс начинает терять аммиак, который замещается на воду; раствор возвращается к исходной окраске. Если для проведения реакции вместо аммиака взять раствор этилендиамина, то образуется более прочный хелатный комплекс меди. Окраска раствора темно синяя.
C
 H2NH2
NH2CH2
H2NH2
NH2CH2
 [Cu(H2O)4]2+
+ 2NH2(CH2)2NH2
= Cu2+
+ 4H2O
[Cu(H2O)4]2+
+ 2NH2(CH2)2NH2
= Cu2+
+ 4H2O
CH2NH2 NH2CH2
Комплексные соединения могут образовываться непосредственно при окислении металлов d-блока 5 и 6 периодов в присутствии лигандов, способствующих окислению.
Золото окисляется кислородом в присутствии цианида. Получаемый раствор дицианоаурата(I) калия бесцветен.
4Au + O2 + 8KCN + 2H2O = 4K[Au(CN)2] + 4KOH
Платина окисляется азотной кислотой в присутствии соляной кислоты. Хлороводород так же играет роль комплексообразователя, способствующего окислению.
Pt + 2HNO3 + 6HCl = H2[PtCl6] + NO2↑ + NO↑ + 3H2O
Следует обратить внимание на то, что продуктом реакции является комплексная кислота. Раствор имеет интенсивный желто-оранжевый цвет.
Обычными для комплексных соединений являются реакции обмена ионов внешней сферы, которые идут при выполнении тех же условий, как и ионообменные реакции обычных солей, оснований и кислот. Например, при добавлении хлорида калия к раствору платинохлороводородной кислоты выпадает малорастворимая соль гексахлороплатинат калия желтого цвета:
H2[PtCl6] + 2KCl = K2[PtCl6]↓ + 2HCl
Ц
+2
+3
2
+4
+2
K
желтый осадок
красный раствор
У атома железа КЧ 6 при изменении степени окисления сохранилось. Но в случае платины уменьшение степени окисления от 4 до 2 повлекло за собой уменьшение КЧ от 6 до 4. Это связано с особенностями электронной структуры центральных атомов.
В комплексных соединениях могут окисляться и лиганды. Например, при действии перекиси водорода на светлозеленый раствор триоксалато-феррата(III) калия образуется бурый осадок гидроксида железа:
K3[Fe(C2O4)3] + 3H2O2 = Fe(OH)3↓ + 6CO2↑ + 3KOH
Лиганды могут проявлять свойства, отсутствующие у соответствующих молекул в свободном состоянии. Известно, что аммиак в растворе не реагирует со щелочью, то есть не отдает протон. Но комплексное соединение [Pt(NH3)2(CN)4] проявляет свойства слабой кислоты:
[Pt(NH3)2(CN)4] + KОН = K[Pt(NH2)(NH3)(CN)4] + Н2О
Специфическими для комплексных соединений являются реакции замещения лигандов (РЗЛ). Сущность их заключается в замене всех или только части имеющихся в комплексе лигандов, на ионы и молекулы, которые становятся на место прежних лигандов. Направление процесса замещения определяется прочностью связей: лиганды с менее прочными связями M – L замещаются на лиганды с более прочными связями.
Если замещение лигандов идет быстро, то соответствующие комплексы называются лабильными. В случае медленного замещения лигандов комплексы называются инертными. Скорость РЗЛ определяется электронной структурой центрального атома. Образование инертных комплексов характерно для кобальта(III), хрома(III), платины(II), платины(IV) и ряда других.
Химические свойства инертных комплексов оказываются очень разнообразными, так как легко могут образовываться смешаннолигандные (смешанные) комплексы и изомеры, характеризующиеся различным размещением лигандов во внутренней сфере. Рассмотрим образование смешанных комплексов на примере получения изомеров дихлородиммминплатины, один из которых применяется как лекарственное средство.
При действии концентрированного раствора аммиака на красный раствор тетрахлороплатината(II) калия в течение нескольких часов происходит осаждение желтого осадка цис-дихлородиамминплатины:
C
 l–
NH3
l–
NH3
K 2[PtCl4]
+ 2NH3
= Pt2+
+ 2KCl
2[PtCl4]
+ 2NH3
= Pt2+
+ 2KCl
Cl– NH3
Осадок отфильтровывают и очищают перекристаллизацией. Комплекс может реагировать с избытком аммиака, образуя тетрамминплатина(II)-ион:
цис-[Pt(NH3)2Cl2] + 2NH3 = [Pt(NH3)4]2+ + 2Cl–
цис-Дихлородиамминплатина известна с 1851 г. Она была получена итальянским химиком Пейроне, и упоминалась в статьях по химии под его именем. Она применялась как исходное вещество для синтеза многих других комплексных соединений платины. В 1969 г. Б. Розенбергом с сотрудниками (США) была открыта цитостатическая активность цис-[Pt(NH3)2Cl2]. В присутствии этого вещества резко замедлялось деление бактериальных клеток. Возникло предположение, что вещество может обладать противоопухолевым действием. Вскоре развернулись исследования биологической активности соли Пейроне и других комплексных соединений платины. Под кратким обозначением ДДП и фирменным названием «платин» цис-дихлородиаммин-платина заняла ведущее положение среди противоопухолевых лекарственных средств. Исследованию этого комплекса посвящены тысячи научных статей.
Изомер соли Пейроне, то есть транс-дихлородиамминплатина (соль Рейзе), получается длительным нагреванием хлорида тетрамминплатины(II) с концентрированной соляной кислотой:
H3N Cl–
Cl–
[Pt(NH3)4]Cl2 + 2HCl = Pt2+ + 2NH4Cl
Cl– NH3
транс-Дихлородиамминплатина цитостатической активности не проявляет.
В образовании двух разных изомеров [Pt(NH3)2Cl2] проявляется важная закономерность в химии комплексных соединений, открытая в 1926 г. И.И. Черняевым, и названная им закономерностью трансвлияния. Некоторый лиганд в комплексах с квадратной конфигурацией сильно влияет на скорость замещения другого лиганда, находящегося к нему в транс-положении, и очень слабо влияет на лиганды в цис-положении. Любой из лигандов Cl– в [PtCl4]2– влияет на лиганд в транс-положении, в результате чего в реакции с аммиаком относительно быстро образуется [PtNH3Cl3]–. Молекула аммиака проявляет слабый трансэффект, и по этой причине второй лиганд Cl– замещается в оставшемся фрагменте Cl–Pt–Cl. Получается цис-изомер:
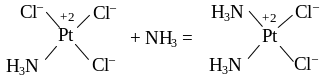
Два оставшихся лиганда Cl– замещаются при слабом трансвлиянии аммиака медленнее, что способствует накоплению в качестве продукта реакции цис-дихлородиамминплатины. При замещении NH3 на Cl– в [Pt(NH3)4]2+ реакция идет очень медленно. После замещения первой молекулы NH3, вторая молекула замещается под трансэффектом Cl–, и образуется транс-изомер:
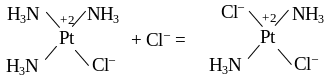
Таким образом, взаимное влияние лигандов приводит к образованию различных пространственных изомеров комплексных соединений. Это явление широко используется в синтезе комплексов заданного строения.
