
- •Лекция 6 Химическая кинетика в биологии и медицине
- •1. Механизмы сложных реакций
- •Типичный пример параллельных реакций – образование изомеров. В) Последовательно-параллельные реакции. Один и тот же продукт может получаться по разным цепочкам промежуточных реакций, например
- •2. Зависимость скорости реакции от температуры
Лекция 6 Химическая кинетика в биологии и медицине
1. Механизмы сложных реакций
а) Последовательные реакции. Идут через ряд стадий с образованием промежуточных веществ – интермедиатов.Простейший случай две стадии
k1
k2
А В Р
В некоторых стадиях может устанавливается равновесие.
В последовательных реакциях скорость исчезновения реагента
![]()
не равна скорости образования конечного продукта
![]() ,
,
так как образуется одно или последовательно несколько промежуточных веществ.
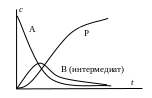
В последовательных реакциях может наступать стационарное состояние для промежуточного вещества.
При наличии резко замедленной стадии скорость образования конечного продукта определяется этой стадией. В других случаях могут получаться очень сложные зависимости.
б) Параллельные реакции. Исходные вещества образуют две или несколько конечных продуктов
k1
 Р1
Р1
А
k2
Р2
Константа скорости исчезновения реагента является суммой констант скорости параллельных реакций, а количества образующихся продуктов пропорциональны соответствующим константам скорости:
![]() ;
;
![]()
Типичный пример параллельных реакций – образование изомеров. В) Последовательно-параллельные реакции. Один и тот же продукт может получаться по разным цепочкам промежуточных реакций, например
В
k1
k2


А
k
Это механизм, лежащий в основе явления катализа. Промежуточное вещество В может быть соединением реагента А с некоторым веществом, при участии которого реакция значительно ускоряется. Тогда это вещество называется катализатором.
k1
k2

 АК
АК
А
k
Каталитическая реакция идет по двум путям, но большая доля продукта образуется при участии катализатора. Однако катализатор не препятствует параллельному протеканию реакции без его участия.
г) Фотохимические реакции. Фотохимические реакции идут при поглощении квантов света определенной энергии (частоты). Необычайно важен фотосинтез, снабжающий калорийной пищей все живое. Без фотосинтеза жизнь в высших формахсуществовать не могла бы.
Основной кинетической характеристикой фотохимических реакций является квантовый выход Ф – отношение числа превращенных частиц к числу поглощенных квантов. Квантовый выход может быть значительно меньше единицы. Это значит, что возбужденная молекула переходит в исходное состояние без химического превращения. Квантовый выход может во много раз превышать единицу, если возникает цепная реакция. Такие реакции, как например взаимодействие водорода с хлором, называются фотокаталитическими, так как квант света лишь инициирует реакцию, не давая дополнительной энергии образующемуся продукту.
В фотохимической реакции
СО2 + h = CO + O
квантовый выход Ф = 1. Длина волны поглощаемого излучения от 160 до 120 нм.
Скорость фотохимических реакций зависит также от мощности поглощаемого излучения.
