
- •Предмет химии. Значение химии в изучении природы и развитии техники. Роль химии для металлургии.
- •Важнейшие классы неорганических соединений: оксиды, кислоты, основания, соли. Классификация, номенклатура, получение, свойства.
- •Квантово-механические представления об электронной структуре атомов.
- •Периодический закон и периодическая система д.И. Менделеева в свете учения о строении атома.
- •Зависимость свойств элементов и их соединений от строения атома.
- •Виды и характеристики химической связи.
- •Ковалентная связь, способы образования ковалентной связи. Метод валентных связей.
- •Пространственная структура молекулярного явления гибридизации.
- •Аморфное и кристаллическое состояние твердых тел. Строение твердого тела. Классификация кристаллов по характеру химической связи.
- •Энергетика химических процессов. Внутренняя энергия и энтальпия.
- •Энтропия, ее изменение при химических реакциях.
- •Энергия Гиббса и направленность химических процессов.
- •Скорость гомогенных, гетерогенных химических реакций. Закон действия масс.
- •Факторы, влияющие на скорость химической реакции.
- •Каталитические системы и катализаторы. Механизмы гомогенного и гетерогенного катализа.
- •Химическое равновесие. Константа химического равновесия и ее связь с термодинамическими функциями. Смещение равновесия.
- •Растворы. Классификация растворов. Способы выражения концентрации растворов.
- •Теория электролитической диссоциации. Диссоциация сильных и слабых электролитов. Закон разбавления Оствальда. Ионные уравнения реакций. Водородные показатели среды.
- •Окислительно-восстановительные процессы. Степень окисления. Составление уравнений овр методом электронного баланса с учетом рН среды.
- •Электрохимические процессы. Уравнение Нернста. Электродные потенциалы металлических, газовых и окислительно-восстановительных электродов.
- •Гальванический элемент. Анодные и катодные процессы. Условная схема гальванического элемента, эдс и ее измерение.
- •Электролиз растворов и расплавов электролитов. Применение электролиза.
- •Основные виды коррозии металлов. Методы защиты от коррозии: легирование, электрохимическая защита, защитные покрытия.
- •Окислительно-восстановительные реакции с участием металлов. Взаимодействие металлов с кислотами.
- •Дисперсные системы и их классификации. Коллоидные растворы.
- •Химические свойства материалов, применяемых в металлургии.
- •Качественный и количественный анализ веществ.
- •Органические полимерные материалы. Применение полимеров. Получение полимеров.
- •Кислотно-основные и окислительно-восстановительные свойства р-, d- элементов и их соединений.
- •Способы получения металлов.
- •Сплавы металлов.
- •Комплексные соединения d- элементов.
Виды и характеристики химической связи.
Химическая связь - это совокупность сил электростатического притяжения и отталкивания, создающее динамически устойчивую систему из двух и более атомов. Основной принцип образования молекул из атомов – это стремление к минимальной энергии и к максимальной устойчивости (пример: H(г)+H(г)=H2(г) + 435 кДж/моль энергии).
Виды химической связи:
Ковалентная связь – связь атомов за счет обществления электронной пары с антипараллельными спинами. Ковалентная неполярная связь возникает между неметаллами, разность электроотрицательности между которыми невелика: 0<D Э.О.<0,4 (пример: PH3; Э.О.(P)=2,1; Э.О.(H)=2,2; D Э.О.=0,1). Соответственно ковалентная полярная связь возникает между элементами с большой электроотрицательностью: 0,4<D Э.О.<2 (пример: HCl Э.О.(H)=2,2; Э.О.(Cl)=3,1; D Э.О.=0,9).
Ионная связь – это связь между ионами, т.е связь между атомами. Обусловлена электростатическим взаимодействием противоположно заряженных ионов. Рассматривается как отдельный случай ковалентной полярной связи. Для ионной связи D Э.О.>2 (пример: NaCl Э.О.(Na)=0,9; Э.О.(Cl)=3,1; D Э.О.=2,2).
Водородная связь – связь, обусловленная положительно поляризованным водородом в молекуле и электроотрицательным атомом другой или той же молекулы.
Металлическая связь – связь, обусловленная электростатическим взаимодействием между обобществленными делокализованными валентными электронами и положительно заряженными катионами в узлах кристаллической решетки.
Основные характеристики ковалентной связи:
Энергия химической связи (Exc) – определяет прочность связи. Данная энергия необходима для превращения одного моля газообразного (молекулярного) вещества в отдельные газообразные атомы. Энергия ковалентной связи имеет порядок 10-1000 кДж/моль.
Длина химической связи (Lxc) – расстояние между ядрами химически связанных атомов. Чем короче длина химической связи, тем связь прочнее. Длина химической связи имеет порядок 0,1-0,3 нм.
Полярность химической связи – неравномерное распределение электронной плотности между атомами в молекуле из-за разной электроотрицательности. В неполярных молекулах центры тяжести положительных и отрицательных зарядов совпадают. Полярные молекулы являются диполями.
Поляризуемость – способность электронной плотности становится полярной в результате действия на молекулу внешнего электрического поля – в частности поля других молекул, вступающих в реакцию.
Направленность – определенное направление химической связи, которое возникает в результате перекрывания электронных облаков. Направленность определяется строением молекулы.
Ковалентная связь, способы образования ковалентной связи. Метод валентных связей.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Простая ковалентная связь образуется из двух неспаренных валентных электронов, по одному от каждого атома:
A· + ·В → А : В
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет не чем иным, как энергией связи).
Заполнение электронами атомных (по краям) и молекулярных (в центре) орбиталей в молекуле H2. Вертикальная ось соответствует энергетическому уровню, электроны обозначены стрелками, отражающими их спины.
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществленные электроны располагаются на более низкой по энергии связывающей МО.
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:
1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Комбинации двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем. Примеры построения валентных схем:
![]()
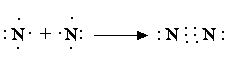
В валентных схемах наиболее наглядно воплощены представления Льюиса об образовании химической связи путем обобществления электронов с формированием электронной оболочки благородного газа: для водорода – из двух электронов (оболочка He), для азота – из восьми электронов (оболочка Ne).
