
- •Предмет химии. Значение химии в изучении природы и развитии техники. Роль химии для металлургии.
- •Важнейшие классы неорганических соединений: оксиды, кислоты, основания, соли. Классификация, номенклатура, получение, свойства.
- •Квантово-механические представления об электронной структуре атомов.
- •Периодический закон и периодическая система д.И. Менделеева в свете учения о строении атома.
- •Зависимость свойств элементов и их соединений от строения атома.
- •Виды и характеристики химической связи.
- •Ковалентная связь, способы образования ковалентной связи. Метод валентных связей.
- •Пространственная структура молекулярного явления гибридизации.
- •Аморфное и кристаллическое состояние твердых тел. Строение твердого тела. Классификация кристаллов по характеру химической связи.
- •Энергетика химических процессов. Внутренняя энергия и энтальпия.
- •Энтропия, ее изменение при химических реакциях.
- •Энергия Гиббса и направленность химических процессов.
- •Скорость гомогенных, гетерогенных химических реакций. Закон действия масс.
- •Факторы, влияющие на скорость химической реакции.
- •Каталитические системы и катализаторы. Механизмы гомогенного и гетерогенного катализа.
- •Химическое равновесие. Константа химического равновесия и ее связь с термодинамическими функциями. Смещение равновесия.
- •Растворы. Классификация растворов. Способы выражения концентрации растворов.
- •Теория электролитической диссоциации. Диссоциация сильных и слабых электролитов. Закон разбавления Оствальда. Ионные уравнения реакций. Водородные показатели среды.
- •Окислительно-восстановительные процессы. Степень окисления. Составление уравнений овр методом электронного баланса с учетом рН среды.
- •Электрохимические процессы. Уравнение Нернста. Электродные потенциалы металлических, газовых и окислительно-восстановительных электродов.
- •Гальванический элемент. Анодные и катодные процессы. Условная схема гальванического элемента, эдс и ее измерение.
- •Электролиз растворов и расплавов электролитов. Применение электролиза.
- •Основные виды коррозии металлов. Методы защиты от коррозии: легирование, электрохимическая защита, защитные покрытия.
- •Окислительно-восстановительные реакции с участием металлов. Взаимодействие металлов с кислотами.
- •Дисперсные системы и их классификации. Коллоидные растворы.
- •Химические свойства материалов, применяемых в металлургии.
- •Качественный и количественный анализ веществ.
- •Органические полимерные материалы. Применение полимеров. Получение полимеров.
- •Кислотно-основные и окислительно-восстановительные свойства р-, d- элементов и их соединений.
- •Способы получения металлов.
- •Сплавы металлов.
- •Комплексные соединения d- элементов.
Растворы. Классификация растворов. Способы выражения концентрации растворов.
Растворы – это однородные (гомогенные) дисперсные системы, состоящие из двух или большего числа компонентов (относительные количества которых могут меняться в широких пределах) и продуктов их взаимодействия.Растворы занимают промежуточное положение между механическими смесями (растворы характеризуются непостоянством своего состава и могут быть разделены на составные части) и химическими соединениями (растворы однородны, устойчивы, образование растворов сопровождается энергетическим эффектом).
В настоящее время установлено, что при растворении молекулы растворяемого вещества связываются с молекулами растворителя, при этом образуются сольваты (если растворитель вода, то образуются гидраты). На разрушение связей между молекулами энергия затрачивается, а при образовании гидрата (сольвата) энергия выделяется; разница между этими энергиями будет наблюдаться в виде теплового эффекта растворения, которая может быть как положительной, так и отрицательной.
Способы выражения концентрации растворов.
1) Массовая доля раствора ω (х). Выражается
отношением массы растворенного вещества
m(х) к массе раствора.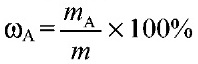
Является величиной безразмерной или
выражается в процентах:
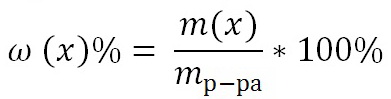
Например, 15%-ный раствор: массовая доля ω (х) = 0,15
2) Молярная концентрация раствора С(х). Выражается отношением количества растворенного вещества n(x) к объему раствора, выраженному в литрах.
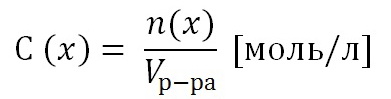
Т.к. количество вещества n(x) выражается отношением массы вещества m(x) к его молярной массе M(x), то молярную концентрацию раствора удобно выразить как
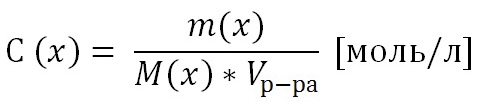
Теория электролитической диссоциации. Диссоциация сильных и слабых электролитов. Закон разбавления Оствальда. Ионные уравнения реакций. Водородные показатели среды.
Теория электролитической диссоциации
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).
a = n / N 0<a<1
Сильные электролиты Это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH)2).
В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Слабые электролиты Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе.
К слабым электролитам относятся:
1) почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2) некоторые неорганические кислоты (H2CO3, H2S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
4) вода.
Они плохо (или почти не проводят) электрический ток.
СH3COOH « CH3COO- + H+
Cu(OH)2 « [CuOH]+ + OH- (первая ступень)
[CuOH]+ « Cu2+ + OH- (вторая ступень)
H2CO3 « H+ + HCO- (первая ступень)
HCO3- « H+ + CO32- (вторая ступень)
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
![]()
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
![]()
где α — степень диссоциации.
Водоро́дный показа́тель, pH
(произносится «пэ аш», английское
произношение англ. pH — piː'eɪtʃ
«Пи эйч») — мера активности (в очень
разбавленных растворах она эквивалентна
концентрации) ионов водорода в растворе,
и количественно выражающая его
кислотность, вычисляется как отрицательный
(взятый с обратным знаком) десятичный
логарифм активности водородных ионов,
выраженной в молях на литр:![]()
Ионные уравнения реакций
Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов. Конечный раствор может остаться прозрачным (продукты хорошо растворимы в воде), но один из продуктом окажется слабым электролитом; в других случаях будет наблюдаться выпадение осадка или выделение газа.
Для реакций в растворах при участии ионов составляют не только молекулярное уравнение, но также полное ионное и краткое ионное.
В ионных уравнениях по предложению французского химика К.-Л. Бертолле (1801 г.) все сильные хорошо растворимые электролиты записывают в виде формул ионов, а осадки, газы и слабые электролиты - в виде молекулярных формул. Образование осадков отмечают знаком "стрелка вниз" ( ↓ ), образование газов - знаком "стрелка вверх" ( ↑ ). Пример записи уравнения реакции по правилу Бертолле:
а) молекулярное уравнение
Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
б) полное ионное уравнение
2Na+ + CO32− + 2H+ + SO42− = 2Na+ + SO42− + CO2↑ + H2O
(CO2 - газ, H2O - слабый электролит)
в) краткое ионное уравнение
CO32− + 2H+ = CO2↑ + H2O
Обычно при записи ограничиваются кратким ионным уравнением, причем твердые вещества-реагенты обозначают индексом (т), газобразные реагенты - индексом (г). Примеры:
1) Cu(OH)2(т) + 2HNO3 = Cu(NO3)2 + 2H2O
Cu(OH)2(т) + 2H+ = Cu2+ + 2H2O
Cu(OH)2 практически нерастворим в воде
2) BaS + H2SO4 = BaSO4↓ + H2S↑
Ba2+ + S2− + 2H+ + SO42− = BaSO4↓ + H2S↑
(полное и краткое ионное уравнения совпадают)
3) CaCO3(т) + CO2(г) + H2O = Ca(HCO3)2
CaCO3(т) + CO2(г) + H2O = Ca2+ + 2HCO3−
(большинство кислых солей хорошо растворимы в воде).
Если в реакции не участвуют сильные электролиты, ионный вид уравнения отсутствует:
Mg(OH)2(т) + 2HF(р) = MgF2↓ + 2H2O
