
- •1.1.Основы калориметрических измерений
- •1.2. Определение теплового значения калориметра
- •1.3. Описание оборудования
- •1.4. Порядок проведения эксперимента
- •2. Обработка результатов эксперимента
- •1.3. Описание оборудования 6
- •1.4. Порядок проведения эксперимента 6
- •1.2. Некоторые свойства йода 13
- •1.2. Некоторые свойства йода
1.2. Некоторые свойства йода
Для йода характерен переход при нагревании из твердого состояния в газообразное, минуя жидкое, т. е. возгонка. Это свойство используют для его очистки от хлора и брома.
Иод плохо растворим в воде, гораздо лучше - в органических растворителях: бензоле, эфире, спирте; 10%-ный раствор последнего используют в медицине и ветеринарии. Однако йод хорошо растворяется в водных растворах йодида калия в результате образования комплексного соединения.
Ю + 12 = К[Л2]. (10.8)
Для простоты это соединение часто изображают формулой К13 и называют трийодидом калия.
Растворы йода широко используют в аналитической химии. Для его обнаружения применяют крахмал, который в присутствии йода окрашивает раствор в синий цвет.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 10.1. Каталитическое разложение хлорноватистой кислоты
В пробирку налить около 1 мл свежеприготовленной хлорной воды. Нагреть на газовой горелке до 70 °С. Прибавить несколько капель раствора нитрата кобальта. Наблюдать. Поднести к пробирке тлеющую лучинку. Наблюдать. Написать уравнение реакции.
Опыт 10.2. Взаимодействие гипохлорита с соляной кислотой (под тягой)
В пробирку всыпать на кончике шпателя немного хлорной извести. Из капельницы пипеткой добавить 1-2 капли концентрированной соляной кислоты. Наблюдать. Поднести к пробирке бумажку, пропитанную КХ Наблюдать. Написать уравнения реакций.
Опыт 10.3. Окисление сероводорода (под тягой)
В пробирку налить 4-5 мл сероводородной воды. Затем добавить 2- 3 мл хлорной воды, Наблюдать. Написать уравнение реакции.
Опыт 10.4. Взаимное вытеснение галоидов
В одну пробирку налить 1-2 мл раствора бромида калия, в другую - 1-2 мл йодида калия. Затем в каждую пробирку добавить несколько капель хлорной воды. Наблюдать. В пробирку с йодидом калия добавить еще немного капель хлорной воды. Наблюдать. Написать уравнение реакций.
Опыт 10.5. Очистка йода возгонкой
В сухой стаканчик на 100 мл внести на кончике шпателя несколько кристаллов йода. Стаканчик накрыть круглодонной колбочкой с холодной водой, осторожно нагревать. Наблюдать. Кристаллы собрать и использовать в следующем опьгге.
Опыт 10.6. Растворимость йода
В три пробирки влить по 1-2 мл воды, раствора йодида калия и спирта. Внести в каждую пробирку 1-2 кристаллика йода. Наблюдать.
Опыт 10.7. Действие йода на крахмап
В две пробирки влить 1-2 мл воды и раствора йодида калия. Затем добавить несколько капель крахмала. Внести в пробирку кристаллик йода. Наблюдать.
Работа 11 СВОЙСТВА (/-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
Цель работы:
Закрепить знания свойств (/-элементов и некоторых их соединений.
1. ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
К ^/-элементам (с!- и /-элементы называются переходными) относятся такие, в атомах которых идет заполнение электронами (/-подуровня предвнешнего уровня. Они составляют побочные подгруппы периодической системы.
Большинство атомов (/-элементов имеют на внешнем уровне по два электрона (.у2), реже по одному (.V1), поэтому они являются метал- лами-восстановителями. Их валентность в соединениях определяется ^-электронами внешнего и частично (/-электронами предвнешнего уровней. Оксиды и гидроксиды этих соединений в низшей степени окисления имеют основной характер (как правило, восстановители), в высшей степени окисления - кислотный (как правило, окислители). В промежуточных степенях окисления (/-элементы могут образовать амфотерные оксиды и гидроксиды и проявлять как окислительные, так и восстановительные свойства. Для (/-элементов характерно образование комплексных соединений путем заполнения электронными парами лигандов вакантных орбиталей (/-подуровня центрального иона (/-элемента - комплексообразователя с формированием донорно-акцеп- торных связей.
Хром. Наиболее устойчивыми являются соединения хрома, в которых он имеет валентности 3 и 6.
Оксид хрома (III) Сг203 - твердое тугоплавкое вещество, нерастворимое в воде и кислотах. Ему соответствует гидроксид Сг(ОН)3, обладающий амфотерными свойствами. Он реагирует с кислотами с образованием солей хрома (Ш):
Сг(ОН)3 + ЗНС1 = СгС13 + ЗН20,
со щелочами образуются соли хромистой кислоты (хромиты) или комплексные соединения хрома (III):
Сг(ОН)3 + N3011 = МаСг02 + 2Н20 (сплавление);
Сг(0Н)3 + 3№0Н = Ыа:,[Сг(0Н)6] (в растворе).
Все соли трехвалентного хрома в твердом состоянии и в растворе имеют окраску.
Хромокалиевые квасцы КСг(802) ■ 12Н20 применяют для дубления кож и в качестве протравы в текстильной промышленности.
Оксид хрома (VI) Сг03 - хромовый ангидрид - сильный окислитель, хорошо растворимый в воде с образованием хромовой Н2Сг04 и дихро- мовой Н2Сг207 кислот. Они существуют только в растворе. Их соли - хроматы и дихроматы - находятся в растворе в равновесии, которое может быть сдвинуто в ту или иную сторону путем добавления кислоты или основания:
2СгО 24 +2Н+ Сг207~ + Н20, Сг207_ +20Н 2Сг04~ + Н20
Соединения хрома (VI) в кислой среде обладают высокой окислительной способностью. Восстанавливаясь, они переходят в соединения хрома (III), и оранжевая окраска раствора меняется на зеленую.
6Ре804 + К2Сг207 + 7Н2804 = ЗРе2(804>, + Сг2(804)3 + К2804 + 7Н20.
Раствор дихромата калия 3%-ный в концентрированной серной кислоте называется хромовой смесью. Ее применяют для мытья стеклянной химической посуды.
Марганец. Марганец проявляет все степени окисления, от +2 до +7, например, в своих оксидах МпО, Мп203, Мп02, Мп205, Мп207. Оксиды марганца с низкими степенями окисления (МпО, Мп203) имеют основной характер (восстановители), Мп02 амфотерен, а Мп03 и Мп207 кислотные оксиды (окислители). Оксиды марганца (1П) и (V) в свободном состоянии не выделены. Наиболее устойчивым является Мп02. Он проявляет как окислительные, так и восстановительные свойства. В присутствии кислорода при сплавлении со щелочами он образует соли неустойчивой марганцовистой кислоты (Н2Мп04) - манганаты.
Окислитель: Мп02 + 4НС1 = С12 + МпС12 + 2Н20;
Восстановитель: 2Мп02 + 4К0Н + 02 = 2К2Мп04 + 2Н20 (сплавление).
Манганаты в растворе также неустойчивы и диспропорционируют по уравнению:
ЗК2Мп04 + 2Н20 = 2КМп04 + Мп02 + 4К0Н.Образующийся перманганат калия является солью неустойчивой марганцовой кислоты (НМп04), существующей только в водном растворе. Эта кислота и ее соли являются сильнейшими окислителями, которые в кислой среде восстанавливаются до солей Мп2+, в нейтральной - до Мп02, в щелочной - до манганатов:
2КМп04 + 5К2803 + ЗН2804 = 2Мп804 + 6К2804 + ЗН20;
2КМп04 +2К2803 + Н20 = 2Мп021 + 2К2804 + 2КОН;
2КМп04 + К2803 + 2КОН = 2К2Мп04 + К2804 + Н20.
Перманганаты разлагаются при нагревании с выделением кислорода (лабораторный способ получения 02):
2КМп04 = К2Мп04 + Мп02 + 02Т.
Железо. Железо, как другие металлы, проявляет восстановительные свойства. Оно образует устойчивые соединения со степенями окисления +2 и +3. Известны также соединения Ре(У1) - железная кислота (Н2Ре04) и ее соли - ферраты.
Оксид железа (II) - РеО - проявляет основные свойства. Он не растворяется в воде и растворах щелочей, но растворим в кислотах с образованием соответствующих солей:
РеО + 2НС1 - РеС12 + Н20.
Такие соли являются восстановителями. В присутствии окислителей, в том числе кислорода воздуха, они окисляются до солей железа (III):
2РеС12 + С12= 2РеС13. Гидроксид железа (II) образуется в результате реакции: РеС12 + 2ШОН = Ре(ОН)24- + 2ЫаС1. Он неустойчив, на воздухе окисляется до гидроксида железа (III): 4Ре(ОН)2 + 02 + 2Н20 = 4Ре(ОН)31.
Оксид железа (III) Ре203 обладает слабо выраженными амфотерны- ми свойствами. Он растворяется в кислотах с образованием солей железа (Ш):
Ре2Оэ + 6НС1 + 2РеС13 + ЗН20.
При его сплавлении с основаниями (или карбонатами) щелочных металлов образуются соли железистой кислоты - ферриты:
Ре203 + 2Ыа2С03 = 2ЫаРе02 + С02. 62
Гидроксид железа (III) также амфотерен. Со щелочами в растворе он образует комплексные соли:
Ре(ОН)3 + ЗМаОН = Ыа,[Ре(ОН)6|.
Соли трехвалентного железа являются окислителями:
2РеС13 + ЗКаЛ = 2РеС12 + ЫаС1 + ]2.
Реагентами на ион Ре3, являются роданиды щелочных металлов:
РеС13 + ЗК8СЫ = РеС5С1Ч)3 + ЗКС1.
красный
Из устойчивых комплексов железа заслуживают внимание гекса- цианоферрат (II) калия К4[Ре(СМ)Л] (желтая кровяная соль) и гексациа- ноферраг (III) калия Кз[Ре(С1Ч)6] (красная кровяная соль). Первая образуется при действии на раствор соли двухвалентного железа избытка цианида калия:
2РеС!2 + 2КСК = 2КС1 + Ре(СМ)2;
Ре(С1ч[)2 + 4КСИ = К4[Ре(СМ)й]. Эта соль является реагентом на ион Ре1 :
4РеС13 + ЗК4[Ре(СМ)6] = Ре4[Ре(СЫ)б]з + 12КС1.
синий
Красная кровяная соль образуется при окислении желтой ковяной
соли:
2К4[Ре(СЫ)6] + С12 = 2К3[Ре(СЫ)6] + 2КС1. Красная кровяная соль - реагент на ион Ре^":
ЗРеС12 + 2К3[Ре(С]Ч)6] =Ре3[Ре(СМ)6]2 + 16К.С1.
синий
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Соединения хрома
Опыт 11.1. Получение и свойства гидроксида хрома (III)
В две пробирки внести по 3-4 капли раствора сульфата хрома (или хлорида) и добавить 1-2 капли 2 н раствора гидроксида натрия. Наблюдать В первую пробирку добавить по каплям 2 н. раствора соляной (или серной) кислоты, а в другую - гидроксида натрия. Наблюдать. Написать уравнения реакций в молекулярной и ионной формах. Полученное соединение сохранить для последующих опытов.
63
Опыт 11.2. Гидролиз солей хрома (III)
а) Гидролиз сульфата хрома
В пробирку поместить 3-5 капель раствора сульфата хрома (Ш) и добавить 1-2 капли раствора лакмуса. Наблюдать. Написать уравнения гидролиза сульфата хрома по первой ступени.
б) Гидролиз солей хрома в щшсутствии соды и сульфида аммония
В две пробирки поместить по 2-3 капли раствора сульфата (или хлорида) хрома (III). По каплям прибавить в одну - раствор карбоната натрия, в другую - сульфида аммония. Наблюдать. Написать уравнения реакций.
Опыт 11.3. Окисление солей хрома (III)
К раствору гексагидроксохромата (III) натрия из опыта 11.1 добавить 1-2 капли щелочи и 3-4 капли бромной воды. Смесь нагреть на водяной бане до изменения окраски. Написать уравнения реакций.
Опыт 11.4. Хроматы и дихроматы
а) Переход хромата в дихромат
К раствору хромата калия (3—4 капли) добавить по каплям раствор 2 н. серной кислоты. Наблюдать. Написать уравнения реакции в молекулярной и ионной формах.
б) Переход дихромата в хромат
К раствору дихромата калия (3-4 капли) добавить по каплям 2 н. раствор гидроксида натрия. Наблюдать. Написать уравнение реакции в молекулярной и ионной формах.
Опыт 11.5. Окислительные свойства дихроматов
В три пробирки налить по 4-5 капель раствора дихромата калия и добавить в каждую по 2-3 капли раствора серной кислоты. В первую пробирку прилить 2-3 капли раствора йодида калия, во вторую и третью - столько же, соответственно, нитрита натрия и сульфита натрия. Нагреть пробирки на водяной бане. Наблюдать. Написать уравнения реакций (уравнять методом полуреакций).
Соединения марганца
Опыт 11.6. Получение гидроксида марганца (II)
Внести в две пробирки по 3-4 капли раствора соли марганца (И) и 2-3 капли 2 н. раствора щелочи. Наблюдать. В первой размешать осадок
64
стеклянной палочкой. Наблюдать. Во вторую добавить 5-6 капель бромной воды. Наблюдать. Написать уравнения реакций.
Опыт 11.7. Разложение перманганата катя
Поместить 3-4 капли кристаллика перманганата калия в пробирку и укрепить ее горизонтально в штативе. Нагреть кристаллики на слабом пламени и внести в пробирку тлеющую лучинку. Наблюдать. Пробирку охладить и добавить 5-6 капель воды. Обратить внимание на цвет. Написать уравнения реакций, указав окислители и восстановители.
Опыт 11.8. Окислительные свойства перманганата калия
В пять пробирок внести по 3 -4 капли раствора перманганата калия. В первые три добавить 2 капли 2 н. раствора серной кислоты, в четвертую - столько же воды, в пятую - 2 н. раствор щелочи. В первую пробирку прибавить несколько кристалликов сульфата железа (П), во вторую - 3-4 капли 10%-ного раствора пероксида водорода, во все остальные - несколько кристалликов сульфита натрия (или 3-4 капли 0,1 н. раствора йодида калия). Четвертую пробирку слегка подогреть. Наблюдать. Написать уравнения реакций в молекулярной и ионной формах.
Железо и его свойства
Опыт 11.9. Восстановительные свойства железа
В две пробирки поместить по 8 -10 капель соответственно растворов хлорида олова и сульфата меди. В каждую поместить железную проволоку, очищенную наждачной бумагой. Наблюдать. Написать уравнения реакций в молекулярной и ионной формах.
Опыт 11.10. Получение и окисление гидроксида железа (II)
В пробирку поместить 3-4 капли раствора соли железа (П) и прилить раствор гидроксида натрия. Наблюдать. Осадок перемешать стеклянной палочкой (1-2 мин). Наблюдать. Написать уравнения реакций.
Опыт 11.11. Восстановительные свойства железа (II)
Поместить в две пробирки раствор соли железа (П). В первую добавить 2-3 капли 2 н. раствора серной кислоты и 2-3 капли 3%-ного раствора пероксида водорода. В обе пробирки добавить по капле 0,1 н. раствора роданида калия (аммония). Наблюдать. Написать уравнения реакций. Поместигь в пробирку 5-6 капель раствора ди-
65хромата калия, 2 капли 2 н. раствора серной кислоты и два микрошпателя соли железа (П). Наблюдать. Написать уравнения реакций.
Опыт 11.12. Получение гидроксида железа (III) и его свойства
В две пробирки внести по 5-6 капель раствора хлорида железа (III) и добавить по 3-4 капли 2 н. раствора гидроксида натрия. Наблюдать. В одну пробирку добавить 2 н. раствор серной кислоты, во вторую - щелочи. Наблюдать. Написать уравнения реакций.
Опыт 11.13. Окислительные свойства железа (III)
Поместить в две пробирки по 3-4 капли раствора хлорида железа (III). В первую добавить 1-2 капли раствора йодида калия, во вторую - несколько кристалликов сульфита натрия. Наблюдать. Во вторую после исчезновения окраски добавить 1-2 капли раствора гексацианоферрата (1П) калия. Наблйэдать. Написать уравнения реакций.
Опыт 11.14. Качественные реакции на ионы железа (II) и (III)
Поместить в три пробирки по 5-6 капель растворов солей: в первую - железа (П), во вторую и третью - железа (III). В первую добавить 1-2 капли раствора гексацианоферрата (1П) калия, во вторую - 1 каплю 0,1 н. раствора роданида аммония, в третью - 1-2 капли раствора гексацианоферрата (II) калия. Наблюдать. Написать уравнения реакций в молекулярной и ионной формах. Указать химическое название полученных соединений.
Опыт 11.15. Гидролиз солей железа (II) и (III)
а) В пробирку поместить 5-6 капель раствора лакмуса и добавить два микрошпателя соли железа (II) (хлорида или сульфата). Размешать стеклянной палочкой. Установить по цвету лакмуса реакцию среды. Написать уравнение реакции гидролиза по первой ступени.
б) В две пробирки поместить по 5-6 капель раствора лакмуса и по 2 микрошпателя хлорида железа (Ш). Определить реакцию среды. Одну из пробирок нагреть.
Наблюдать, какая из солей имеет большую степень гидролиза. Сделать выводы. Написать уравнения реакций гидролиза.
в) Поместить в пробирку 3-4 капли раствора хлорида железа (Ш) и прибавить по каплям раствор карбоната натрия. Наблюдать. Написать уравнения реакций.
ПРИЛОЖЕНИЯ
1.
МАНТИССЫ ДЕСЯТИЧНЫХ ЛОГАРИФМОВ |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
0000 |
0043 |
0086 |
0128 |
0170 |
0212 |
0253 |
0294 |
0334 |
0374 |
11 |
0414 |
0453 |
0492 |
0531 |
0569 |
0607 |
0645 |
0682 |
0719 |
0755 |
12 |
0792 |
0828 |
0864 |
0899 |
0934 |
0969 |
1004 |
1038 |
1072 |
1106 |
13 |
1139 |
1173 |
1206 |
1239 |
1271 |
1303 |
1335 |
1367 |
1399 |
1430 |
14 |
1461 |
1492 |
1523 |
1553 |
1584 |
1614 |
1644 |
1673 |
1703 |
1732 |
15 |
1761 |
1790 |
1818 |
1847 |
1875 |
1903 |
1931 |
1959 |
1987 |
2014 |
16 |
2041 |
2068 |
2095 |
2122 |
2148 |
2175 |
2201 |
2227 |
2253 |
2279 |
17 |
2304 |
2330 |
2335 |
2380 |
2405 |
2430 |
2455 |
2480 |
2504 |
2529 |
18 |
2553 |
2577 |
" 2601 |
2625 |
2648 |
2672 |
2695 |
2718 |
2742 |
2765 |
19 |
2788 |
2810 |
2833 |
2856 |
2878 |
2900 |
2923 |
2945 |
2967 |
2989 |
20 |
ЗОЮ |
3032 |
3054 |
3075 |
3096 |
3118 |
3139 |
3160 |
3181 |
3201 |
21 |
3222 |
3243 |
3263 |
3284 |
3304 |
3324 |
3345 |
3365 |
3385 |
3404 |
22 |
3424 |
3444 |
3464 |
3483 |
3502 |
3522 |
3541 |
3560 |
3579 |
3598 |
23 |
3617 |
3636 |
3655 |
3674 |
3692 |
3711 |
3729 |
3747 |
3766 |
3784 |
24 |
3802 |
3820 |
3838 |
3856 |
3874 |
3892 |
3909 |
3927 |
3945 |
3962 |
25 |
3979 |
3997 |
4014 |
4031 |
4048 |
4065 |
4082 |
4099 |
4119 |
4133 |
26 |
4150 |
4166 |
4183 |
4200 |
4216 |
4232 |
4249 |
4265 |
4281 |
4298 |
27 |
4314 |
4330 |
4346 |
4362 |
4378 |
4393 |
4409 |
4425 |
4440 |
4456 |
28 |
4472 |
4487 |
4502 |
4518 |
4533 |
4548 |
4564 |
4579 |
4594 |
4609 |
29 |
4624 |
4639 |
4654 |
4669 |
4683 |
4698 |
4713 |
4728 |
4742 |
4757 |
30 |
477-1 |
4786 |
4800 |
4814 |
4829 |
4843 |
4857 |
4871 |
4886 |
4900 |
31 |
4914 |
4928 |
4942 |
4955 |
4969 |
4983 |
4997 |
5011 |
5024 |
5038 |
32 |
5051 |
5065 |
5079 |
5092 |
5105 |
5119 |
5132 |
5145 |
5159 |
5172 |
33 |
5185 |
5198 |
5211 |
5224 |
5237 |
5250 |
5263 |
5276 |
5289 |
5302 |
34 |
5315 |
5328 |
5340 |
5353 |
5366 |
5378 |
5391 |
5403 |
5416 |
5428 |
35 |
5441 |
5453 |
5465 |
5478 |
5490 |
5502 |
5514 |
5527 |
5539 |
5551 |
36 |
5563 |
5575 |
5587 |
5599 |
5611 |
5623 |
5635 |
5647 |
5658 |
5670 |
37 |
5682 |
5694 |
5705 |
5717 |
5729 |
5740 |
5752 |
5763 |
5775 |
5786 |
38 |
5798 |
5809 |
5821 |
5832 |
5843 |
5855 |
5866 |
5877 |
5888 |
5899 |
39 |
5911 |
5922 |
5933 |
5944 |
5955 |
5966 |
5977 |
5988 |
5999 |
6010 |
40 |
6021 |
6031 |
6042 |
6053 |
6064 |
6075 |
6085 |
6096 |
6107 |
6117 |
41 |
6128 |
6138 |
6149 |
6160 |
6170 |
6180 |
6191 |
6201 |
6212 |
6222 |
42 |
6232 |
6243 |
6253 |
6263 |
6274 |
6284 |
6294 |
6304 |
6314 |
6325 |
43 |
6335 |
6345 |
6355 |
6365 |
6375 |
6385 |
6395 |
6405 |
6415 |
6425 |
44 |
6435 |
6444 |
6454 |
6464 |
6474 |
6484 |
6493 |
6503 |
6513 |
6522 |
45 |
6532 |
6542 |
6551 |
6561 |
6571 |
6580 |
6590 |
6599 |
6609 |
6618 |
46 |
6628 |
6637 |
6646 |
6656 |
6665 |
6675 |
6684 |
6693 |
6702 |
6712 |
47 |
6721 |
6730 |
6739 |
6749 |
6758 |
6767 |
6776 |
6785 |
6784 |
6803 |
48 |
6812 |
6821 |
6830 |
6839 |
6848 |
6857 |
6866 |
6875 |
6884 |
6893 |
49 |
6902 |
6911 |
6920 |
6928 |
6937 |
6946 |
6955 |
6964 |
6972 |
6981 |
50 |
6990 |
6998 |
7007 |
7016 |
7024 |
7033 |
7042 |
7050 |
7059 |
7067 |



1 |
2 |
3 |
4 |
|
|
|
0 |
191,5 |
0 |
|
|
-46,2 |
192,6 |
• -16,7 |
ЫЩМОг (к) |
|
-256 |
- |
- |
№ШОэ(к) |
|
-365,4 |
151 |
-183,8 |
N11)01 (к) |
|
-315,39 |
94,56 |
-343,64 |
N,0 (г) |
|
82,0 |
219,9 |
104,1 |
N0 (г) |
|
90,3 |
210,6 |
86,6 |
ИЛ (г) |
|
83,3 |
307,0 |
140,5 |
(к) |
|
33,5 |
240,2 |
51,5 |
N,04 (г) |
|
9,6 |
303,8 |
98,4 |
И205(г) |
|
-42,7 |
1,8 |
114,1 |
ЫаОН (к) |
|
-426,6 |
64,18 |
-377,0 |
№ЮН (р) |
|
- |
- |
-419,5 |
Ыа28Ю3(к) |
|
- |
- |
-1427,8 |
ЫаС1 (к) |
|
-410,9 |
72,36 |
-384,0 |
№02(к) |
|
-239,7 |
38,2 |
-211,6 |
02(г) |
V |
0 |
205,0 |
0 |
ОР2(г) |
|
25,1 |
247,0 |
32,5 |
Р2Оз (к) |
|
-820 |
173,5 |
- |
Р3О5 (к) |
|
-1492 |
114,5 |
-1348,8 |
РЪО (к) |
|
-219,3 |
66,1 |
-189,1 |
РЮ2 (к) |
|
-276,6 |
74,9 |
-218,3 |
8 (ромб) |
|
0 |
31,88 |
0 |
802 (Г) |
|
-296,9 |
248,1 |
-300,2 |
803(г) |
|
-395,8 |
256,7 |
-371,2 |
81С14(Ж) |
|
-687,8 |
239,7 |
- |
8Ш4(Г) |
|
34,7 |
204,6 |
57,2 |
8Ю2(к) |
|
-859,3 |
42,09 |
-803,75 |
8пО (к) |
|
-286,0 |
56,5 |
-256,9 |
8п02(К) |
|
-580,8 |
52,3 |
-519,3 |
Т] (к) |
|
0 |
30,6 |
0 |
ТЮ14(ж) |
|
-804,2 |
252,4 |
-737,4 |
т;о2(ю |
|
-943,9 |
50,3 |
-888,6 |
|
|
-842,7 |
75,9 |
-763,9 |
7мО (к) |
|
-350,6 |
43,6 |
-320,7 |
Таблица 10
Названия важнейших кислот и их солей. Названия
I кислоты ^ соли
"" Г " -у——— ~ —
НА-Ю^ Метаалшиниваая Метаалюминат
НА^Од Мет&мышьяковая Метаарсенат
НзА404 Ортомшьяковая Ортоарсенат
НА^О^ Метамшьяковистая Метаарсенит
НзАй0э Ортомышьяковистая Ортоарсенит
НВО^ Метаборная Метаборат
Н3ВО3 Ортоборная Ортоборат
Н^В^Оу Чет: эехборная Тетраборат
НВг- Вромо водород Бромид
НОВг Бромноватистая Гипобромит
НВЮд Бромно катая Бромат
НСООН Муравьиная Формиат
СНдСООН Уксусная Ацетат
НС№ Циаиоводород Цианид
НоСОд Угольная Карбонат
Щавелевая Оксалат
НС1 Хлороводород Хлорид
Н0С1 Хлорноватистая Гипохлорит
НСЮ2 Хлористая Хлорит
НСГОд Хлорноватая Хлорат
НСЮ4
Хлорная Перхлорат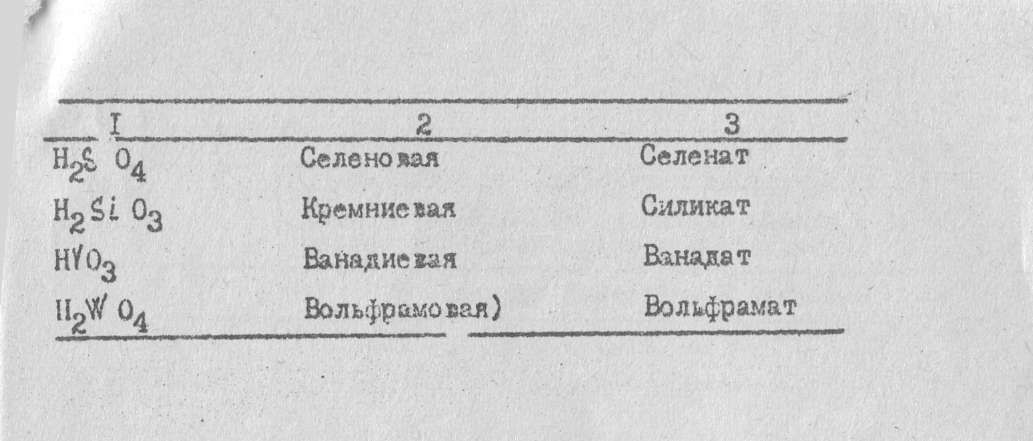
I |
2 |
3 |
НСр02 |
Метахромистая |
Метахромит |
н2оо4 |
Хромош |
Хромат |
|
Д вухромо ВЙ |
Дихромат |
на |
Иодоводород |
Иодид |
ноэ |
Иодноватиетая |
Гипоиодит |
шо3 |
Йодноватая |
Иодат |
Н304 |
• Йодная |
Периодат |
НМп04 |
Марганцовая |
Пермаиганат |
н^п04 |
Марганцовистая |
Манганит |
Н^МоО^ |
.Молибденовая |
Модибдат |
ШРо |
Азвдоводород |
Азцд |
о |
(азо тис то водородная) |
|
ННЮ2 |
Азотистая |
Нитрит |
№Ю3 |
Азотная |
Нитрат |
НР03 |
Метафосфорная |
Метафосфат |
К3Р04 |
Орт^фасфорная |
Ортофосфат |
н4р2о7 |
Двуфасфорная (пиро- фосфорная) |
Дифосфат (пиро- фосфат) |
К3Р03 |
Фосфористая |
Фосфит |
Н3Р02 |
Фосфорноватистая |
Гипофосфит |
Н25 |
Сероводород |
Сульфид |
|
Родановодород |
Роданид |
Н2303 |
Сернистая |
Сульфит |
н^о4 |
Серная |
Сульфат |
Н252°3 |
Ткосерная |
Тиосульфат |
н2$2о7 |
Дяусеряая (пиро- сср.чая) |
Дисульфат (пиро- |
сульфат) |
||
Н2$208 |
Перо кс одяус ер ная (надсерная) |
Пероксодисульфат (персульфат) |
Н2$е |
Селено гюдород |
Селенид |
Н25е03 |
Селенистая 1Р7 |
Селенит |



