
Химия КР вар 30
.pdf
Часть 1
Дано: |
|
Решение: |
|
|
|
№ 111. |
|
|
|||||
|
|
|
|
|
|
|
|
||||||
[N2 ]1 2моль/л |
|
N2 |
3H2 2NH3 |
|
|
|
|
||||||
[H2 ]1 8моль/л |
|
|
k [N |
2 |
] |
[H |
2 |
] 3 |
k 2 83 1024k |
|
|
||
[N2 ]2 0,9[N2 ]1 |
|
1 |
|
|
1 |
|
1 |
|
|
|
|||
|
|
|
|
|
|
|
|
3 |
|
3 |
|
||
|
|
|
2 |
k [N2 ]2 |
[H2]2 |
k (2 2 0,9) (8 3 (2 2 0,9)) |
|
729,4k |
|||||
1 |
? |
|
|
||||||||||
|
Ответ: |
|
|
|
|
|
|
|
|
|
|||
2 |
? |
|
|
|
|
|
|
|
|
|
|
||
|
|
1024k |
|
|
|
|
|
|
|
|
|
||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 729,4k |
|
|
|
|
№ 135. |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
Дано:
КС 1
V 10 л
n(A) 60 моль
n(B) 40 моль
[A]РАВН ?
[B]РАВН ?
[C]РАВН ?
[D]РАВН ?
Решение:
A B C D
[A] |
ИСХ |
|
n(A) |
|
60 |
6 |
моль/ л |
|
|||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
V |
10 |
|
|
|
|
|
|
||||||
[B] |
ИСХ |
|
n(B) |
|
40 |
4 |
моль/л |
|
|||||||||
|
|
|
|||||||||||||||
|
|
|
|
V |
10 |
|
|
|
|
|
|
|
|||||
Пусть х = [C]РАВН = [D]РАВН |
|
||||||||||||||||
Тогда [A]РАВН = 6-x, [B]РАВН = 4-x |
|
||||||||||||||||
K |
С |
|
[C]РАВН [D]РАВН |
|
|
|
x x |
1 |
|||||||||
[A]РАВН [B]РАВН |
|
|
(6 x)(4 x) |
||||||||||||||
|
|
|
|
|
|
||||||||||||
x2 |
24 10x x2 |
|
|
|
|
|
|||||||||||
x 2,4 |
моль/ л |
|
|
|
|
|
|||||||||||
[A]РАВН |
6 2,4 3,6 |
|
моль/ л |
|
|||||||||||||
[B]РАВН |
4 2,4 1,6 |
моль/ л |
|
||||||||||||||
Ответ: |
|
|
|
|
|
|
|
|
|
|
|
||||||
K |
С |
|
[C]РАВН [D]РАВН |
|
|
|
x x |
1 |
|||||||||
[A]РАВН [B]РАВН |
|
|
(6 x)(4 x) |
||||||||||||||
|
|
|
|
|
|
||||||||||||
x2 |
24 10x x2 |
|
|
|
|
|
|||||||||||
[C]РАВН |
[D]РАВН 2,4 |
моль/ л |
|
||||||||||||||
[A]РАВН |
3,6 |
|
моль/ л |
|
|
|
|
|
|||||||||
[B]РАВН |
1,6 |
моль/ л |
|
|
|
|
|
||||||||||
EA 500,8 кДж/ моль
Так как реакция экзотермическая, для смещения равновесия вправо необходимо понизить температуру. Кроме этого, можно увеличить концентрацию исходных веществ. При смещении равновесия вправо константа равновесия увеличится.

Дано: m(NaOH) 0,32 г
V(р ра NaOH) 40 см3
СН (р ра к ты) 0,3 Н
V(р ра к ты) ?
Дано:
СМ (KCl) 0,01 М СН (K2SO4 ) 0,02 Н
I ? aK ?
aCl ?
aSO42 ?
Дано: m(KOH) 0,28 г
V(р ра KOH) 1 л
pH ?
№ 169.
Решение:
|
|
|
V(р ра NaOH) CН (р ра NaOH) |
|
||||||
V(р ра к ты) |
|
|
|
|
|
|
||||
|
CН (р ра к ты) |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
n(NaOH) |
|
|
|
m(NaOH) |
|
0,32 |
|
|
|
|
|
|
|
М(NaOH) CН (р ра к ты) |
40 0,3 |
|||||
|
CН (р ра к ты) |
|
|
|||||||
0,0267 л 26,7 |
мл |
|
|
|
|
|
|
|||
Ответ: V(р ра к ты) 26,7 мл
№ 198.
Решение:
I 0,5 Ci zi2 0,5 [K ] 12 [Cl ] 12 [SO4 ] 22 0,04
|
|
|
|
|
|
|
|
10 0,5z2 |
|
|
|
|
|
|
|
|
|
|
|
|||
f |
|
f |
Cl |
|
|
I 10 0,5 1 0,04 0,79 |
|
|||||||||||||||
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
f |
|
2 10 0,5z2 |
|
10 0,5 4 |
|
|
|
|
|
|
|
|||||||||||
|
I |
0,04 |
0,4 |
|
|
|
||||||||||||||||
SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
a |
|
f |
K |
|
[K ] 0,79 0,02 0,0158 моль/ л |
|
||||||||||||||||
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
a |
|
f |
K |
|
[Cl ] 0,79 0,01 0,0079 моль/ л |
|||||||||||||||||
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
a |
|
2 f |
|
[SO 2 |
] 0,4 0,01 0,004 |
|
||||||||||||||||
SO4 |
|
|
|
K |
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|||||
Ответ: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
I 0,04 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
aK |
0,0158 |
моль/ л |
|
|
|
|
|
|
|
|
||||||||||||
aK |
0,0079 |
моль/ л |
|
|
|
|
|
|
|
|
||||||||||||
aSO |
2 0,004 |
моль/ л |
|
|
|
|
|
|
|
|
||||||||||||
|
|
4 |
|
|
|
|
№ 201. |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Решение: |
|
|
|
|
n(KOH) |
|
|
|
|
|||||||||||||
CН (р ра KOH) |
|
|
|
|||||||||||||||||||
V(р ра KOH) |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
m(KOH) |
|
0,28 |
|
0,005 |
моль/ л [OH ] |
|||||||||
М(KOH) V(р ра KOH) |
|
|
||||||||||||||||||||
|
|
|
56 1 |
|
||||||||||||||||||
pH 14 pOH 14 ( lg[OH ]) 14 2,3 11,7
Ответ: pH 11,7

№ 250.
2LiOH (NH4 )2 SO3 Li2SO3 2NH4OH OH NH4 NH4OH
Li2SO3 H2O LiHSO3 LiOH
SO32 H2O HSO3 OH
LiHSO3 H2O LiOH H2SO3
HSO3 H2O OH H2SO3 |
|
|
|
|
|
|
|||||||||||||||||||
pH 7 |
1 |
pK |
H 2SO3 |
1 |
lg[Li SO ] 7 1 |
2 |
0,9 1 |
lg0,01 8,45 |
|||||||||||||||||
|
|
|
|
2 |
|
2 |
|
2 3 |
|
2 |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ 255. |
|
|
|
|
|
|
PbS 2 2H2S 6O4 |
PbSO4 S 4O2 S0 |
2H2O |
|
|
|
||||||||||||||||||||
S 2 |
6e |
S 4 |
|
6 |
|
|
|
1 |
|
1 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
S 6 |
6e |
S0 |
|
|
6 |
|
|
|
|
1 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
S 2 |
окисляется восстановитель |
|
|
|
|
|
|
||||||||||||||||||
S 6 |
восстанавливается окислитель |
|
|
|
|
|
|
||||||||||||||||||
2KCl 5O |
|
4Cr |
3Cl |
3 |
20KOH 14KCl 4K |
Cr 6O |
10H |
2 |
O |
||||||||||||||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
4 |
|
|
|||
Cr 3 3e |
Cr 6 |
|
3 |
|
6 |
|
2 |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
Cl 5 6e |
Cl |
|
|
|
6 |
|
|
1 |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Cr 3 |
окисляется восстановитель |
|
|
|
|
|
|
||||||||||||||||||
Cl 5 |
восстанавливается окислитель |
|
|
|
|
|
|
||||||||||||||||||

Часть 2
№ 8.
Дано:
Н2980 HBr(Г) 36,38 кДж/ мольН2980 О2(Г) 0 кДж/ моль
Н2980 H2O(Г) 241,81 кДж/ мольН2980 Br2(Г) 0 кДж/ моль
C |
0 |
|
HBr |
Г) |
29,14 |
Дж/ моль K |
||
|
P 298 |
( |
|
|
|
|||
CP0 |
298 |
O2(Г) 29,37 |
Дж/ моль K |
|||||
CP0 |
298 |
H2O(Г) 33,61 |
Дж/ моль K |
|||||
C |
0 |
|
Br |
|
36,07 |
|
Дж/ моль K |
|
|
P 298 |
2(Г) |
|
|
|
|
||
T 600 K
CP T
H6000 реакции ?
Решение:
4HBr(Г) O2(Г) |
2H2O(Г) |
2Br2(Г) |
|
|
|
|
|
|
|
|
|||||||||||||||||||
H2980 |
(đĺŕęöčč ) H2980 (ďđîä. |
|
|
đĺŕęöčč ) |
|
|
|
|
|
|
|||||||||||||||||||
H2980 |
(čńő. âĺůĺńňâ ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
H 0 |
|
(реакции) (2 H 0 |
|
(H |
2 |
O |
(Г) |
) 2 H |
0 |
|
(Br |
|
)) |
|
|||||||||||||||
298 |
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
298 |
2(Г) |
|
|
|||||||
(4 H 0 |
|
(HBr |
) H |
0 |
(O |
2(Г) |
)) |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
298 |
|
|
(Г) |
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
(2 ( 241,81)) 2 0) ( 36,38 0) 447,3 |
|
кДж 447300 Дж |
|||||||||||||||||||||||||||
CP0 |
298 (реакции) CP0 |
298 (прод. |
реакции) |
|
|
|
|
|
|||||||||||||||||||||
CP0 |
298 (исх. веществ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
C0 |
|
|
(реакции) (2 C0 |
|
298 |
|
(H |
2 |
O |
(Г) |
) 2 C |
0 |
(Br |
)) |
|||||||||||||||
P 298 |
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
P 298 |
|
2(Г) |
|
|||||||
(4 C0 |
298 |
(HBr |
|
) C0 |
298 |
(O |
2(Г) |
)) |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
P |
|
(Г) |
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
(2 33,61 2 36,07) (29,14 29,37) 80,85 |
Дж/К |
|
|
||||||||||||||||||||||||||
H6000 |
(реакции) H2980 (реакции) |
|
|
|
|
|
|
|
|||||||||||||||||||||
CP0 |
298 (реакции) (T 298) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
447300 (80,85 (600 298)) 422883 Дж 422,9 |
Дж |
||||||||||||||||||||||||||||
Ответ: H6000 (реакции) 422,9 Дж
№ 23.
Дано:
S2980 |
SO2(Г) |
248,07 |
Дж/ моль K |
||||
S |
0 |
O |
|
|
|
205,04 Дж/ моль K |
|
|
298 |
2(Г) |
|
|
256,69 |
|
|
S |
0 |
SО |
Г) |
|
Дж/ моль K |
||
|
298 |
3( |
|
|
|
||
S2980 |
FeO(КР) 60,75 |
Дж/ моль K |
|||||
S |
0 |
CO |
|
|
197,55 |
Дж/ моль K |
|
|
298 |
(Г) |
|
|
|
||
S2980 |
Fe(КР) 27,15 Дж/ моль K |
||||||
S2980 |
СO2(Г) 213,66 |
Дж/ моль K |
|||||
S2980 (реакции) ?
Решение:
2SО2(Г) О2(Г) 2SО3(Г)
S2980 (đĺŕęöčč ) S2980 (ďđîä. đĺŕęöčč )S2980 (čńő. âĺůĺńňâ )
S0 |
(реакции) 2 S0 |
(SО |
|
Г) |
) |
|
|||||
298 |
|
|
|
298 |
|
3( |
|
|
|||
(2 S0 |
(SО |
) S0 |
|
(О |
|
)) |
|
||||
|
298 |
2(Г) |
298 |
|
2(Г) |
|
|
|
|
||
2 256,69 (2 248,07 205,04) 187,8 |
Дж/К |
||||||||||
FeО(КР) СО2(Г) Fe(КР) |
СО2(Г) |
|
|||||||||
S2980 |
(реакции) S2980 |
(Fe(КР) ) S2980 (СО2(Г) ) |
|
||||||||
(S2980 (FeO(КР) ) S2980 |
(СО(Г) )) |
|
|||||||||
27,15 213,66 (60,75 197,55) 17,49 |
Дж/К |
||||||||||
Ответ: 2SО2(Г) О2(Г) 2SО3(Г) |
|
||||||||||
S2980 |
(реакции) 187,8 |
Дж/К |
|
||||||||
FeО(КР) СО2(Г) Fe(КР) |
СО2(Г) |
|
|||||||||
S2980 |
(реакции) 17,49 |
Дж/К |
|
||||||||

Дано:
S0 |
|
CO |
|
197,55 |
Дж/ моль K |
|
298 |
|
(Г) |
|
|
||
S2980 H2O(Г) 188,72 |
Дж/ моль K |
|||||
S2980 |
СO2(Г) 213,66 |
Дж/ моль K |
||||
S2980 |
H2(Г) 130,52 Дж/ моль K |
|||||
CP0 |
298 |
CO(Г) 29,14 |
Дж/ моль K |
|||
CP0 |
298 |
H2O(Г) 33,61 Дж/ моль K |
||||
CP0 |
298 |
H2(Г) 28,83 |
Дж/ моль K |
|||
CP0 |
298 |
СO2(Г) 37,11 |
Дж/ моль K |
|||
H2980 |
(реакции) 41,2 кДж |
|||||
41200 |
Дж |
|
||||
G2980 реакции ?G3980 реакции ?
№ 57.
Решение:
CO(Г ) Н2O(Г ) CO2(Г) Н2(Г)
S2980 (реакции) S2980 (прод. реакции)S2980 (исх. веществ)
S2980 (реакции) S2980 (H2(Г) ) S2980 (CO2(Г) )
(S2980 (CO(Г) ) S2980 (H2O(Г) )) 130,52 213,66
197,55 188,72 42,09 Дж / К
CP0 298 (реакции) CP0 298 (прод. реакции)CP0 298 (исх. веществ)
CP0 298 (реакции) CP0 298 (H2(Г) ) CP0 298 (CO2(Г) )
(CP0 298 (CO(Г) ) CP0 298 (H2O(Г) )) 28,83 37,11
29,14 33,61 3,19 Дж / К
G2980 (реакции) Н2980 реакции Т S2980 (реакции)
41200 (298 ( 42,09)) 28657 Дж 28,7 кДж
H3980 (реакции) H2980 (реакции) CP0 298 (реакции)
(398 298) 41200 3,19 100 40881 Дж
S3980 (реакции) S2980 (реакции) CP0 298 (реакции)
ln 398 42,09 3,19 0,29 41,17 Дж 298
G3980 (реакции) Н3980 реакции Т S3980 (реакции)
40881 (398 ( 41,17)) 24495 Дж 24,5 кДж
Ответ: G2980 (реакции) 28,7 кДжG3980 (реакции) 24,5 кДж
Так как при повышении температуры значение энергии Гиббса повышается, скорость реакции падает, т.е. выход продуктов реакции (одним из которых является водород) падает.
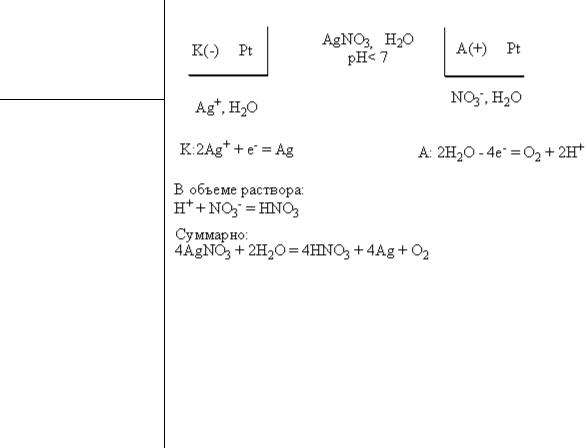
№ 91.
Для того, чтобы создать гальванический элемент из двух электродов первого рода одинаковой химической природы, необходимо погрузить их в растворы с различной концентрацией электролита, например:
Ni |1М NiSO4 || 0,001М NiSO4 | Ni K : Ni2 2e- Ni0
0 |
2 |
/ Ni |
0,25 |
В |
|
|
|
|
|
|
|||||
Ni |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
A : Ni 2e- Ni2 |
|
|
|
|
|
||||||||||
|
2 |
|
|
0 |
2 |
|
|
0,059 |
lg[Ni2 ] 0,25 0,0295 lg0,001 0,34 В |
||||||
/ Ni |
/ Ni |
|
|||||||||||||
Ni |
|
Ni |
|
|
|
|
2 |
|
|
|
|
||||
|
|
|
|
|
|
|
0 |
|
|
|
|
0,25 ( 0,34) 0,09 В |
|||
|
К |
|
А |
2 |
/Ni |
|
2 |
||||||||
|
|
|
|
|
|
Ni |
|
|
Ni |
|
/ Ni |
||||
A' |
n F 2 96500 0,09 17370 Дж/ моль 17,4 кДж/ моль |
||||||||||||||
М |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G AМ' 17,4 кДж/ моль
№ 102.
Дано: Решение: t 3 ч 10800 с
IПР 0,9 А m(Ag) 12,32 г
?
V(O2) ?
I |
|
m Ag F |
|
|
12,32 96500 |
1,02 A |
|||
t MЭ Ag |
|
|
|||||||
|
|
10800 108 |
|||||||
|
I IПР |
|
1,02 0,9 |
0,118 или 11,8% |
|||||
|
|
||||||||
|
|
I |
1,02 |
|
|
||||
V O2 |
I t VЭ O2 |
|
|
1,02 10800 5,6 |
0,64 л |
F |
|
||||
|
96500 |
|
|||
Ответ: 11,8% |
|
|
|
||
V O2 0,64 л |
|
|
|
||

№ 139.
Так как медь является более активным металлом, чем серебро, в этих условиях она подвергается коррозии с кислородной деполяризацией. Серебро является катодом. Образование этого гальванического элемента ускоряет коррозию:
Анодный процесс (на меди):
Сu 2e Cu2
Катодный процесс(на серебре):
O20 2H2O 4e 4OH
Суммарно :
2Сu O20 2H2O 2Cu(OH)2
К А O02 /OH Cu2 /Cu 0,4 0,34 0,06 В
AМ' n F 2 96500 0,06 11580 Дж/ моль 11,5 кДж/ моль
G AМ' 11,5 кДж/ моль
№ 141.
Для увеличения эффективной работы и эффективного КПД топливного элемента необходимо повысить клеммовое напряжение элемента. Это может быть достигнуто снижением поляризации топливного элемента и омических потерь.
Снижение поляризации ТЭ может быть достигнуто при увеличении температуры, перемешивании электролита, при увеличении концентрации или парциального давления веществ, подаваемых к электроду, применением катализаторов, увеличением поверхности электродов. Омическая поляризация элемента может быть снижена увеличением электропроводности электролита и снижением расстояния между электродами.
№ 167.
Титан - белый, пластичный металл, обладает высокой коррозионной стойкостью. В обычных условиях устойчив на воздухе (не тускнеет), при нагревании покрывается оксидно-нитридной пленкой. Пассивируется в воде, разбавленных серной и азотной кислотах. Не реагирует с разбавленными щелочами, гидратом аммиака. Реагируете водяным паром, хлороводородной и фтороводородной кислотами, концентрированной серной и азотной кислотами, концентрированными щелочами, галогенами, халькогенами, фосфором, углеродом, кремнием. При умеренном нагревании энергично поглощает водород:

Благодаря исключительно высокому сопротивлению коррозии титан - прекрасный материал для изготовления химической аппаратуры. Но главное свойство титана, способствующее все большему его применению в современной технике, - высокая жаростойкость как самого титана, так и его сплавов с алюминием и другими металлами. Кроме того, эти сплавы обладают жаропрочностью - способностью сохранять высокие механические свойства при повышенных температурах. Все это делает сплавы титана весьма ценными материалами для самолето- и ракетостроения.
Титан лишь немного тяжелее алюминия, но в 3 раза прочнее его. Это открывает перспективы применения титана в различных областях машиностроения. Использование деталей из титана и его сплавов в двигателях внутреннего сгорания позволяет снизить массу этих двигателей примерно на 30%.
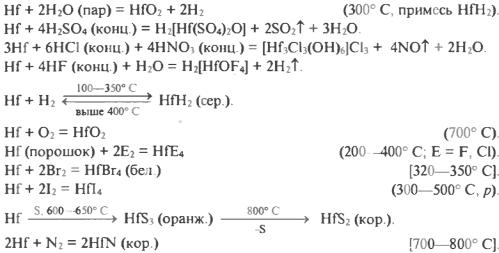
Цирконий - белый, довольно пластичный металл, тугоплавкий, высококипящий. На воздухе не тускнеет. Устойчив к коррозии в химически агрессивных средах. Не реагирует с водой, хлороводородной кислотой, щелочами (даже в расплаве), гидратом аммиака. Простых аквакатионов не образует. Переводится в раствор действием концентрированной серной кислоты, фтороводородной кислоты, «царской водки». Реагирует с кислородом, галогенами, серой, азотом при нагревании. Слабый восстановитель. Поглощает заметные количества Н2 и О2:
Одно из наиболее ценных свойств металлического циркония его высокая стойкость против коррозии в различных средах.
Цирконий почти не захватывает медленные (тепловые) нейтроны. Это его свойство в сочетании с высокой стойкостью против коррозии и механической прочностью при повышенных температурax делает цирконий и сплавы на его основе одним из главных
конструкционных материалов для энергетических атомных реакторов. К важнейшим сплавам циркония относятся циркаллои — сплавы, содержащие небольшие количества олова, железа, хрома и никеля.
При производстве стали присадки циркония служат для удаления из нее кислорода, азота, серы. Кроме того, цирконий используется в качестве легирующего компонента некоторых броневых, нержавеющих и жаропрочных сталей.
Добавка циркония к меди значительно повышает ее прочность, почти не снижая электрическую проводимость. Сплав на основе магния с добавкой 4-5 % цинка и 0,6-7 % циркония вдвое прочнее чистого магния и не теряет прочности при 200°С. Качество алюминиевых сплавов также значительно повышается при добавлении к ним циркония.
Гафний - белый, достаточно тяжелый, более твердый, чем цирконий металл; тугоплавкий, высококипящий. На воздухе не тускнеет. Устойчив к коррозии в химически агрессивных средах. Не реагирует с водой, хлороводородной кислотой, щелочами (даже в расплаве), гидратом аммиака. Переводится в раствор концентрированными серной и фтороводородной кислотами, «царской водкой». Окисляется кислородом при высокой температуре (медленнее, чем цирконий), реагирует с галогенами, серой, азотом:
Сплавы титана, легированные гафнием, применяются в судостроении (производство деталей судовых двигателей), а легирование гафнием никеля не только увеличивает его прочность и коррозионную стойкость, но и резко улучшает свариваемость и прочность сварных швов.
Добавление гафния к танталу резко увеличивает его стойкость к окислению на воздухе за счет образования плотной и непроницаемой пленки сложных оксидов на поверхности, и, кроме всего, эта пленка оксидов очень стойка к теплосменам (тепловой удар). Эти свойства позволили создать очень важные сплавы для ракетной техники (сопла, газовые рули). Один из лучших сплавов гафния и тантала для сопел ракет содержит до 20 % гафния. Также следует отметить большой экономический эффект при применении сплава гафний-тантал для производства электродов для воздушно-плазменной и кислородно-пламенной резки металлов.
Легирование гафнием резко упрочняет многие сплавы кобальта, очень важных в турбостроении, нефтяной, химической и пищевой промышленности.
