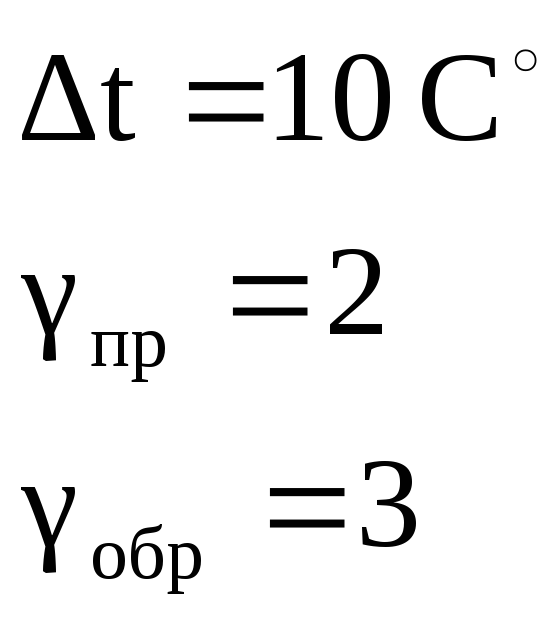Химия вариант17
.doc№ 3
Из 1,35 г оксида металла получается 2,85 г его нитрита. Вычислить эквивалентную массу его металла.
Ответ:
|
Дано:
|
|
|
Из закона эквивалентов:
![]()
Эквиваленты оксида и нитрита можно записать как:
![]()
Подставим эти выражения в закон
эквивалентов и выразим
![]()
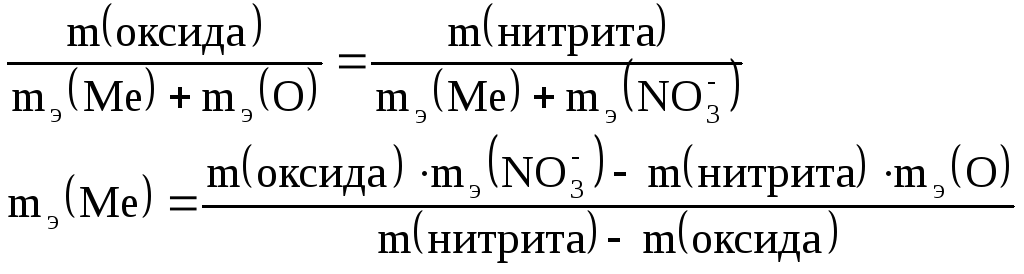
Тогда:
![]()
Ответ:
![]() .
.
№ 21
Что называется энергией сродства к электрону? В каких единицах она выражается? Как изменяется окислительная способность неметаллов в периодах и группах с увеличением порядкового номера?
Ответ:
Энергия сродства к электрону – это энергия, выделяющееся при присоединении электрона к свободному атому. Обычно энергию сродства к электрону выражают в электрон-вольтах.
Окислительная способность неметаллов в периоде с увеличением порядкового номера увеличивается. В группе наоборот – уменьшается.
№36
Возможна ли самопроизвольное протекание
реакции
![]() при стандартных условиях? Определите
температуру, при которой вероятность
протекания реакции в обоих направлениях
одинакова.
при стандартных условиях? Определите
температуру, при которой вероятность
протекания реакции в обоих направлениях
одинакова.
Ответ:
Определим возможность самопроизвольного протекания реакции при стандартных условиях:
![]()
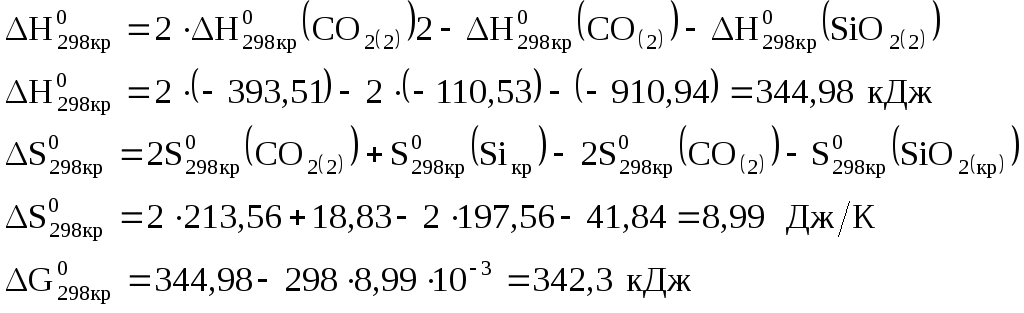
т.к.
![]() ,
то самопроизвольное протекание реакции
при стандартных условиях невозможно.
,
то самопроизвольное протекание реакции
при стандартных условиях невозможно.
Определим температуру при которой вероятность протекания реакции в обоих направлениях одинакова.
В этих условиях
![]() ,
тогда
,
тогда

Ответ: при стандартных условиях самопроизвольное протекание реакции невозможно, Т≈38373 К.
№ 55
В каком направлении сместиться равновесие
в системе
![]() есил давление увеличить в 2 раза и
одновременно повысить температуру на
10 градусов? Температурный коэффициент
прямой реакции равен 2, обратной – 3.
Каков знак
есил давление увеличить в 2 раза и
одновременно повысить температуру на
10 градусов? Температурный коэффициент
прямой реакции равен 2, обратной – 3.
Каков знак
![]() этой реакции?
этой реакции?
Ответ:
|
Дано:
|
|
|
![]()
Увеличение давления не окажет на
равновесие влияния, т.к. и по прямой и
по обратной реакциям образуются по 2
моля газообразных продуктов, т.к.
температурный коэффициент обратной
реакции больше, чем прямой, то при
повышении температуры скорость обратной
реакции увеличивается в большой степени,
следовательно равновесие сместиться
в сторону обратной реакции. А это говорит,
что прямая реакция является экзотермической,
т.е.
![]() .
.
Ответ:
![]() ,
,
![]() -
не окажет влияния,
-
не окажет влияния,
![]() - смещение равновесия в сторону
- смещение равновесия в сторону
обратной реакции.
№ 73
Металлы серебро и золото образуют
диаграмму плавкости с неограниченными
твердыми растворами. Начертите диаграмму,
если
![]() :
Ag-960,8; Au-1083.
покажите ход кристаллизации состава,
содержащего 80
:
Ag-960,8; Au-1083.
покажите ход кристаллизации состава,
содержащего 80
![]() Ag.
Определите число фаз и степеней свободы
при t=1040
Ag.
Определите число фаз и степеней свободы
при t=1040![]() и ниже линии солидуса.
и ниже линии солидуса.
Ответ:
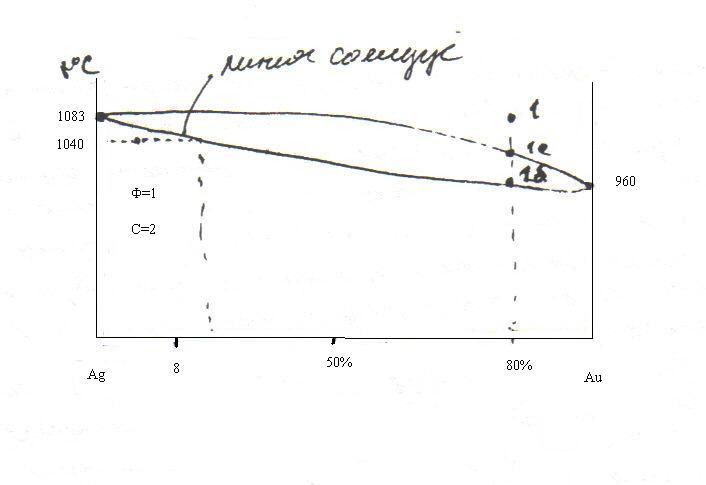
Ниже линии солидуса система однофазна – только твердое соединение, следовательно:
Ф=1, К=2, тогда С=2-1+1=2; С=2
При кристаллизации расплава состава 80% Ag, 20%Au:
От точки 1 до 1а – жидкость.
От точки 1а до 1б – кристаллизуется твердый раствор – состав жидкий+твердый раствор.
Ниже точки 1б – существует только тверды раствор.
№ 85
Сложные полупроводнике и их классификация
по периодической таблице. Приведите
примеры алмазоподобных полупроводниковых
соединений типа
![]() .
особенности химической связи и структуры.
Применение их в полупроводниковой
технике.
.
особенности химической связи и структуры.
Применение их в полупроводниковой
технике.
Ответ:
В периодической системе все элементы образующие полупроводниковые фазы, кроме бора, расположены правее так называемой границы Цинтля, которая разделяет элементы с дефицитом валентных электронов (менее 4-ех электронов на атом) и элементы у которых достаточное число валентных электронов для образования ковалентных связей в структурах простых веществ в соответствии с правилом Октета.
В бинарных соединениях между элементами, расположенными левее границы Цинтля, и элементами, стоящими вправо от нее, реализуются полярные ковалентные связи. Эти соединения проявляют полупроводниковые свойства, в том случае, если орбитали более электроотрицательного элемента полностью заполнены электронами.
Полупроводниковые соединения подчиняются
модифицированному правилу Октета, -
отношение числа валентных электронов
![]() ,
приходящиеся на одну формульную единицу,
к числу
,
приходящиеся на одну формульную единицу,
к числу
![]() атомов элемента групп
атомов элемента групп
![]() равна 8.
равна 8.
Состав таких соединений строго подчиняется правилу формальной валентности.
Формулы образованных соединений:
![]()
Интерес представляют бинарные
алмазободобные фазы, в состав которых
входят элементы группы равностоящих
от группы
![]() .
Они образуют изоэлектронные ряды Si,
Ge,
.
Они образуют изоэлектронные ряды Si,
Ge,
![]() .
.
Например:![]()
Кристаллическая структура этих соединений характеризуется тэтроэдрической координацией атомов как это имеет место в кристаллической решетке алмаза. Связь в соединениях – ковалентная полярная, поэтому решетка несколько искажена.
Наибольший интерес представляют
соединения
![]() и
и
![]() ,
которые в настоящие время являются
важнейшими материалами полупроводниковой
оптоэлектроники.
,
которые в настоящие время являются
важнейшими материалами полупроводниковой
оптоэлектроники.
На их основе создают: инжекционные лазеры и светодиоды, а также фотодиоды и фотоэлементы; генераторы СВЧ-колечаний, магниторезисторы и преобразователи Холла, полевые транзисторы.
№ 101
Определите рН раствора, в 1 л которого
содержится 4,7 г азотистой кислоты
![]() .
Как измениться степень диссоциации,
если концентрацию получившегося раствора
уменьшить в 10 раз?
.
Как измениться степень диссоциации,
если концентрацию получившегося раствора
уменьшить в 10 раз?
Ответ:
|
Дано: v=1 л
N=10 раз |
|
|
В растворе азотистая кислота диссоциирует в соответствии с уравнением:
![]()
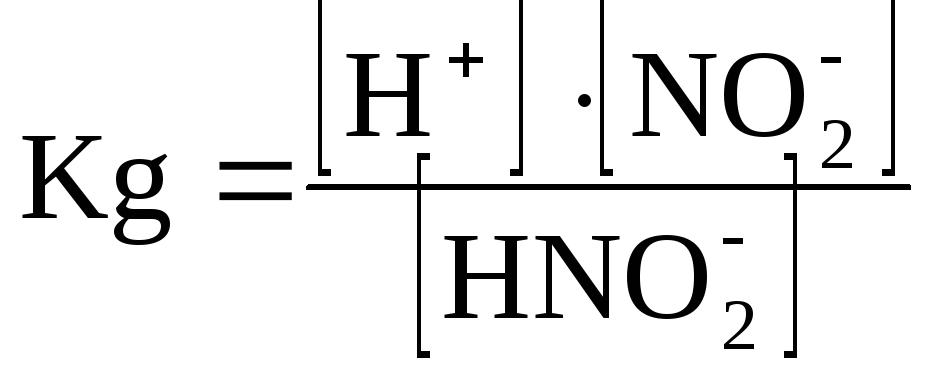
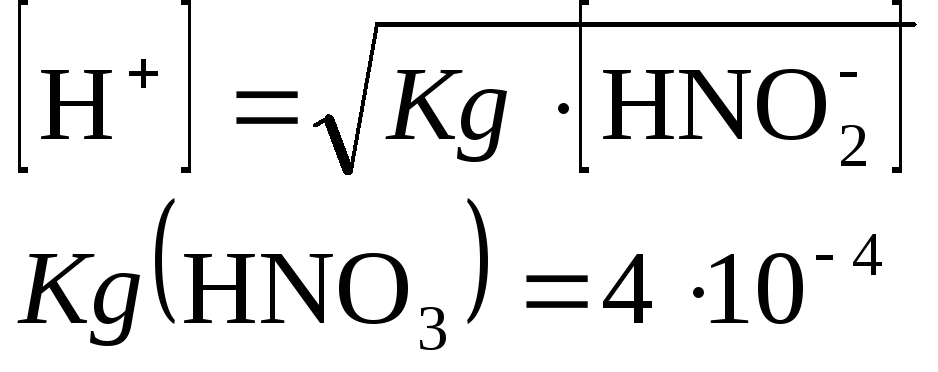
Определим молярную концентрацию:
Объем раствора 1 л, найдем
![]()

тогда
![]()
![]()
Найдем степень диссоциации 0,1
![]() раствора:
раствора:
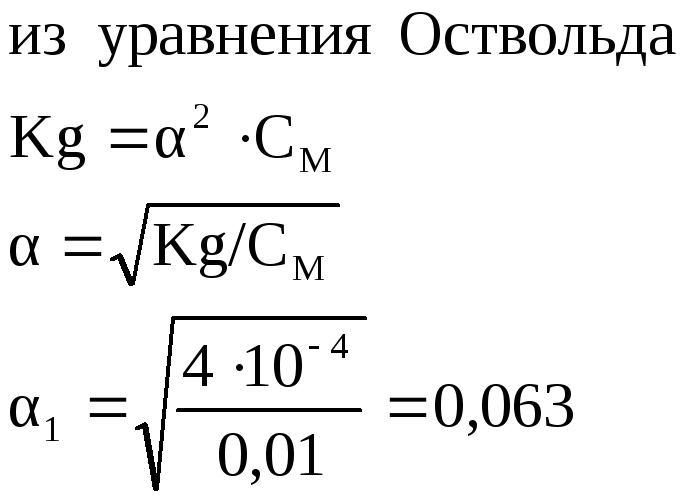
Найдем степень диссоциации 0,1
![]() раствора
(разбавление 10 раз):
раствора
(разбавление 10 раз):
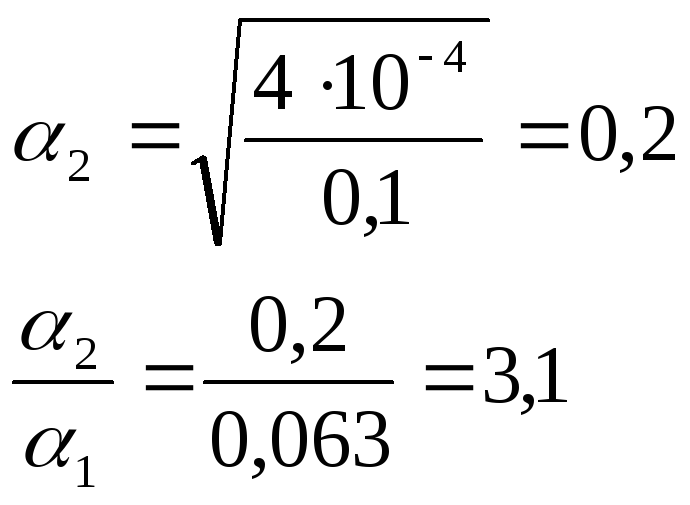
Ответ: рН=2,2; степень диссоциации увеличится в 3,1 раза.
№119
Эдс концентрированного гальванического
элемента, составленного из двух водородных
электродов, равен 272 мВ. Чему равен рН
раствора, в который погружен анод, если
катод погружен в раствор с рН=3 ? Напишите
уравнения анодно-катодных процессов и
рассчитайте
![]() .
.
Ответ:
|
Дано: Q=96500 Кл
|
|
|
Схема гальванического элемента:
![]()
Уравнения процессов на электродах:
![]()
Определим
![]() из уравнения:
из уравнения:
![]()
Определим
![]() :
:
![]() рН
рН
![]()
Определим
![]() :
:
![]() В
В
Определим pH из раствора в который погружен анод:
![]()
Определим
![]() :
:
![]()
Ответ:
![]()
№124
Определить выход по току (В![]() ),
если при прохождении через раствор
),
если при прохождении через раствор
![]() 96500 Кл электричества на катоде выделилось
30 г меди. Составить схему электролиза
на электродах: а) Pt; б) Cu.
96500 Кл электричества на катоде выделилось
30 г меди. Составить схему электролиза
на электродах: а) Pt; б) Cu.
Ответ:
|
Дано: Q=96500 Кл
|
|
|
Выход по току В![]() :
:
![]()
![]()
![]()
M – молекулярная масса
элемента,
![]() ;
;
Q – количество электричества, Кл;
B – валентность;
![]() г
г
![]()
Ответ: 94,93 %.
№ 145
Определить термодинамическую возможность коррозии свинца в среде электролита (рН=12). С какой деполяризацией, водородной или кислородной, будет происходить коррозия свинца? Ответ подтвердите соответствующими уравнениями и расчетами.
Ответ:
|
Дано: рН=12 |
|
|
Запишем возможные анодно-катодные процессы происходящие при электрохимической коррозии свинца в щелочной среде с а) кислородной деполяризацией; б) водородной деполяризацией;
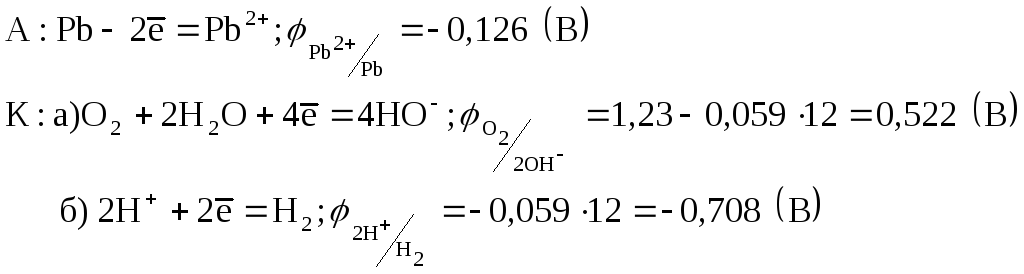
т.к.
![]() ,
то при рН=12 водородная деполяризация
невозможна.
,
то при рН=12 водородная деполяризация
невозможна.
![]() - кислородная деполяризация возможна.
- кислородная деполяризация возможна.
ЭДС процесса:
![]()
Определим изменения энергии Гиббса:
![]()
т.к.
![]() ,
коррозия свинца при рН=12 с кислородной
деполяризацией возможна.
,
коррозия свинца при рН=12 с кислородной
деполяризацией возможна.
Литература:
Курс общей химии/ Под ред. Н. В. Коровина. – М.: Высшая школа, 1988.
Харин А. Н., Катаева Н.А., Харина Л. Т. Курс химии. – М.: Высшая школа, 1983.