
Химия ОКР Вариант 26
.docxМинистерство образования Республики Беларусь
Учреждение образования
«Белорусский государственный университет информатики и радиоэлектроники»
Кафедра химии
Факультет заочного обучения
Специальность:
Информационные
технологии и управление в
технических системах
Контрольная работа №1 по дисциплине «Химия»
Вариант № 26
2.108.
Определите
скорость реакции
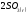 =
=
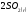 +
+
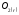 при исходной концентрации
при исходной концентрации
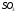 ,
равной 2,8 моль/л, и в момент времени,
когда получится 1 моль/л
,
равной 2,8 моль/л, и в момент времени,
когда получится 1 моль/л
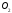 .
Какова концентрация получившегося
.
Какова концентрация получившегося
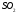 ?
Сформулируйте закон действия масс.
?
Сформулируйте закон действия масс.
Дано:
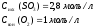
Найти:
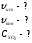
Решение:
Скорость реакций зависит от природы реагирующих веществ, концентрации или парциальных давлений (для газов), температуры, давления, присутствия катализатора, от величины поверхности взаимодействия.
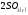 =
=
 +
+
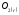
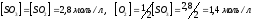
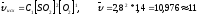



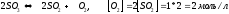
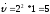
Ответ:
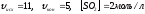
Закон действующих масс: химическое равновесие устанавливается, когда произведение концентрации продуктов реакции, возведенных в степени, равные стехиометрическим коэффициентам, деленное на произведение концентрации реагентов, возведенных в соответствующие степени, становится постоянной величиной при определенных условиях.
3. 127.
Найдите
константу равновесия (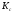 )
эндотермической реакции
)
эндотермической реакции
 если начальная концентрация
если начальная концентрация
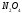 равна 0,08 моль/л, а к моменту равновесия
его израсходовалось 50%. Укажите способы
смещения равновесия вправо. Какой
физический смысл
равна 0,08 моль/л, а к моменту равновесия
его израсходовалось 50%. Укажите способы
смещения равновесия вправо. Какой
физический смысл
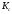 и от каких факторов зависит ее
численное значение?
и от каких факторов зависит ее
численное значение?
Дано:
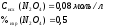
Найти:
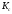 -
?
-
?
Решение:
Химическое
равновесие – состояние обратимого
процесса, при котором скорость прямой
реакции (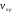 )
равна скорости обратной реакции (
)
равна скорости обратной реакции (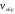 ).
Таким образом, кинетическим условием
наступления равновесия является
равенство скоростей
).
Таким образом, кинетическим условием
наступления равновесия является
равенство скоростей
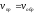 .
.
Численно
химическое равновесие выражается
константами равновесия
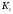 или
или
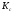 .
.
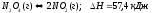
Запишем выражение для константы равновесия:
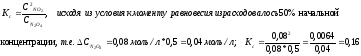
Значение константы химического равновесия зависит от природы реагирующих веществ и от температуры. Но не зависит от концентрации и от действия катализатора. Катализатор только ускоряет время наступления химического равновесия.
Если
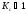 ,
(а
в нашем случаи
,
(а
в нашем случаи
 =0,16),
то равновесие смещается в сторону
обратной реакции. Т.к.
=0,16),
то равновесие смещается в сторону
обратной реакции. Т.к.
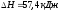 ,
то
увеличение температуры приведет к
образованию продукта реакции (реакция
сместиться вправо).
,
то
увеличение температуры приведет к
образованию продукта реакции (реакция
сместиться вправо).
При
понижении давления (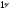 и
и
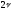 )
равновесие сместиться вправо (с
увеличением объема (числа молей)).
Повышение концентрации исходного
вещества так же будет приводить к
смещению равновесия в сторону прямой
реакции.
)
равновесие сместиться вправо (с
увеличением объема (числа молей)).
Повышение концентрации исходного
вещества так же будет приводить к
смещению равновесия в сторону прямой
реакции.
Константа равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции. Её выражают как отношение произведений концентрации конечных продуктов к отношению произведений концентраций исходных продуктов в степени стехиометрических коэффициентов.
4.
179.
Определите концентрацию ионов
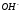 в растворе, в 1 л которого содержится
3,5 г
в растворе, в 1 л которого содержится
3,5 г
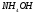 .
Запишите уравнение диссоциации и
выражение для Кд. Как изменится значения
α и КД при увеличении концентрации
раствора? Ответ обосновать.
.
Запишите уравнение диссоциации и
выражение для Кд. Как изменится значения
α и КД при увеличении концентрации
раствора? Ответ обосновать.
Дано:
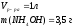
Найти:
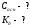
Решение:
Распад
молекул кислот, солей и оснований
под действием полярных молекул воды
на ионы называется электролитической
диссоциацией. Количественно способность
веществ диссоциировать на ионы
характеризуется степенью диссоциации
(α) – отношением числа молекул
электролита распавшихся на ионы (N),
к общему числу молекул электролита
в растворе (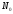 ).
).
Слабые
электролиты диссоциируют обратимо
до установления равновесия, которое
характеризуется константой
диссоциации ( ),
численное значение которой зависит
от природы электролита и температуры.
В слабых электролитах концентрация
ионов определяется по формуле:
),
численное значение которой зависит
от природы электролита и температуры.
В слабых электролитах концентрация
ионов определяется по формуле:
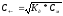 ,
где
,
где
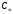 –
молярная концентрация электролита.
–
молярная концентрация электролита.
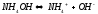 ,
,
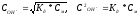
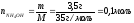 ,
,
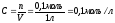
 ,
,
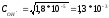
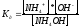
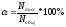
Коэффициент
диссоциации со степенью диссоциации
 отражается
простой зависимостью.
отражается
простой зависимостью.
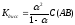 ,
,

Степень диссоциации слабого электролита увеличивается при разбавлении раствора обратно пропорционально корню квадратному из его молярной концентрации.
Ответ:
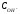 =
=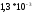
5.
225.
Сколько граммов гидроксида аммония
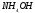 содержится в 1 л раствора, рН которого
равен 10,0? Запишите уравнение диссоциации
для
содержится в 1 л раствора, рН которого
равен 10,0? Запишите уравнение диссоциации
для
 и выражение для константы диссоциации.
и выражение для константы диссоциации.
Дано:

Найти:

Решение:
Характер водной среды оценивают с помощью водородного показателя (рН) – отрицательного десятичного логарифма молярной концентрации ионов водорода, т. е.:
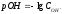 ,
, 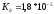 ,
,

Исходя
из уравнения
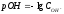 ,
,
 ,
определим концентрацию раствора
,
определим концентрацию раствора
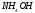 ,
используя соотношение:
,
используя соотношение:
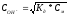 ,
,
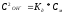 ,
откуда
,
откуда
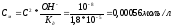
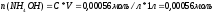
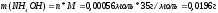
Уравнение
диссоциации для
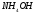 и выражение для константы диссоциации
имеет вид:
и выражение для константы диссоциации
имеет вид:
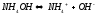 и
и
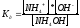
Ответ :
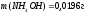 .
.
