

Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
«Казанский государственный технологический университет»
Кафедра «процессы и аппараты химической технологии»
Реферат
на тему
«Адсорбция»
Абсорбцией называют процесс поглощения газов или паров из газовых или парогазовых смесей жидким поглотителем -абсорбентом. Если поглощаемый газ – абсорбатив - химически не взаимодействует с абсорбентом, то такую абсорбцию называют физической (непоглощаемую составную часть газовой смеси называют инертом, или инертным газом). Если же абсорбтив образует с абсорбентом химическое соединение, то такой процесс называют хемосорбцией. В технике часто встречается сочетание обоих видов абсорбции.
Физическая абсорбция (или просто абсорбция) обычно обратима. На этом свойстве абсорбционных процессов основано выделение поглощенного газа из раствора -десорбция. Десорбцию газа проводят отгонкой его в токе инертного газа или водяного пара в условиях подогрева абсорбента или снижения давления над абсорбентом. Отработанные после хемосорбции абсорбенты обычно регенерируют химическими методами или нагреванием.
Сочетание абсорбции и десорбции позволяет многократно применять поглотитель и выделять поглощенный газ в чистом виде. Часто десорбцию проводить не обязательно, так как полученный в результате абсорбции раствор является конечным продуктом, пригодным для дальнейшего использования.
В промышленности абсорбцию применяют для решения следующих основных задач:
1) для получения готового продукта (например, абсорбция S03 в производстве серной кислоты, абсорбция НСl с получением хлороводородной кислоты, абсорбция оксидов азота водой в производстве азотной кислоты и т.д.); при этом абсорбцию проводят без десорбции;
2) для выделения ценных компонентов из газовых смесей (например, абсорбция бензола из коксового газа; абсорбция ацетилена из газов крекинга или пиролиза природного газа и т. д.); при этом абсорбцию проводят в сочетании с десорбцией;
3) для очистки газовых выбросов от вредных примесей (например, очистка топочных газов от S02, очистка от фтористых соединений газов, выделяющихся при производстве минеральных Удобрений и т.д.). Очистку газов oi вредных примесей адсорбцией используют также применительно к технологическим газам, когда присутствие примесей недопустимо для дальнейшей переработки Газа (наример, очистка коксового и нефтяного газов от H2S, очистка азотоводородной смеси для синтеза аммиака от С02 и СО и т. д.). В этих случаях извлекаемые из газовых смесей компоненты обычно используют, поэтому их выделяют десорбцией;
4) для осушки газов, когда в абсорбционных процессах (абсорбция, десорбция) участвуют две фазы -жидкая и газовая - и происходит переход вещества из газовой фазы в жидкую (при абсорбции) или наоборот, из жидкой фазы в газовую (при десорбции), причем инертный газ и поглотитель являются только носителями компонента соответственно в газовой и жидкой фазах и в этом смысле в массопереносе не участвуют.
Аппараты, в которых проводят процессы абсорбции, называют абсорберами.
Равновесие при абсорбции
При взаимодействии какого-либо газа с жидкостью возникает система, состоящая как минимум из трех компонентов (распределяемое вещество и два распределяющих вещества или носителя) и двух фаз - жидкой и газовой. Такая система по правилу фаз имеет три степени свободы
(С = К — Ф + 2 = 3 — 2 + 2 = 3).
Для данного случая массообмена переменными являются температура, давление и концентрации компонента А в газовой и жидкой фазах. Следовательно, в состоянии равновесия при условии постоянства температуры и общего давления зависимость между концентрациями распределяемого в газовой и жидкой фазах компонента (или парциальным давлением газа и составом жидкости) будет однозначной.
Чем выше растворимость газа в абсорбенте, тем меньше расход этого абсорбента. Поэтому при выборе абсорбента растворимость в нем поглощаемого газа рассматривается как важнейшее свойство данного абсорбента (наряду со стоимостью, доступностью, токсичностью, пожаро- и взрывоопасностью и т.п.).
Величина Е для данного газа не зависит от общего давления в системе, но зависит от природы абсорбента и поглощаемого газа и от температуры.
В
идеальных растворах силы взаимодействия
между молекулами каждого из компонентов
раствора, а также молекулами различных
компонентов равны между собой. Поэтому
улетучивание того или иного компонента
из жидкой фазы в газовую не зависит от
присутствия в растворе других компонентов
и определяется содержанием в растворе
данного 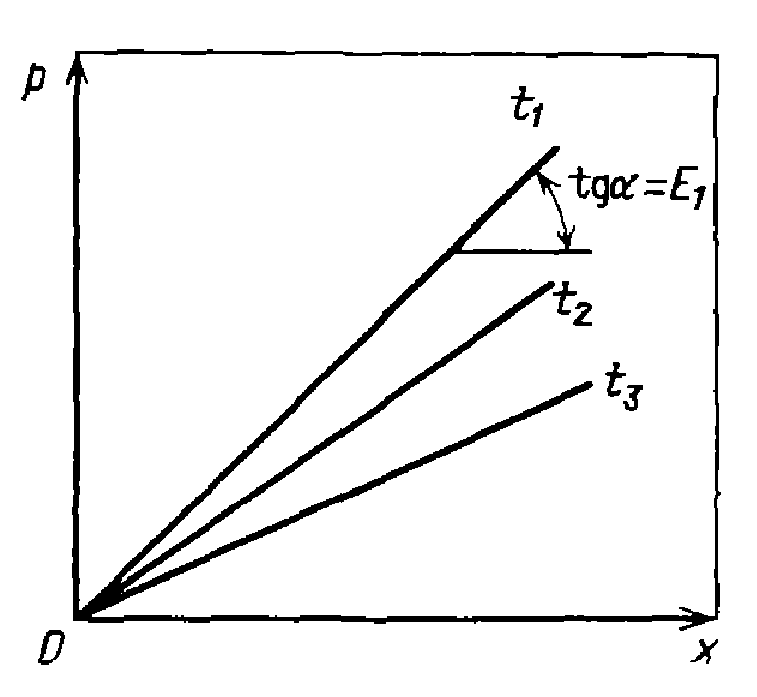 компонента.
компонента.
Для идеальных растворов на диаграмме р — х зави¬симость равновесных концентраций от давления изображается прямой с наклоном, равным E, С повышением температуры значение Е увеличивается и соответственно уменьшается растворимость газа в жидкости.
Зависимость между концентрациями данного компонента в газовой смеси и в равновесной с ней жидкости выражается прямой линией (линия равновесия), проходящей через начало координат и имеющей угол наклона а, тангенс которого равен т. Значения величины т уменьшаются при снижении температуры и увеличении давления в системе. Поэтому растворимость газа в жидкости увеличивается с повышением давления и снижением температуры.
Если в равновесии находится смесь газов, то закону Генри
может следовать каждый из компонентов этой смеси в отдельности.
Как уже отмечалось, закон Генри справедлив для идеальных растворов, поэтому он применим лишь к сильноразбавленным Растворам. При повышенных давлениях (порядка нескольких мегапаскалей и выше) изменение объема жидкости вследствие растворения в ней газа соизмеримо с изменением объема газа, и равновесие в этом случае не следует закону Генри.
При выражении состава фаз в относительных концентрациях запись закона Генри видоизменяется. В этом случае уравнение принимает следующий вид:
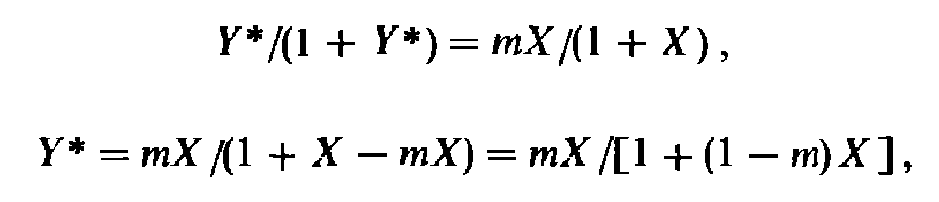
т. е. равновесие в системе газ-жидкость при выражении состава фаз в относительных концентрациях изображается кривой линией. Для сильноразбавленных растворов, т. е. при низких концентрациях газа в жидкости, можно принять (1 — т)Х = 0. При этом в уравнении знаменатель обращается в единицу, и оно принимает вид:
![]()
т.е. при низких концентрациях закон Генри изображается прямой линией.
Для хорошо растворимых газов, при больших концентрациях их в растворе, растворимость меньше, чем следует из закона Генри.
