
Санкт-Петербургский государственный медицинский университет
имени академика И.П.Павлова
Федерального агентства по здравоохранению
и социальному развитию России
______________________________________________________________________
Кафедра факультетской терапии с курсом эндокринологии
С.И. Моисеев, Г.Н. Салогуб, Н.В. Степанова
Современные принципы диагностики и лечения множественной миеломы
Пособие для студентов IV-VI курсов, интернов и клинических ординаторов
Санкт-Петербург
Издательство СПбГМУ
2006
Авторы:
С.И.Моисеев, Г.Н.Салогуб, Н.В.Степанова.
Рецензент:
доцент кафедры гематологии, трансфузиологии, трансплантологии СПбГМУ
им. акад. И.П.Павлова , д.м.н. А.А. Ганапиев.
Утверждено на заседании ЦМК по терапии СПбГМУ им. акад. И.П.Павлова.
Протокол № 59 от 2 октября 2006 г.
С.И.Моисеев, Г.Н.Салогуб, Н.В.Степанова. Современные принципы диагностики и лечения множественной миеломы: Пособие.- СПб.: Издательство СПбГМУ, 2006.- с.39.
Диагностика множественной миеломы и выбор оптимальной тактики лечения остается актуальной проблемой современной гематологии.
В рамках данного пособия представлены современные сведения об особенностях клинических проявлений, принципах диагностики, выборе метода лечения, контроле эффективности проводимой терапии у больных множественной миеломой. Пособие предназначено для врачей-терапевтов, врачей-гематологов, студентов IV-VI курсов медицинских ВУЗов, интернов, клинических ординаторов.
© Авторы, 2006.
© Издательство СПбГМУ, 2006.
Список принятых сокращений
ИЛ-1 - интерлейкин 1
ИЛ-6 - интерлейкин 6
КТ - компьютерная томография
ЛДГ - лактатдегидрогеназа
ММ – множественная миелома
МГНЗ (MGUS) - моноклональная гаммапатия неопределенного значения
МРТ - магнитнорезонансная томография
МО – минимальный ответ
IPI - международный прогностический индекс (International prognostic index)
ПЭТ – позитронно-эмиссионной томография
ПР- полная ремиссия
nПР – близкая к полной ремиссия (nCR – near Complete remission)
ПО – полный ответ
ТNF – туморнекротический фактор
ТГСК – трансплантация гемопоэтических стволовых клеток
ТПСК - трансплантацией периферических стволовых клеток
FISH– флюоресцентная in situ гибридизация
ЧР – частичная ремиссия
ЧО – частичный ответ
Множественная миелома
Общая характеристика
Множественная миелома (ММ) – плазмоклеточная опухоль, характеризующаяся деструктивным поражением скелета, развитием почечной недостаточности, анемии и гиперкальциемии. Заболевание относится к группе злокачественных моноклоновых гаммапатий. В последней классификации ВОЗ лимфоидных опухолей (1997) заболевание относится к группе В-клеточных опухолей с фенотипом зрелых (периферических) клеток и охарактеризовано как миелома или плазмоцитома (солитарная и внекостная). Синонимами термина множественная миелома являются миелома, плазмоклеточная миелома, активная миелома, симптоматическая миелома, болезнь Рустицкого-Калера.
Эпидемиология
Множественная миелома составляет 1% от всех онкологических и 14% от всех онкогематологических заболеваний. Имеется некоторая расовая предрасположенность к данному заболеванию: люди негроидной расы болеют чаще, чем европеоидной, а люди монголоидной расы – крайне редко. Самая низкая заболеваемость ММ наблюдается в Китае – 1 случай на 100000 населения, самая высокая заболеваемость имеет место среди мужчин негроидной расы в США – 1 случай на 10000 населения. В среднем частота заболеваемости ММ составляет 4 случая на 100 000 населения. Соотношение мужчин и женщин составляет 3:2. Множественная миелома встречается от 18 до 85 лет, но чаще в пожилом возрасте. Средний возраст больных ММ - 69 лет.
Этиопатогенез
Этиология заболевания не установлена. В настоящее время обсуждаются только предрасполагающие факторы, к которым относят генетическую предрасположенность (косвенно об этом свидетельствуют расовые различия частоты встречаемости ММ, описание случаев ММ у монозиготных близнецов и членов одной семьи), хроническую антигенную стимуляцию (инфекции, хроническое воспаление, заболевания соединительной ткани, аутоиммунные процессы, аллергические заболевания), воздействие на гемо- и иммуногенез вирусов (вирус приобретенного иммунодефицита человека, вирус гепитита С, герпесвирус 8 типа и некоторые другие) и ионизирующего излучения.
В качестве первого этапа развития ММ рассматривается появление ограниченного количества клональных плазматических клеток, секретирующих моноклональный иммуноглобулин. Это состояние обозначают как моноклональная гаммапатия неопределенного значения (МГНЗ или MGUS в иностранной транскрипции). Клинически МГНЗ, как правило, никак не проявляется, но в 1% случаев в год имеет место трансформация МГНЗ в ММ. При ММ объектом опухолевой трансформации является клетка-предшественница В-лимфоцитов, прошедшая этапы антиген-зависимой дифферецировки, переключения изотипов Н-цепей Ig и гипермутаций V-региона. Будучи опухолевой, эта клетка способна дифференцироваться до конечного этапа – плазмоцита, секретирующего моноклональный Ig. Опухолевая трансформация клетки-предшественницы В-лимфоцитов является результатом транслокации или нарушения экспрессии онкогенов в локусe IgH (тяжелых цепей иммуноглобулинов) на 14 хромосоме в регионе q32. Кроме того, в патогенезе опухолевой трансформации принимает участие, по крайней мере, один из пяти генов-партнеров: BCL1/PRAD-1/cyclin D1 (11q23), cyclin D3 (6p21), FGFR3-MMSET (4p16.3), c-maf (16q23), mafB (20q11). В 50% случаев может иметь место делеция или моносомия 13 хромосомы. В процессе опухолевой прогрессии развивается дополнительная хромосомная нестабильность, что приводит к мутациям или дизрегуляции экспрессии таких ключевых генов как C-myc, N-ras, K-ras, FGFR3 и p53. В патогенезе ММ принимают участие сотни различных генов, определяющих процессы пролиферации, дифференцировки, клеточного апоптоза, секрецию цитокинов и факторов роста. В настоящее время с помощью молекулярногенетических методов (метод секвенирования и метод microarray гибридизации) выявлена экспрессия 9732 генов и составлен каталог экспрессированных генов при множественной миеломе (Myeloma Gene Index).
Кроме изменений в плазматических клетках в патогенезе ММ большое значение имеют изменения в костномозговом микроокружении, включающие активацию ангиогенеза, нарушение функции клеточноопосредованного иммунитета, нарушение паракринной и аутокринной регуляции. Это касается, прежде всего, избыточной продукции интерлейкина 6 (ИЛ-6), интерлейкина 1b (ИЛ-1b), сосудистого эндотелиального ростового фактора (VEGF). ИЛ-6 – основной стимулятор роста и дифференцировки миеломных клеток и клеток- предшественников опухолевого клона. Высокий уровень ИЛ-6 и большое число рецепторов к нему на поверхности плазматических клеток отражает степень активности заболевания и выявляется при прогрессии заболевания. ИЛ-1b синтезируется миеломными клетками и не определяется в норме. Этот цитокин играет ведущую роль в процессах межклеточного взаимодействия, стимулируя продукцию молекул межклеточной адгезии (ICAM), эндотелиально-лейкоцитарной адгезии (ELAM), васкулярно-клеточной адгезии (VCAM), а также активирует остеокласты и продукцию ИЛ-6. Повышенная продукция ИЛ-1b влияет на диссеминацию опухолевых клеток при ММ, а также их контакт с клетками стромы и сосудами. На диссеминацию миеломных клеток влияет также повышенная продукция миеломными клетками металлопротеиназ. Межклеточные взаимодействия плазматических клеток, клеток стромы костного мозга и микросусудов лежат в основе опухолевого роста у больных ММ и резистентности к химиотерапии.
В основе патогенеза литических поражений кости при ММ лежит ингибиция остеобластов и активация остеокластов. На остеобластах увеличена экспрессия рецептора лиганда ядерного фактора κβ (NF-κβ) (RANKL) и снижению антагониста рецептора - остеопрогерина, что приводит к увеличению клеточного апоптоза. Увеличение отношения RANKL к остеопрогерину отражает снижение активности остеобластов и увеличение активности остеокластов, что и приводит к повышенной резорбции костной ткани и развитию остеолитических очагов. В основе увеличения экспрессии RANKL лежит повышенная продукция миеломными клетками макрофагального воспалительного белка MIP1α. В генезе остеолизиса лежит также повышенная продукция DKK1, параттиреоподобного протеина, остеокласт активирующего фактора.
Классификация множественной миеломы.
Как уже указывалось, множественная миелома относится к группе злокачественных моноклональных гаммапатий. Ниже приводим классификацию этих патологических состояний.
Классификация злокачественных моноклональных гаммапатий
1. Множественная миелома (Симптоматическая миелома)*.
2. Вялотекущая (тлеющая) или индолентная миелома.
3. Плазмацитома.
А) Солитарная плазмацитома костей.
Б) Экстрамедуллярная плазмацитома.
4. Злокачественные лимфопролиферативные заболевания
А) Макроглобулинемия Вальденстрема
Б) Неходжкинские лимфомы
5. Болезнь тяжелых цепей
6. Амилоидоз (первичный AL-амилоидоз и вторичный)
* - выделяют вариантные (редкие) формы множественной миеломы:
А) несекретирующая множественная миелома
Б) остеосклеротическая форма миеломы
С) биклональная миелома
Д) плазмоклеточный лейкоз
К доброкачественным моноклональным гаммапатиям относятся моноклональные гаммапатии неопределенного значения (МГНЗ), именуемые в зарубежной литературе MGUS (monoclonal gammapathy of undetermined significance).
Классифицирование множественной миеломы проводят по степени активности опухолевого процесса (симптоматическая или индолентная миелома), продукции патологического белка (иммунохимические варианты), распространенности опухолевого процесса и степени поражения органов-мишеней (стадии множественной миеломы).
В зависимости от типа секретируемого белка выделяют 7 иммунохимических вариантов множественной миеломы (таблица 1).
Таблица 1
Иммунохимические варианты множественной миеломы
Вариант |
Моноклональный Ig сыворотки |
Моноклональный Ig мочи (белок Бенс-Джонса) |
Частота % |
G-миелома |
Gκ |
Κ |
55 - 65 |
Gλ |
Λ |
||
Gκ или Gλ |
- |
||
А - миелома |
А κ |
Κ |
20 - 25 |
А λ |
Λ |
||
А κ или А λ |
- |
||
D -миелома |
D κ |
Κ |
2 - 5 |
D λ |
Λ |
||
D κ или D λ |
- |
||
Е - миелома |
Еκ |
Κ |
не установлена |
Еλ |
Λ |
||
Еκ или Еλ |
- |
||
Болезнь легких цепей (миелома Бенс-Джонса) |
отсутствует |
Κ |
12 - 20 |
|
Λ |
||
Диклоновые миеломы |
Разные соотношения двух и более моноклональных белков |
κ или λ |
1 - 4 |
М- миелома |
Мκ |
Κ |
0,5 |
Мλ |
Λ |
||
Мκ или Мλ |
- |
В зависимости от степени и распространенности поражения костной ткани по данным рентгенографии костей выделяют также следующие формы ММ: диффузная, диффузно-очаговая, очаговая. Данная классификация в клинической практике последнее время используется редко, так как не определяет ни тактики лечения, ни прогноз заболевания. Принципиальное значение для прогноза течения заболевания и ответа на терапию имеет стадия заболевания. В настоящее время используется несколько подходов к стадированию ММ. Ниже приводим основные критерии стадирования заболевания.
Стадии множественной миеломы по Durie/Salmon
Стадия I
Все нижеперечисленные критерии:
- гемоглобин более 100 г/л;
- кальций сыворотки в пределах нормы или менее 2,6 ммоль/л (10,5 мг/дл);
- нормальная костная структура (по шкале - 0) при рентгенологическом исследовании или солитарная костномозговая плазмацитома;
- низкий уровень продукции М-компонента (уровень IgG менее 50 г/л, уровень IgA менее 30 г/л, в моче при электрофорезе М-компонент легких цепей менее 4 г /24 часа).
Стадия II
Не соответствует критериям ни для I ни для III стадии
Стадия III
Один или более критериев из нижеперечисленных:
- гемоглобин менее 85 г/л;
- кальций в сыворотке более 3,0 ммоль/л (12 мг/дл);
- распространенные литические костные повреждения ( по шкале - 3);
- высокий уровень продукции М-компонента:
( уровень IgG более 70 г/л, уровень IgA более 50 г/л, в моче при электрофорезе М-компонент легких цепей более 12 г /24 ч.
Субклассификация (деление на А или В варианты в зависимости от функции почек):
А- уровень креатинина в сыворотке менее 200 ммоль/л
В- уровень креатинина более 200 ммоль/л.
В связи с внедрением в клиническую практику новых рентгенорадиологических методов исследования в настоящее время предложена новая система стадирования множественной миеломы по данным магнитно-резонансной томографии (МРТ) и позитронно-эмиссионной томографии (ПЭТ) с 18-фтордезоксиглюкозой (Durie/Salmon PLUS система стадирования) (таблица 2).
Таблица 2
Durie/Salmon PLUS система стадирования множественной миеломы
Классификация |
Плюс (PLUS) |
ЯМР и/или ПЭТ c 18-фтордеоксиглюкозой |
Моноклональные гаммапатии неопределенного значения |
|
Отсутствуют очаги поражения |
Стадия IА (тлеющая или индолентная миелома) |
|
Плазмацитома и/или ограниченный очаг |
Множественная миелома Стадии IБ, IIA/Б, IIIA/Б. |
|
|
Стадия IБ |
|
< 5 локальных очагов, диффузная форма легкой степени тяжести |
Стадия II А/Б |
|
5-20 локальных очагов, диффузная форма средней степени тяжести |
Стадия IIIA/Б |
|
>20 локальных очагов, диффузная форма тяжелой степени |
|
А – креатинин сыворотки <2 мг/дл, отсутствие вне-костномозговых очагов; Б - креатинин сыворотки > 2 мг/дл, наличие вне-костномозговых очагов; |
|
Учитывая тесную связь между содержанием в сыворотке β2-микроглобулина и альбумина с одной стороны и опухолевой массой с другой - для стадирования множественной миеломы используются также эти показатели.
Система стадирования множественной миеломы по величине β2-микроглобулина и альбумина в сыворотке крови, предложенная югозападной онкологической группой в 2003 году (SWOG система):
Стадия I β2-микроглобулин < 2,5 мг/дл
Стадия II β2-микроглобулин ≥ 2,5 < 5,5 мг/дл
Стадия III β2-микроглобулин ≥ 5,5 мг/дл
альбумин сыворотки ≥ 3 г/дл
Стадия IV β2-микроглобулин ≥ 5,5 мг/дл
альбумин сыворотки < 3 г/дл
Система стадирования множественной миеломы по величине β2-микроглобулина и альбумина в сыворотке крови, предложенная международной рабочей группой по миеломе в 2003 году, предусматривает выделение 3-х стадий заболевания. Данная классификация используется также для оценки прогноза заболевания и предложена ESMO (Европейским обществом медицинской онкологии ) в 2005 году для расчета международного прогностического индекса (IPI- International prognostic index)
IPI группа 1 β2-микроглобулин < 3,5 мг/дл
альбумин сыворотки > 3,5 г/дл
IPI группа 2 β2-микроглобулин < 3,5 мг/дл
альбумин сыворотки < 3,5 г/дл
или β2-микроглобулин 3,5 - 5,5 мг/дл
IPI группа 3 β2-микроглобулин > 5,5 мг/дл
К прогностически неблагоприятным факторам кроме уровня β2-микроглобулина, альбумина сыворотки, учитываемых при расчете IPI, относят также возраст старше 65 лет, плохой соматический статус (ECOG 3 или 4, то есть больной ≥ 50% времени проводит в постели и нуждается в сестринском уходе), увеличение уровня креатинина, СРБ (С -реактивного белка), ЛДГ (лактатдегидрогеназы) в сыворотке крови, снижение уровня гемоглобина и количества тромбоцитов в крови, высокий пролиферативный индекс плазматических клеток, наличие плазмобластов в миелограмме, наличие гиподиплоидии и делеции или моносомии 13 хромосомы при цитогенетическом исследовании клеток костного мозга, наличие экстрамедуллярных опухолевых очагов по данным магнитно-резонансной и протонноэмиссионной томографии.
Таким образом, при формулировке диагноза необходимо указывать иммунологический вариант ММ, стадию заболевания (с указанием на систему стадирования), международный прогностический индекс. В случае вариантной формы ММ указывается вариантная форма. При наличии у больного прогностически неблагоприятных факторов, не учитываемых IPI, при формулировке диагноза может быть указан фактор, влияющий на прогноз заболевания. При повторных госпитализациях указывается также ответ на терапию.
Примеры формулировки диагноза ММ :
1). Множественная миелома А κ, IIIA стадия по Дьюри/Сальмону.
2). Множественная миелома А κ, IIIA стадия по Дьюри/Сальмону Плюс.
3). Множественная миелома А κ, IV стадия по SWOG, IPI 3.
4). Несекретирующая множественная миелома, IIIA стадия по Дьюри/Сальмону Плюс.
5). Множественная миелома А κ, IIIA стадия по Дьюри/Сальмону. Прогностически неблагоприятный вариант (делеция 13 хромосомы, комплексные хромосомные нарушения).
6). Множественная миелома А κ, полная ремиссия (с указанием даты верификации).
Клинические проявления и диагностика множественной миеломы.
Клинические проявления могут отсутствовать у больных множественной миеломой в течение нескольких месяцев и лет. Диагноз в этом случае устанавливается случайно при проведении лабораторных или рентгенологических исследований во время диспансеризации или по поводу сопутствующих заболеваний. Клинические проявления обусловливаются инфильтрацией костного мозга миеломными клетками, остеолизом костной ткани, внекостномозговым распространением опухоли, секрецией моноклонового белка.
Одно из основных проявлений заболевания – поражение костей. В основе этого процесса лежит усиление резорбции костной ткани. У 80% больных имеет место диффузный остеопороз (остеопения) в сочетании с единичными или множественными остеолитическими очагами и патологическими переломами. Остеодеструкции чаще развиваются в плоских костях (кости черепа, таза, ребра, грудина, лопатки, позвонки) и проксимальных эпифизах плечевых и бедренных костей, но могут наблюдаться и в трубчатых костях (рис.1). Наиболее характерны изменения в костях черепа: дефекты костной ткани выглядят как бы выбитыми пробойником или как бы изъеденными молью (рис.2). При поражении позвоночника тела позвонков уплощаются, приобретая форму рыбьих позвонков, вследствие чего рост больного может уменьшиться, что получило название вертебрального коллапса. Возможно развитие вколоченных переломов позвонков, повышенная подвижность дисков с развитием компрессии спинного мозга и неврологической симптоматики: появлением геми- и парапарезов и параличей конечностей, нарушением функции тазовых органов. Боли в костях отмечаются у 70-80% больных ММ. Чаще они локализуются в области пораженных позвонков, ребер, реже - в трубчатых костях. Болевой синдром обычно усиливается при движении или изменении положения тела пациента. Для определения топики поражения и величины распространения опухолевого процесса в этом случае целесообразно выполнение МРТ. Рентгенологические изменения в костях не являются специфическими и позволяют только заподозрить ММ. Диагноз ММ ставится только после лабораторного подтверждения. Для ММ характерны спонтанные легко возникающие переломы костей, поэтому зачастую пациенты с ММ поступают в гематологические отделения после обследования и лечения у травматолога. Внекостная плазмацитома проявляется поражением мягких тканей преимущественно в области головы, шеи, верхних конечностей, но может затрагивать печень, почки.
Повышенная резорбция костной ткани приводит к развитию у 20-40% больных ММ гиперкальциемии с появлением жалоб на повышенную утомляемость, мышечную слабость, чувство жажды, тошноту, запоры, сонливость. Возможно также развитие гипотонии, нарушений ритма сердца, судорог, спутанности сознания и комы. Гиперкальциемия приводит к ухудшению концентрационной способности канальцев, ухудшению гломерулярной фильтрации, повреждению почек, развитию полиурии. Гистологически поражение канальцев вследствие гиперкальциемии проявляется некрозом и приводит к развитию почечной недостаточности.
Нарушение функции почек – одно из наиболее серьезных осложнений ММ и наблюдается в среднем у 30% больных ММ к моменту диагностики. Почечная недостаточность – одна из основных причин смерти больных ММ. У 60-70% больных ММ имеет место гиперпротеинурия, в основе которой лежит секреция белка Бенс-Джонса. У 20% больных ММ имеет место протеинурия Бенс-Джонса, не ассоциированная с парапротеинемией. Таким образом, основанием для обследования у гематолога больного ММ может быть выявление повышенной потери белка с мочой.
У 60-70% больных ММ при первичном обращении к врачу выявляется анемия, как правило, нормоцитарная, нормохромная. В половине случаев она сочетается с умеренной лейкопенией и тромбоцитопенией. Крайне редко у больного ММ развивается панцитопенический синдром. Выраженность анемического синдрома определяется стадией заболевания и опухолевой массой. При эффективной химиотерапии, уменьшении опухолевой массы анемический синдром, как правило, исчезает. Причиной цитопенического синдрома у больных ММ является специфическая инфильтрация костного мозга миеломными клетками, высокий уровень ФНО, изменения стромы костного мозга.
Повышенная секреция патологического моноклонального белка приводит к гиперпротеинемии и, как следствие, к синдрому гипервязкости крови, который обычно проявляется головокружением, головными болями, сонливостью, быстрой утомляемостью, ухудшением течения сопутствующих сердечно-сосудистых заболеваний. В отличие от макроглобулинемии Вальденстрема при ММ синдром гипервязкости встречается у 10-15% больных. Однако прогноз заболевания хуже и риск осложнений химиотерапии выше у больных ММ с синдромом гипервязкости. Если суммировать возможные клинические проявления синдрома гипервязкости, то можно выделить следующие группы симптомов:
неврологические жалобы (головная боль, головокружения, атаксия, парастезии, сомноленция, эпизоды потери сознания, кома);
нарушения зрения (размытость границ предметов, диплопия, потеря зрения);
повышенная кровоточивость (кровоточивость десен, носовые кровотечения, реже- желудочно-кишечное кровотечение, послеоперационные кровотечения);
склонность к тромбозам мелких сосудов (артерии, вены), нарушение микроциркуляции с ухудшением течения сердечно-сосудистых заболеваний (ишемической болезни сердца, гипертонической болезни).
Гиперпротеинемия с М-компонентом в протеинограмме (рис.3) часто выявляется случайно при плановом обследовании или при проведении обследования по поводу высокой скорости оседания эритроцитов (СОЭ). Высокая СОЭ характерна для пациентов с множественной миеломой и её величина определяется выраженностью гиперпротеинемии и, в меньшей степени, анемии. Продукция моноклонового патологического белка приводит к нарушению гуморального иммунитета и повышенному риску инфекционных осложнений. К снижению иммунитета приводит также нарушение функции клеточного иммунитета (В-лимфоцитов и в меньшей степени Т-лимфоцитов). Инфекции у больных ММ могут быть вызваны как бактериальными агентами, так и вирусами. Больные ММ часто страдают герпес-вирусными инфекциями, в том числе Herpes zoster.
Увеличение в сыворотке крови моноклонового патологического белка может приводить к нарушению свертывания крови и развитию геморрагического синдрома. Гипоальбуминемия отмечается у большинства больных ММ и обусловлена с одной стороны - нарушением белковосинтетической функции печени, с другой – повышенной потерей белка с мочой. Гипоальбуминемия может сопровождаться появлением отеков, особенно у пациентов с сопутствующими сердечно-сосудистыми заболеваниями.
Миеломная нефропатия – одно из серьезных осложнений множественной миеломы. При поздней диагностике заболевания у большинства больных ММ нарушается функция почек и развивается хроническая почечная недостаточность с соответствующими клиническими проявлениями. В ряде случаев миеломная нефропатия сочетается с AL-амилоидозом почек, который носит вторичный характер, но усугубляет течение ММ.
Симптомы опухолевой интоксикации у больных ММ, как правило, мало выражены. Общую слабость, недомогание, похудание отмечают менее половины больных. Повышение температуры до субфебрильных цифр, повышенную потливость, не связанные с инфекцией, отмечают менее 20% больных.
У части пациентов множественная миелома ассоциирована с AL-амилоидозом. В этом случае у больных кроме протеинурии, почечной недостаточности могут развиваться гипотензия, синдром малабсорбции, проявления периферической нейропатии. В генезе ортостатической гипотензии у больных ММ может иметь значение также гипонатриемия, встречающаяся у 20% больных.
Диагноз ММ можно поставить только на основании лабораторно-инструментальных методов исследования. В связи с этим показанием к комплексному обследованию больных старше 40 лет могут служить следующие клинические и лабораторные проявления:
- необъяснимые боли в спине или костях;
- спонтанные или несоответствующие травме переломы;
- обнаружение остеолитических очагов или выраженного остеопороза при рентгенологическом исследовании;
- наличие у больного необъяснимой анемии;
- наличие у больного почечной недостаточности;
- необъяснимая протеинурия;
- необъяснимые отеки или асцит;
- наличие нефротического синдрома;
- рецидивирующие инфекции;
- выявление ускоренной СОЭ;
- необъяснимая периферическая нейропатия;
- синдром карпального канала;
- гиперкальциемия;
- приобретенные нарушения свертывания крови;
- ортостатическая гипотензия;
- синдром малабсорбции.
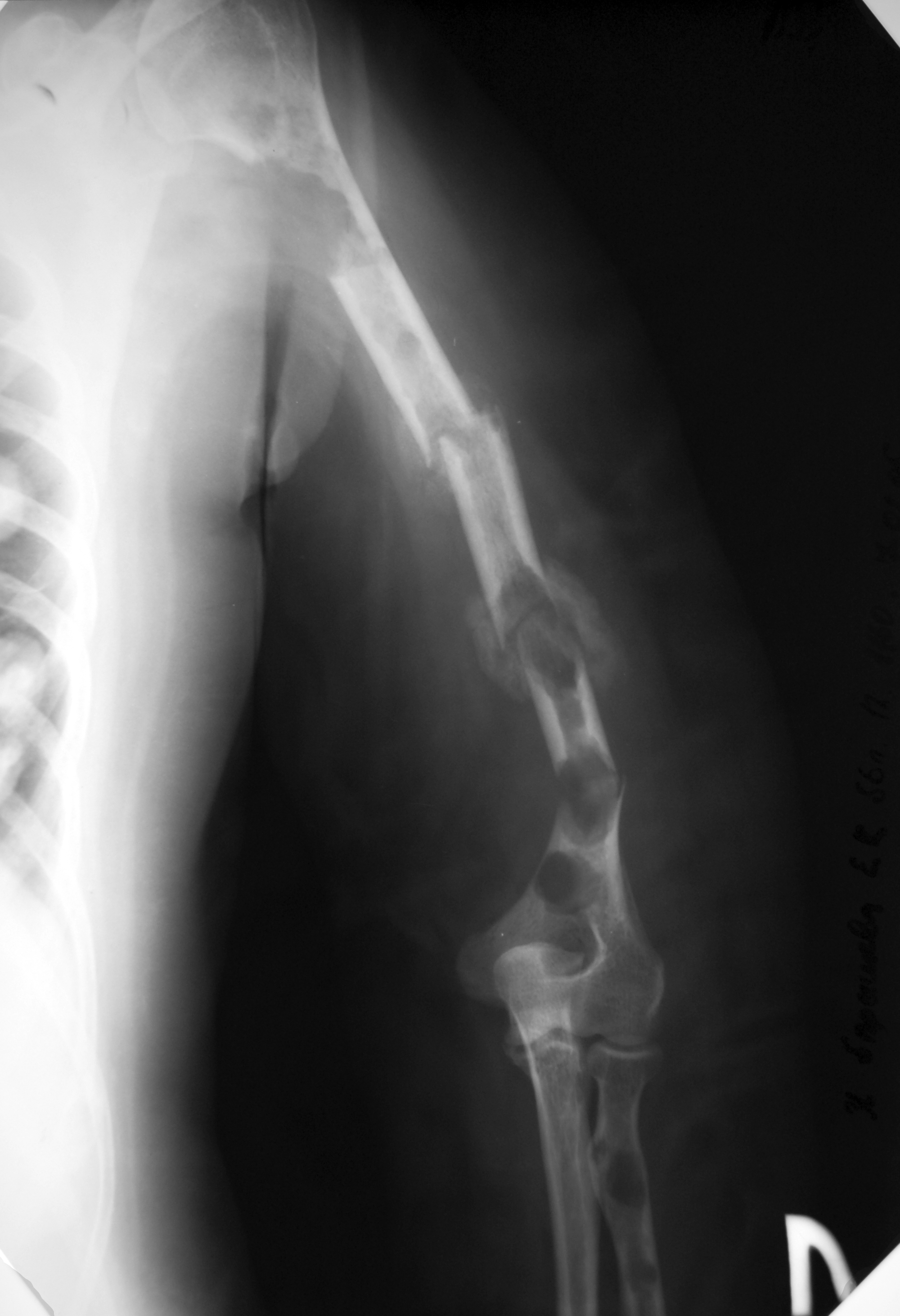

Рис.1. Множественные патологические переломы трубчатых костей
у больного множественной миеломой.
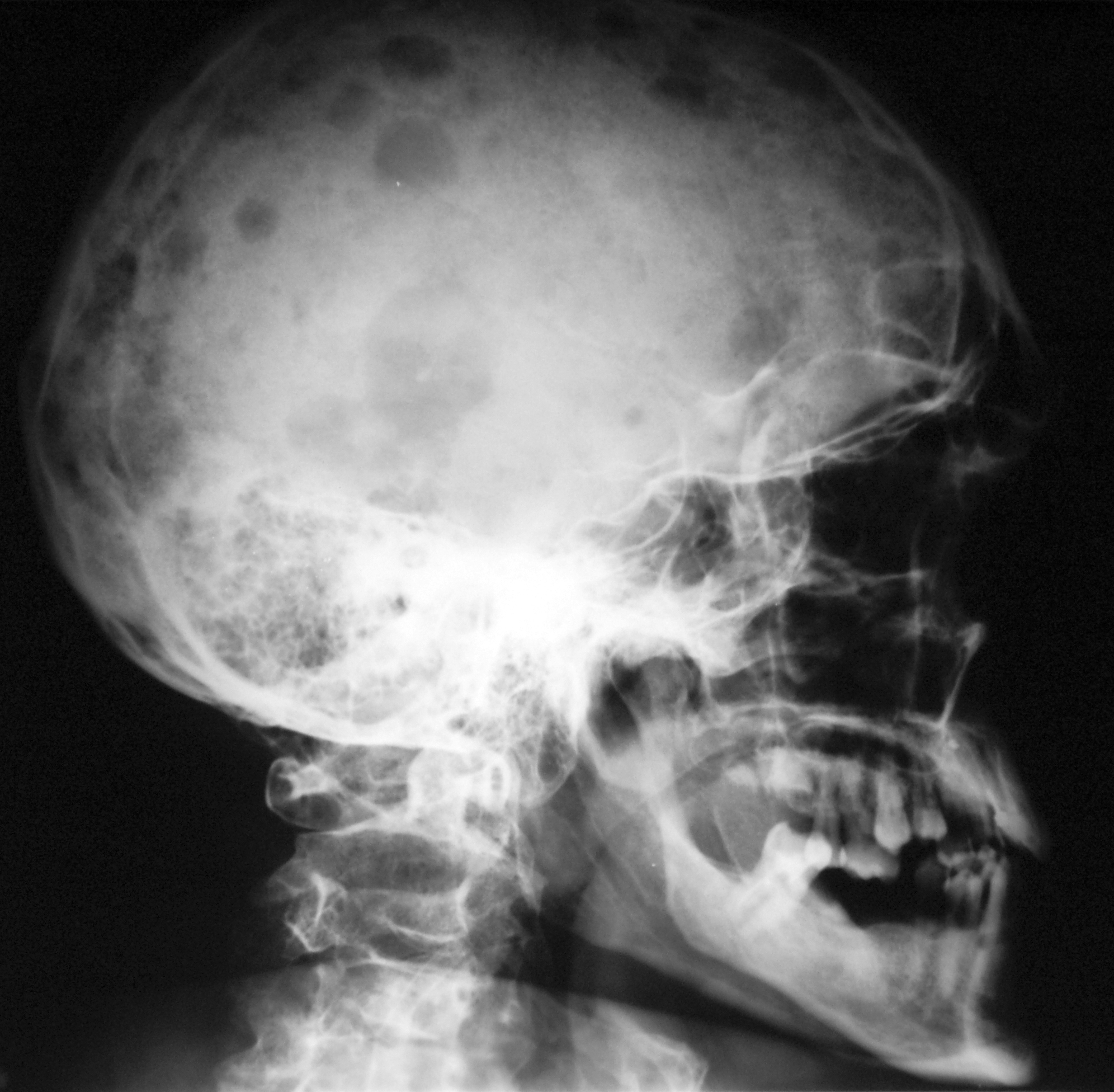

Рис.2. Изменения в костях черепа у больного множественной миеломой.
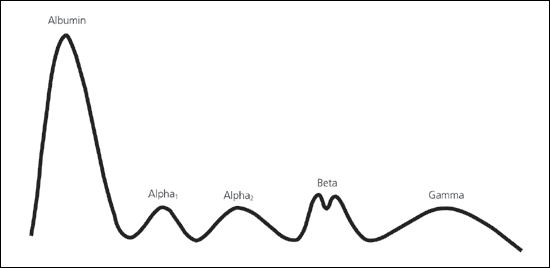
Рис.3а. Электрофорез белков сыворотки крови здорового человека.
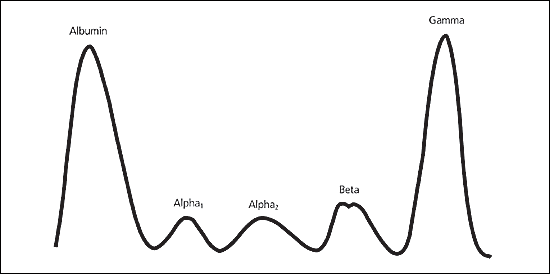
Рис.3 б. Электрофорез белков сыворотки больного множественной
миеломой. М-градиент в γ- фракции.
В комплекс обследования больных ММ входят следующие лабораторные и инструментальные исследования:
- полный клинический анализ крови, СОЭ;
- биохимическое исследование сыворотки крови с оценкой: общего белка и белковых фракций (электрофорез), мочевины, креатинина, мочевой кислоты, кальция, фосфора, натрия, калия;
- определение суточной потери белка с мочой, электрофорез белков мочи;
- общий анализ мочи, определение белка Бенс-Джонса;
- определение клиренса креатинина;
- протромбиновое время, АПТВ (при необходимости – расширенная коагулограмма);
- определение патологического белка в сыворотке крови и моче методом иммунофиксации;
- количественная оценка уровня иммуноглобулинов и легких цепей (κ и λ) в сыворотке крови и моче;
- рентгенологическое исследование всех плоских костей и эпифизов крупных трубчатых костей, компьютерная томография (КТ), магнитно-резонансная томография (МРТ), позитронно-эмисионная томография с 18-фтордезоксиглюкозой (ПЭТ) костей скелета, денситометрия костей при диффузном остеопорозе;
- аспирационная биопсия костного мозга, трепанобиопсия костного мозга;
- СРБ, β2-микроглобулин, интерлейкин 6, лактатдегидрогеназы (ЛДГ) в сыворотке крови;
- цитогенетическое исследование клеток костного мозга (по возможности FISH– исследование (флюоресцентная in situ гибридизация) и молекулярно-генетические методы исследования для выявления реаранжировки генов, ответственных за синтез иммуноглобулинов);
- иммунофенотипирование клеток крови и костного мозга с целью выявления циркулирующих в крови моноклональных В-лимфоцитов (предшественников плазматических клеток) или моноклональных плазматических клеток в костном мозге с фенотипом CD38+, CD19-, CD138+.
- определение белков теплового шока (Hsp90, Hsp70);
- биопсия слизистой рта, прямой кишки, почки при подозрении на амилоидоз.
При оценке клинического анализа крови больного ММ обращает на себя внимание высокие показатели СОЭ, анемия. Анемия чаще нормохромная, нормоцитарная с низким содержанием ретикулоцитов в крови. Гораздо реже у больных ММ может быть выявлена тромбоцитопения, лейкопения и нейтропения. Возможно выявление единичных плазматических клеток и крайне редко – плазмобластов. Именно высокая СОЭ у 70% больных является основанием для комплексного обследования больного ММ и часто опережает клинические симптомы заболевания.
Обычно у больных ММ выявляется увеличение в сыворотке крови IgG > 35 г/л, IgA > 20 г/л и/или увеличение κ или λ легких цепей в суточной порции мочи более 1 г, но большую диагностическую значимость имеет доказательство моноклональности патологического белка. При исследовании биохимических показателей крови выявляется увеличение общего белка за счет глобулиновой фракции (часто в сочетании с гипоальбуминемией) и появление М-компонента на электрофореграмме белков (рис 3). При поражении почек у больных ММ выявляется увеличение уровня креатинина. Уровень мочевой кислоты в сыворотке крови повышается в активной фазе заболевания, а также на фоне лечения. При исследовании электролитов часто выявляется гиперкальциемия, гиперфосфатемия, гипонатриемия, гипо- или гиперкалиемия.
Изменения в коагулограмме обычно обусловлены нарушениями белковосинтетической функции печени и выраженным увеличением моноклонального белка в сыворотке крови с развитием синдрома гипервязкости. В этом случае наблюдается гипокоагуляция. Проведение лечения большими дозами дексаметазона, талидомидом, ревлимидом сопровождается развитием гиперкоагуляционного синдрома и риском развития артериальных и венозных тромбозов.
В активной фазе заболевания у больных ММ отмечается увеличение уровня СРБ, β2-микроглобулина, интерлейкина 6, лактатдегидрогеназы в сыворотке крови. Величина этих показателей ассоциирована с опухолевой массой и может быть использована для стадирования заболевания и оценки эффективности лечения.
Отдельно следует остановиться на цитогенетических методах исследования при ММ. Хотя множественная миелома – клональное заболевание, хромосомные нарушения при использовании стандартных методов цитогенетического исследования выявляются только у 20-60% больных на ранних этапах заболевания и у 50-90% больных с III стадией заболевания. Наибольшую информативность имеет метод флюоресцентной in situ гибридизации (FISH) c флюоресцентным окрашиванием цитоплазматических иммуноглобулинов (cIg FISH или FICTION), который выявляет аномалии в 89% случаев. Специфические изменения кариотипа включают количественные и структурные нарушения кариотипа. Наиболее часто у больных ММ выявляется моносомия 13 хромосомы ( или потеря части 13 хромосомы), более редко – моносомия Х, У, 14, 8 хромосом и трисомия или тетрасомия 9 хромосомы, более редко – 3, 19, 15, 11, 7, 5, 18, 21 хромосом. Структурные изменения хромосомного аппарата у больных ММ схожи с изменениями при других лимфопролиферативных заболеваниях. Изменения в области региона 14q (switch-регион Н-цепи Ig) связаны с транслокациями t(11;14)(q13;q32), t(8;14)(q24;q32), t(14;18)(q32;q21); изменения в области региона 16p или 16q – c транслокациями t(1;16)(p11;p11), t(1;16)(p10;p10). Кроме того, возможны структурные изменения в области 1p или 1q (частичная делеция, трисомия), 19q13 или 19р13, 6q, 17q, 17p, 2p12, 22q11, 7q. Цитогенетическое исследование при ММ имеет принципиальное значение, так как позволяет формировать группу риска и выбирать оптимальный подход к лечению. Кроме того, цитогенетическое исследование и FISH используются для диагностики и лечения резидуальной болезни у больных ММ.
Учитывая полиморфность клинических проявлений и течения описываемой патологии, в настоящее время разработаны строгие диагностические критерии множественной миеломы (симптоматической миеломы), индолентной (тлеющей) миеломы, солитарной плазмоцитомы, МГНЗ. Эти критерии основываются на лабораторно-инструментальных данных. Однако необходимость комплексного обследования больных определяется клиническими проявлениями заболевания, которые зависят от особенностей течения и стадии множественной миеломы.
