
- •I. Мембраны
- •II. Строение, свойства и функции белков. (7)
- •III. Строение и функции ферментов. (5)
- •Простетические группы (фад, фмн, биотин, гем)
- •Коферменты (над, надф, кофермент а, атф)
- •Нуклеиновые кислоты и матричные биосинтезы. (6)
- •Регуляция экспрессии генов
- •Регуляция экспрессии генов у прокариот
- •Регуляция экспрессии генов у эукариот
- •Энергетический обмен (4)
- •VI. Обмен и функции углеводов (8)
- •VII. Обмен и функции липидов. (8)
- •Биологически активные вещества. Интеграция метаболических процессов (4)
VII. Обмен и функции липидов. (8)
33. Классификация и функции липидов.
Липиды –это класс органических соединений, представляющих собой эфиры многоатомных или сложнопостроенных спиртов и высших жирных кислот. Липиды нерастворимы в воде (гидрофобны), но хорошо растворимы в органических растворителях.
По строению липиды разделяют на две группы:
-
Простые липиды
-
Сложные липиды.
К простым липидам относят сложные (жир и масло) или простые (воск) эфиры высших жирных кислот и спиртов.
Сложные липиды имеют в своем составе соединения, содержащие атомы азота, серы, фосфора. В эту группу относят фосфолипиды. Они представлены фосфотидной кислотой, которая содержат только фосфорную кислоту, занимающую место одного из остатков жирных кислот, и фосфолипидами, в состав которых входят три азотистых основания. Азотистые основания присоединяются к остатку фосфорной кислоты у фосфотидной кислоты.
Сложные липиды содержат остатки углеводов – гликолипиды, остатки белков – липопротеиды, спирт сфингозин (вместо глицерина) содержат сфинголипиды. Гликолипиды выполняют структурные функции, входят в состав клеточных мембран, в состав клейковины зерна. Чаще всего в составе гликолипидов встречаются моносахариды D- галактоза, D – глюкоза.
Липопротеиды входят в состав клеточных мембран, в протоплазму клеток.
Сфинголипиды участвуют в деятельности центральной нервной системы. При нарушении обмена и функционирования сфинголипидов развиваются нарушения в деятельности центральной нервной системы.
Функции:
-
Структурная - построение мембран клеток всех органов и тканей.
-
Энергетическая функция – при расщеплении выделяется энергия.
-
Регуляторная: некоторые липиды являются гормонами.
-
Источник воды: при окислении липида выделяется вода.
-
Каталитическая: жирорастворимые витамины – кофакторы ферментов, не обладают активностью сами по себе.
34. Переваривание и всасывание липидов в желудочно-кишечном тракте.
В составе животных жиров с организм поступают жирорастворимые витамины А, Д, Е, К, в составе растительных жиров – F.
В желудке переваривание начинается ферментом липазой, которая гидролизует эмульгированный жир. Однако в желудке pH невелик, по сравнению с необходимой для активности липазы. Липаза относительно стойкая к воздействию кислоты, в желудке происходит умеренное расщепление некоторого количества триглицеридов.
В кишечнике – в двенадцатиперстной кишке пища подвергается действию желчи и сока поджелудочной железы: происходит эмульгирование жиров.
Из поджелудочной железы в двенадцатиперстную кишку поступает главный фермент процесса переваривания жиров – панкреатическая липаза. Он вместе с другими ферментами расщепляет пищевые липиды на простые соединения (триглицериды, глицерол, свободные жирные кислоты), а фосфолипиды – на их первичные компоненты.
Во время нахождения перевариваемой пищевой массы в среднем отделе тонкой кишки происходит всасывание образовавшихся из пищевых жиров глицерола и жирных кислот. Получившиеся вещества всасываются непосредственно в кровоток или лимфатическую систему.
35. Система транспорта липидов в крови.
Липиды транспортируются в водной фазе крови в составе особых частиц – липопротеинов. Поверхность частиц гидрофильна и сформирована белками, фосфолипидами и свободным холестеролом. Триацилглицеролы и эфиры холестерола составляют гидрофобное ядро.
Белки в липопротеинах обычно называются апобелками, выделяют несколько их типов – А, В, С, D, Е. В каждом классе липопротеинов находятся соответствующие ему апобелки, выполняющие структурную,ферментативную икофакторную функции.
Липопротеины различаются по соотношению триацилглицеролов, холестерола и его эфиров, фосфолипидов и как сложные белки состоят из четырех классов.
-
хиломикроны (ХМ)
-
липопротеины очень низкой плотности
-
липопротеины низкой плотности
-
липопротеины высокой плотности
Хиломикроны и ЛПОНП ответственны, в первую очередь, за транспорт жирных кислот в составе триглицеролов. Липопротеины высокой и низкой плотности – за транспорт холестерола и жирных кислот в составе эфиров ХС.
-
Депонирование и мобилизация жиров.
Адипоциты (место депонирования жиров) располагаются в основном под кожей, образуя подкожный жировой слой, и в брюшной полости. Мобилизация жиров, т.е. гидролиз до глицерола и жирных кислот, происходит в постабсорбтивный (более 2 часов после приема пищи) период, при голодании и активной физической работе. Гидролиз внутриклеточного жира осуществляется под действием фермента гормончувствительной липазы - ТАГ-липазы. Этот фермент отщепляет одну жирную кислоту у первого углеродного атома глицерола с образованием диацилглицерола, а затем другие липазы гидролизуют его до глицерола и жирных кислот, которые поступают в кровь. Глицерол как водорастворимое вещество транспортируется кровью в свободном виде, а жирные кислоты (гидрофобные молекулы) в комплексе с белком плазмы.
Депонирование жира в адипоцитах в абсорбтивном (период 1-2 часов после приема еды) периоде. После еды при повышении концентрации глюкозы в крови увеличивается секреция инсулина. Инсулин активирует транспорт глюкозы внутрь адипоцитов, действуя на ГЛЮТ-4 (инсулинзависимый белок-переносчик глюкозы, осуществляет перенос глюкозы, посредством облегчённой диффузии через клеточную мембрану под контролем инсулина.), и синтез ЛП-липазы в адипоцитах и её экспонирование на поверхности стенки капилляров. ЛП-липаза, связанная с эндотелием сосудов, гидролизует жиры в составе ХМ и ЛПОНП. АпоС-II на поверхности ХМ и ЛПОНП активирует ЛП-липазу. Жирные кислоты проникают в адипоцит, а глицерол транспортируется в печень. Так как в адипоцитах нет фермента глицеролкиназы, то свободный глицерол не может использоваться для синтеза ТАГ в этой ткани. Активированные жирные кислоты взаимодействуют с глицерол-3-фосфатом, образующимся из дигидроксиацетонфосфата, и через фосфатидную кислоту превращаются в ТАГ, которые депонируются в адипоцитах.
-
Окисление жирных кислот. Реакции пути β-окисления
Активация жирных кислот. Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A и ионов Mg2+. Реакция катализируется ферментом ацил-КоА-синтетазой:
![]()
В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты.
Считают, что активация жирной кислоты протекает в 2 этапа. Сначала жирная кислота реагирует с АТФ с образованием ациладенилата, представляющим собой эфир жирной кислоты и АМФ. Далее сульфгидрильная группа КоА действует на прочно связанный с ферментом ациладенилат с образованием ацил-КоА и АМФ.
Транспорт жирных кислот внутрь митохондрий. Коэнзимная форма жирной кислоты, в равной мере как и свободные жирные кислоты, не обладает способностью проникать внутрь митохондрий, где, собственно, и протекает их окисление. Переносчиком активированных жирных кислот с длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. Ацильная группа переносится с атома серы КоА на гидроксильную группу карнитина с образованием ацилкарнитина, который диффундирует через внутреннюю митохондриальную мембрану:
Реакция протекает при участии специфического цитоплазматического фермента карнитин-ацилтрансферазы. Уже на той стороне мембраны, которая обращена к матриксу, ацильная группа переносится обратно на КоА, что термодинамически выгодно, поскольку О-ацильная связь в карнитине обладает высоким потенциалом переноса группы. Иными словами, после прохождения ацилкарнитина через мембрану митохондрий происходит обратная реакция – расщепление ацилкарнитина при участии HS-KoA и митохондриальной карнитин-ацилтрансферазы:
Внутримитохондриальное окисление жирных
кислот. Процесс окисления жирной
кислоты в митохондриях клеткивключает
несколько последовательных
энзиматических реакций.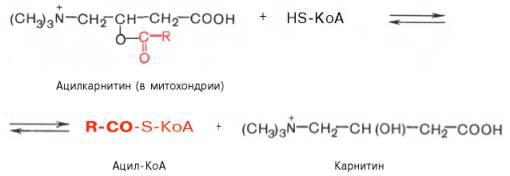
Первая стадия дегидрирования. Ацил-КоА в митохондриях прежде всего подвергается ферментативному дегидрированию, при этом ацил-КоА теряет 2 атома водорода в α- и β-положениях, превращаясь в КоА-эфир ненасыщенной кислоты. Таким образом, первой реакцией в каждом цикле распада ацил-КоА является его окисление ацил-КоА-де-гидрогеназой, приводящее к образованию еноил-КоА с двойной связью между С-2 и С-3:
Существует несколько
ФАД-содержащих ацил-КоА-дегидрогеназ,
каждая из которых обладает специфичностью по
отношению к ацил-КоА с определенной
длиной углеродной цепи.
Стадия гидратации.
Ненасыщенный ацил-КоА (еноил-КоА) при
участии фермента еноил-КоА-гидратазы
присоединяет молекулу воды.
В результате образуется β-оксиацил-КоА
(или 3-гидроксиацил-КоА).
Заметим, что гидратация еноил-КоА стереоспецифична, подобно гидратации фумарата и аконитата.
Вторая
стадия дегидрирования.
Образовавшийся β-оксиацил-КоА
(3-гидроксиацил-КоА) затем дегидрируется.
Эту реакцию катализируют
НАД+-зависимые дегидрогеназы:
Тиолазная реакция. В ходе предыдущих реакций происходило окисление метиленовой группы при С-3 в оксогруппу. Тиолазная реакция представляет собой расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулы КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА.
Например,
при окислении пальмитиновой
кислоты (С16)
повторяется 7 циклов β-окисления.
Запомним, что при окислениижирной
кислоты, содержащей п углеродных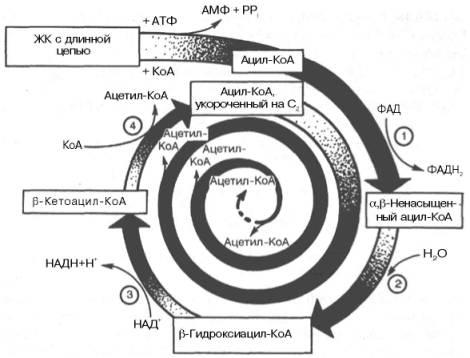
атомов, происходит n/2–1 цикл β-окисления (т.е. на один цикл меньше, чем n/2, так как при окислении бутирил-КоА сразу происходит образование 2 молекул ацетил-КоА) и всего получится п/2 молекул ацетил-КоА. Следовательно, суммарное уравнение β-окисления активированной кислоты можно записать так:
Пальмитоил-КоА + 7ФАД + 7НАД+ + 7Н2O + 7HS-KoA –> 8Ацетил-КоА + 7ФАДН2 + 7НАДН + 7Н+.
Баланс энергии. При каждом цикле β-окисления образуются одна молекула ФАДН2 и одна молекула НАДН. Последние в процессе окисления в дыхательной цепи и сопряженного с ним фосфорилирования дают: ФАДН2 – 2 молекулы АТФ и НАДН – 3 молекулы АТФ, т.е. в сумме за один цикл образуется 5 молекул АТФ. При окислениипальмитиновой кислоты образуется 5 х 7 = 35 молекул АТФ. В процессе β-окисления пальмитиновой кислотыобразуется 8 молекул ацетил-КоА, каждая из которых, «сгорая» в цикле трикарбоновых кислот, дает 12 молекулАТФ, а 8 молекул ацетил-КоА дадут 12 х 8 = 96 молекул АТФ.
Таким образом, всего при полном β-окислении пальмитиновой кислоты образуется 35 + 96 = 131 молекула АТФ. С учетом одной молекулы АТФ, потраченной в самом начале на образование активной формы пальмитиновой кислоты (пальмитоил-КоА), общий энергетический выход при полном окислении одной молекулы пальмитиновой кислоты в условиях животного организма составит 131 – 1 = 130 молекул АТФ.
-
Стероиды. Роль и биосинтез холестерина в организме.
Стероиды — вещества животного или, реже, растительного происхождения, обладающие высокой биологической активностью. В группу стероидов входят:
-
стерины (в частности, холестерин)
-
желчные кислоты,
-
стероидные гормоны,
-
кардиотонические гликозиды

Стероиды имеют циклическое строение:
Холестерин: Холестерин
— важная составная часть клеточных
мембран животных клеток. Суточная
потребность в холестерине (1 г) может
покрываться за счет биосинтеза. При
смешанной диете примерно половина
суточной нормы холестерина синтезируется
в кишечнике, коже и главным образом в
печени (примерно 50%), а остальной холестерин
поступает с пищей. Значительная часть
холестерина включена в липидный слой
плазматических мембран. Большое
количество холестерина расходуется в
биосинтезе желчных кислот, часть
выделяется с желчью. Ежесуточно из
организма выводится примерно 1 г
холестерина. Очень небольшая часть
холестерина используется для биосинтеза
стероидных гормонов. 
Синтез:
1.Образование мевалоната.
Превращение ацетил-КоА в ацетоацетил-КоА и затем в З-гидрокси-З-метилглутарил-КоА соответствует пути биосинтеза кетоновых тел, однако этот процесс происходит не в митохондриях, а в эндоплазматическом ретикулуме. 3-ГМГ-КоА восстанавливается с отщеплением кофермента А с участием 3-ГМГ-КоА-редуктазы, ключевого фермента биосинтеза холестерину. На этом важном этапе путем репрессии биосинтеза фермента (эффекторы: гидроксистерины), а также за счет взаимопревращения молекулы фермента (эффекторы: гормоны) осуществляется регуляция биосинтеза холестерина.
2. Образование изопентенилдифосфата.
Мевалонат за счет декарбоксилирования с потреблением АТФ превращается в изопентенилдифосфат.
3. Образование сквалена.
Изопентенилдифосфат подвергается изомеризации с образованием диметилаллилдифосфата. Обе С5-молекулы конденсируются в геранилдифосфат и в результате присоединения следующей молекулы изопентенилдифосфата образуют фарнезилдифосфат. При димеризации последнего по типу «голова к голове» образуется сквален.
4. Образование холестерина.
Сквален, линейный изопреноид, циклизуется с потреблением кислорода в ланостерин, от которого на последующих стадиях, отщепляются три метильные группы, вследствие чего образуется конечный продукт — холестерин.
39. Синтез жирных кислот
Биосинтез жирных
кислот катализируется синтазой жирных
кислот. Эта ферментная система локализована
в цитоплазме и нуждается в качестве
затравки в ацетил-КоА. В циклической
реакции одна молекула удлиняется
семикратно на С2-звена.
А. Синтаза жирных кислот.
Синтаза жирных кислот позвоночных состоит из двух идентичных пептидных цепей, т. е представляет собой гомодимер. Каждая из двух пептидных цепей, представленных на рисунке в виде половинок шара, может катализировать семь различных реакций ([1]-[7]), из которых складывается синтез пальмитата. Каждая половинка синтазы жирных кислот может связывать субстрат тиолсложноэфирной связью по двум SH-группам: цистеинового остатка и 4'-фосфопантетеиновой группы. Pan-SH, очень похожий на кофермент А, связан с доменом синтазы, который называют ацилпереносящим белком [АПБ (ACP). Эта часть фермента функционирует как "длинная рука", которая фиксирует субстрат и передает его от одного реакционного центра к другому.
Б. Реакции синтазы жирных кислот
Биосинтез пальмитата начинается с переноса ацетильной группы на уже упомянутый остаток цистеина [1] и малонильной группы на 4-фосфопантетеин (Pan-SH) в АПБ [2]. Удлинение цепи происходит вследствие переноса ацетильной группы на углеродный атом С-2 малонильного остатка (голубая стрелка), причем свободная карбоксильная группа отщепляется в виде СО2. Следующие три стадии реакции, а именно восстановление 3-оксогруппы [4], отщепление воды [5] и вновь восстановление [6], приводят к жирной кислоте с четырьмя углеродными атомами. Ацилтрансфераза [1] переносит этот промежуточный продукт на цистеиновый остаток, освобождая Pan-SH для присоединения следующего малонильного остатка. После семи циклов ацил-[АПБ]-гидролаза «опознает» и освобождает конечный продукт — молекулу пальмитиновой кислоты.
40. Происхождение и функции желчных кислот.
А. Холевая кислота: В печени из холестерина образуются желчные кислоты. Эти стероидные соединения с 24 атомами углерода являются производные холановой кислоты, имеющими от одной до трех α-гидроксильных групп и боковую цепь из 5 атомов углерода с карбоксильной группой на конце цепи. В организме человека наиболее важна холевая кислота. В желчи при слабощелочном рН она присутствует в виде холат-аниона.
Б. Желчные кислоты
и соли желчных кислот:
кроме холевой кислоты в желчи содержится
также хенодезоксихолевая кислота. Она
отличается от холевой отсутствием
гидроксильной группы при С-12. Оба
соединения принято называть первичными
желчными кислотами. В количественном
отношении это наиболее важные конечные
продукты обмена холестерина.
Другие две кислоты, дезоксихолевая и литохолевая, называются вторичными желчными кислотами, поскольку они образуются путем дегидроксилирования по С-7 первичных кислот в желудочно-кишечном тракте. В печени образуются конъюгаты желчных кислот с аминокислотами (глицином или таурином), связанные пептидной связью. Эти конъюгаты являются более сильными кислотами и присутствуют в желчи в форме солей (холатов и дезоксихолатов Na+ и К+, называемых солями желчных кислот).
В. Мицеллы: В связи с наличием в структуре α-гидроксильных групп желчные кислоты и соли желчных кислот являются амфифильными соединениями и обладают свойствами детергентов (см. с. 34). Основные функции желчных кислот состоят в образовании мицелл, эмульгировании жиров и солюбилизации липидов в кишечнике. Это повышает эффективность действия панкреатической липазы и способствует всасыванию липидов.
На рисунке показано, как молекулы желчных кислот фиксируются на мицелле своими неполярными частями, обеспечивая ее растворимость. Липаза агрегирует с желчными кислотами и гидролизует жиры (триацилглицерины), содержащиеся в жировой капле.
Г. Метаболические превращения желчных кислот: первичные желчные кислоты образуются исключительно в цитоплазме клеток печени. Процесс биосинтеза (1) начинается с гидроксилирования холестерина по С-7 и С-12, и эпимеризации по C-3, затем следует восстановление двойной связи в кольце В и укорачивание боковой цепи на три углеродных атома.
Лимитирующей стадией является гидроксилирование по С-7 с участием 7α-гидроксилазы. Холевая кислота служит ингибитором реакции, поэтому желчные кислоты регулируют скорость деградации холестерина.
Коньюгирование желчных кислот проходит в две стадии. Вначале образуются КоА-эфиры желчных кислот, а затем следует собственно стадия конъюгации с глицином или таурином (2) с образованием, например, гликохолевой и таурохолевой кислот. Желчь дренируется во внутрипеченочные желчные протоки и накапливается в желчном пузыре (3).
Кишечная микрофлора продуцирует ферменты, осуществляющие химическую модификацию желчных кислот (4). Во-первых, пептидная связь гидролизуется (деконьюгирование), и, во-вторых, за счет дегидроксилирования С-7 образуются вторичные желчные кислоты (5). Однако большая часть желчных кислот всасывается кишечным эпителием (6) и после попадания в печень вновь секретируется в составе желчи (энтерогепатическая циркуляция желчных кислот). Поэтому из 15-30 г солей желчных кислот, ежедневно поступающих в организм с желчью, в экскрементах обнаруживается только около 0,5 г.
При неблагоприятном составе желчи отдельные компоненты могут кристаллизоваться. Это влечет за собой отложение желчных камней, которые чаще всего состоят из холестерина и кальциевых солей желчных кислот (холестериновые камни), но иногда эти камни включают и желчные пигменты.
