
- •I. Мембраны
- •II. Строение, свойства и функции белков. (7)
- •III. Строение и функции ферментов. (5)
- •Простетические группы (фад, фмн, биотин, гем)
- •Коферменты (над, надф, кофермент а, атф)
- •Нуклеиновые кислоты и матричные биосинтезы. (6)
- •Регуляция экспрессии генов
- •Регуляция экспрессии генов у прокариот
- •Регуляция экспрессии генов у эукариот
- •Энергетический обмен (4)
- •VI. Обмен и функции углеводов (8)
- •VII. Обмен и функции липидов. (8)
- •Биологически активные вещества. Интеграция метаболических процессов (4)
II. Строение, свойства и функции белков. (7)
-
Структура аминокислот. Заменимые и незаменимые аминокислоты.
Аминокислоты – сложные органические вещества, состоящие из углеводородного радикала, который может включать серу или фосфор, и двух функциональных групп -NH2 и -COOH.
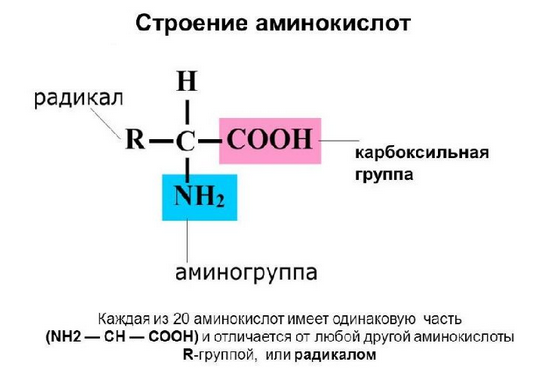
Функции аминокислот в организме
аминокислоты, из которых состоит белок, являются строительным материалом всех структур организма. Каждая в отдельности выполняет свою незаменимую роль
-
синтез белка
-
поддержание активности умственных процессов (аминокислоты выполняют функцию нейромедиаторов, являясь проводниками нервных импульсов)
-
регуляция работы ЦНС (центральной нервной системы)
-
формирование мышечных волокон
-
восстановление тканей и органов после травм
-
являясь основным компонентом ферментов, регулируют обменные процессы в организме (в том числе углеводный и липидный обмены)
-
регулируют гормональный фон
Аминокислоты – кристаллические соединения, растворимые в воде. Они проявляют амфотерные свойства и могут реагировать с неорганическими веществами – кислородом, водой, кислотами, щелочами.
В то время как растения и микроорганизмы могут синтезировать все аминокислоты, млекопитающие в ходе эволюции утратили способность к синтезу примерно половины из 20 протеиногенных аминокислот.
Важные для организма аминокислоты классифицируют на три группы:
-
заменимые – синтезируются внутри организма;
-
незаменимые – не синтезируются в организме;
-
частично заменимые – не синтезируются в организме в большом количестве.
незаменимые аминокислоты не могут образовываться в организме, поэтому поступают к клеткам в готовом виде. Их отсутствие приводит к снижению умственной деятельности, памяти, иммунитета. Так, организм высших организмов не способен синтезировать ароматические аминокислоты (тирозин не является незаменимой аминокислотой только потому, что может образоваться из фенилаланина). К незаменимым аминокислотам принадлежат аминокислоты с разветвленной боковой цепью: валин и изолейцин, а также лейцин, треонин, метионин и лизин.
Заменимые аминокислоты (аланин, аспарагиновая и глутаминовая кислоты и их амиды, аспарагин и глутамин) образуются в результате трансаминирования из промежуточных метаболитов — 2-кетокислот. Пролин синтезируется в достаточных количествах из глутамата, а представители серинового семейства (серин, глицин и цистеин) сами являются естественными метаболитами организма животных.
Частично (не)заменимые аминокислоты синтезируются в организме, но большая их часть попадает в организм в готовом виде вместе с пищей
-
Функции белков.
-
Каталитическая или ферментативная. Все химические превращения в живом организме протекают при участии катализаторов. Биологические катализаторы (ферменты) по химической природе белки, следовательно, катализируют в организме химические превращения, из которых складывается обмен веществ.
-
Транспортная функция. Белки транспортируют или переносят биологически значимые соединения в организме. В одних случаях транспортируемое соединение сорбируется белковой молекулой. Это защищает от разрушения и обеспечивает перенос с током крови . Этот вид транспорта называют пассивным. В других случаях пассивный транспорт сочетается с депонированием (запасанием) тех или иных соединений (например, трансферрин плазмы крови не только переносит железо, но и запасает (накапливает) его при избытке). С помощью мембранных белков переносятся соединения из зон с низкой концентрацией в зону с высокой. Это сопряжено с заметным потреблением энергии и называется активным транспортом (например, транспорт ионов натрия из цитоплазмы и калия в цитоплазму).
-
Механохимическая функция — способность некоторых белков изменять конформацию, т.е. укорачивать или сокращать молекулы. Такие белки называют сократительными (некоторые мышечные белки). Название вытекает из того, что сократительные белки выполняют механическую работу за счет энергии химических связей.
-
Структурная (пластическая) выполняется белками — элементами клеточных мембран (эти белки могут обнаруживать каталитическую или транспортную активность), но главным образом фибриллярными белками. Последние в составе соединительных тканей обеспечивают их прочность и эластичность' кератин шерсти и волос, коллагены сухожилий, кожи, хрящей, стенок сосудов и связывающих тканей.
-
Регуляторная/Гормональная функция (функция управления) реализуется гормонами пептидной или белковой природы. Они, влияя на продукцию или активность белков-ферментов, изменяют скорость катализируемых ими химических реакций
-
Защитная функция белков реализуется антителами, интерферонами и фибриногеном.
В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их.
Антитела — соединения белковой природы, синтез которых индуцируется в процессе иммунного ответа — реакции организма на проникновение во внутреннюю среду посторонних белков или других антигенных компонентов. Антитела, соединяясь с антигеном, образуют нерастворимый комплекс, делая антиген безопасным для организма.
Интерфероны — гликопротеины, синтезирующиеся клеткой после проникновения в нее вируса. вызывают образование внутриклеточных ферментов. Они блокируют синтез вирусных белков, препятствуя копированию вирусной информации. Это приостанавливает размножение вируса.
Фибриноген — растворимый белок плазмы, который на последней стадии процесса свертывания крови трансформируется в фибрин — нерастворимый белок. Фибрин образует каркас тромба, ограничивающего кровопотерю
Плазмин — белок плазмы крови, катализирующий расщепление фибрина. Это обеспечивает восстановление проходимости сосуда, закупоренного фибриновым сгустком.
-
Энергетическая функция белков обеспечивается за счет части аминокислот, высвобождающихся при расщеплении белка в тканях В процессе окислительно-восстановительного распада аминокислоты высвобождают энергию и синтезируют энергоноситель — АТФ. На долю белка приходится около 18% энергопотребления у человека.
-
Структура белка. Связи, характерные для первичной, вторичной, третичной и четвертичной структуры белка.
Молекула белка — неразветвляющийся (линейный) полимер, минимальная структурная единица которого (мономер) представлена аминокислотой. Аминокислоты в молекуле белка соединены карбамидной (пептидной) связью.
Белок может включать несколько полипептидных цепей, соединение которых между собой происходит за счет непептидных связей. В этом случае молекула имеет характер сополимера. Следовательно, белковая молекула — линейный полимер или сополимер, образованный из аминокислот, соединенных пептидной связью.
полипептидная цепь включает в себя соединенные пептидной связью аминокислоты. У одной из аминокислот, занимающей крайнее положение в цепи, остается свободной аминогруппа (C-концевая аминокислота и соответственно N-концевой полюс полипептида), у другой, находящейся на противоположном конце, — свободный карбоксил (С-концевая аминокислота и соответственно С-полюс полипептида). Аминокислотным остаткам в составе полипептида (белка), не имеющим свободного карбоксила, придано окончание «ил», те представленная пептидная цепочка именуется фенилаланил-аланил-аспарагинил-глутаминил-гистидин. При изображении структурных формул пептидов или белков принято располагать слева N-концевую, справа С-концевую аминокислоту
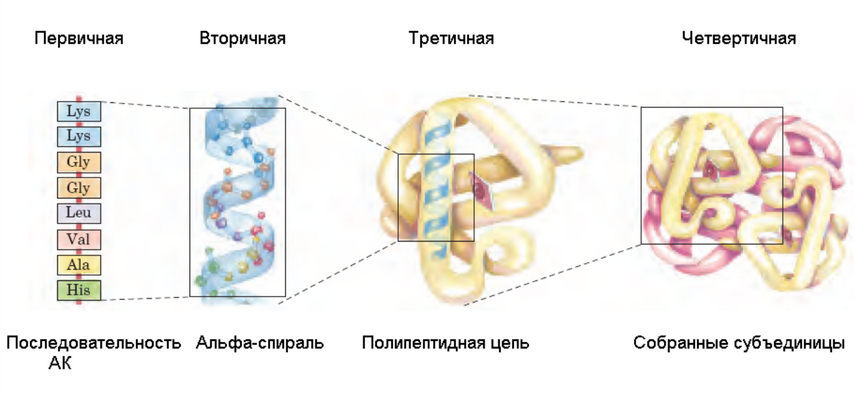
Первичная структура — понятие, обозначающее последовательность аминокислотных остатков в белке.
Пептидная связь — основной вид связи, определяющий первичную структуру. Возможно и присутствие дисульфидных связей между двумя остатками цистеина в одной полипептидной цепи с образованием цистина. Такая же связь (дисульфидный мостик) может возникать и между остатками цистеина, принадлежащими разным полипептидным цепям в белковой молекуле, сополимерном образовании. Изучение первичной структуры требует следующих операций
1) разделение сополимеров-полипептидов путем разрыва дисульфидных связей;
2) разделение цепей и гидролиз до свободных аминокислот;
3) определение аминокислотного состава;
4) определение последовательности аминокислот.
Так, если молекула содержит только 10 видов аминокислот и каждый из них повторяется по 2 раза (всего 20 остатков), то число возможных вариантов белков равно 1020.
Вторичная структура
характеризует
форму белковой цепи в пространстве. Эта
форма изменяется в зависимости от набора
аминокислот и их последовательности
в полипептидной цепи. Различают два
основных варианта вторичной структуры
-спираль
и -
конфигурацию
Форму -спирали имеют многие белки. Представить ее можно как правильную спираль, образованную на поверхности цилиндра. Шаг спирали, т.е. расстояние между витками, — 5,4 А виток образуется 3,6 аминокислотных остатка, т.е. 36 аминокислотных остатков образуют 10 витков спирали. Устойчивость спиралевидной конфигурации определяется многочисленными водородными связями между СО- и NН-группами пептидных связей Конфигурация свойственна небольшому числу белков, в молекуле которых есть более одной полипептидной цепи. В отличие от а-цепей здесь водородные связи образуются между СО- и NН-группами пептидных связей двух полипептидных цепей, расположенных параллельно, но таким образом, что N-концевому полюсу одной цепи соответствует С-концевой полюс другой.
Третичная структура представляет собой более высокий порядок организации белковой молекулы в пространстве. Возникает благодаря изгибам полипептидной цепи (цепей) в участках, содержащих остатки пролина, дикарбоновых и диаминовых кислот. Представить эту конфигурацию можно как спираль, образованную на цилиндре, ось которого периодически меняет направление, что приводит к образованию клубка.
Характер третичной организации устанавливают с помощью рентгеноструктурного анализа. Наиболее полно изучена третичная структура гемоглобина. В этой структуре гидрофильные (полярные) группы располагаются на поверхности молекул, гидрофобные — сближены между собой в ее внутренних областях. Они выполняют важную роль в поддержании третичной структуры, это важнейший вид взаимодействий. Наряду с гидрофобными в сохранении третичной структуры участвуют водородные и электростатические взаимодействия.
Белки по форме клубка делят на две группы: близкие к шару (глобуле) — глобулярные, близкие к вытянутому эллипсу — фибриллярные (нитевидные).
Четвертичная структура. Многие белки образуются путем объединения одинаковых или неодинаковых молекул (субъединиц) в более сложное образование — молекулу с четвертичным уровнем организации (четвертичной структурой). Субъединицы соединяются слабыми связями, которые легко диссоциируют под действием кислых и солевых растворов, мочевины, детергентов с высвобождением субъединиц. Классический пример молекулы с четвертичной структурой — фермент лактатдегидрогеназа, который содержит четыре субъединицы (одинаковые или двух типов).
Интересен белок оболочки вируса табачной мозаики — он состоит из 2130 субъединиц. Форма молекул характеризуется соотношением осей белковой молекулы, которая пространственно представляет собой эллипсоид вращения.
-
Переваривание и всасывание белков в желудочно-кишечном тракте.
Переваривание не относится к процессам метаболизма, поскольку происходит вне организма (по отношению к тканям просвет желудочно-кишечного тракта является внешней средой). Задача переваривания - раздробить (расщепить) крупные молекулы пищевых веществ до маленьких стандартных мономеров, которые всасываются в кровь. Эти вещества, которые получаются в результате переваривания, уже лишены видовой специфичности. Но энергетические запасы, имеющиеся в пищевых веществах, сохраняются, и в дальнейшем используются организмом.
-
Переваривание белков начинается в желудке под действием ферментов желудочного сока. За сутки его выделяется до 2,5 литров и он отличается от других пищеварительных соков сильно кислой реакцией, благодаря присутствию свободной соляной кислоты, секретируемой обкладочными клетками слизистой желудка.
Роль соляной кислоты:
1. денатурирует белки;
2. стерилизует пищу;
3. вызывает набухание труднорастворимых белков;
4. активирует пепсиноген;
5. создает рН-оптимум для действия пепсина;
6. способствует всасыванию железа;
7. вызывает секрецию секретина в двенадцатиперстной кишке.
-
В желудочном соке содержатся протеолитические ферменты пепсин, гастриксин и реннин. Главным из них является пепсин. Он вырабатывается главными клетками слизистой желудка в виде профермента пепсиногена. Активация его осуществляется соляной кислотой (медленная) и аутокаталитически пепсином (быстрая) путем отщепления фрагмента полипептидной цепи с N-конца (частичный протеолиз). При этом происходит изменение конформации молекулы и формирование активного центра. Пепсин действует при значениях рН 1,5–2,5 и является эндопептидазой с относительной специфичностью действия, расщепляющей пептидные связи внутри белковой молекулы.
-
Кроме пепсина в желудочном соке содержится фермент гастриксин, проявляющий протеолитическую активность при рН 3,0–4,0. По-видимому, именно он начинает перваривание белков.
-
Образовавшиеся в результате действия пепсина в желудке полипептиды поступают в двенадцатиперстную кишку, куда выделяется сок поджелудочной железы. Панкреатический сок имеет щелочную реакцию (рН 7,5–8,2), что обусловлено высоким содержанием бикарбонатов. Кислое содержимое, поступающее из желудка нейтрализуется, и пепсин теряет свою активность.
-
В панкреатическом соке содержатся протеолитические ферменты трипсин, химотрипсин, карбоксипептидаза и эластаза, которые вырабатываются также в виде проферментов. Трипсиноген активируется энтерокиназой (вырабатывается клетками слизистой двенадцатиперстной кишки), переходит в активный трипсин, который активирует все остальные ферменты поджелудочного и кишечного сока. Клетки поджелудочной железы защищены от действия протеаз тем, что ферменты желудочного сока образуются в виде неактивных предшественников, а в панкреас синтезируется особый белок-ингибитор трипсина. В полости ЖКТ протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами. Разрушение клеточных белков ферментами желудочного или кишечного сока происходит при язвенной болезни.
-
Переваривание продуктов протеолиза пищевых белков в тонком кишечнике осуществляется с помощью амино-, ди-, и трипептидаз, которые функционируют преимущественно пристеночно.
-
Таким образом, конечными продуктами переваривания белков в ЖКТ являются свободные аминокислоты, которые всасываются.
-
Источники и пути расходования аминокислот в организме.
Основные пути расходования аминокислот:
1) синтез пептидов и белков (основной путь);
2) синтез небелковых азотсодержащих соединений (пуринов, пиримидинов, НАД, фолиевой кислоты, КоА и др.), тканевых биорегуляторов (гистамин, серотонин), медиаторов (норадреналин, ацетилхолин);
3) синтез углеводов (глюконеогенез) с использованием углеродных скелетов аминокислот;
4) синтез липидов с использованием ацетильных остатков углеродных скелетов аминокислот;
5) окисление до конечных продуктов с выделением энергии (рис. 20.4).
Аминокислоты в норме не резервируются (как глюкоза или жирные кислоты) и не выводятся с мочой. Редко аминокислоты используются для энергетических целей как топливные молекулы
Типичные реакции обмена аминокислот
Аминокислоты, не использованные для биосинтетических процессов, подвергаются катаболизму, а из углеродных цепей аминокислот синтезируются вещества, способные резервировать энергию – глюкоза (гликоген) и липиды.
Основное количество аминокислот метаболизируется в печени. Аммиак, образующийся при метаболизме аминокислот, используется для биосинтетических процессов; избыток аммиака выделяется непосредственно или превращается в мочевину или мочевую кислоту в зависимости от организма. Избыток аммиака, образующийся в периферических тканях, транспортируется в печень, где превращается в форму, в виде которой он выводится из организма.
a-Аминокислоты являются бифункциональными соединениями, содержащими аминную и карбоксильную группы. Реакции по этим группам являются общими для различных аминокислот: 1) по аминной группе - реакции трансаминирования и дезаминирования; 2) по карбоксильной группе - реакции декарбоксилирования, образования аминоациладенилатов; 3) реакции по радикалу являются специфичными для каждой аминокислоты.
Для освобождения аммиака аминокислоты подвергаются реакциям трансаминирования с последующим дезаминированием. Аминогруппы аминокислот утилизируются для синтеза мочевины, которая экскретируется как конечный продукт метаболизма белков. Углеродный скелет аминокислот сначала превращается в кетокислоты, которые используются для получения энергии, синтеза глюкозы, кетоновых тел и незаменимых аминокислот.
Трансаминирование
Трансаминирование является первым этапом и основным путем метаболизма аминокислот. Трансаминирование (переаминирование) – реакции межмолекулярного переноса аминогруппы от аминокислоты на a-кетокислоту без промежуточного образования аммиака. Этот процесс открыт в 1937 году Е. А. Браунштейном и М. Г. Крицман. По меньшей мере 11 аминокислот способны вступать в реакции трансаминирования.

1.Реакции трансаминирования являются универсальными у всех живых организмов. Трансаминирование катализируют ферменты аминотрансферазы (трансаминазы). Для каждой пары аминокислоты и кетокислоты существует свой фермент. Аспартатаминотрансфераза (АсАТ) и аланинаминотрансфераза (АлАТ) являются основными трансаминазами.
2. Коферментом трансаминаз является пиридоксальфосфат–производное витамина В6 (пиридоксол, пиридоксин). Пиридоксальфосфат функционирует как переносчик аминогруппы в активном центре трансаминаз. Трансаминазы подвергаются обратимому превращению между альдегидной формой (пиридоксальфосфатом), которая является акцептором аминогруппы, и аминированной формой, пиридоксаминфосфатом, которая является донором аминогруппы на α-кетокислоту.
Ферментысодержатся в цитозоле и митохондриях клеток.
4. Реакции трансаминирования обратимы.
5. Основными кетокислотами, принимающими участие в трансаминировании, являются пируват, оксалоацетат и2-оксоглутарат.
6. Трансаминирование происходит при катаболизме и анаболизме аминокислот и является пунктом "переключения" метаболических превращений. В процессе трансаминирования происходит перераспределение аминогрупп и синтез заменимых аминокислот.
7. Происходит накопление a-аминогрупп в форме одной аминокислоты - глутаминовой кислоты, которая затем подвергается дезаминированию.
1) a-АК + 2-оксоглутарат « a-кетокислота + ГЛУТАМАТ
2) a-АК + оксалоацетат « a-кетокислота + аспартат
аспартат + 2-оксоглутурат « оксалоацетат + ГЛУТАМАТ (АсАТ)
3) a-АК + пируват « a-кетокислота + аланин
аланин + 2-оксоглутарат « пируват + ГЛУТАМАТ (АлАТ)
8. Для лабораторной практики особое значение имеет определение активности АлАТ и АсАТ. Их активность в клетках превышает активность в сыворотке крови. Эти ферменты появляются в сыворотке крови при повреждениях тканей. При поражении сердца преимущественно повышается активность сывороточной АсАТ, а при повреждениях гепатоцитов - АлАТ.
|
|

Значение аминокислот для организма в первую очередь определяется тем, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и внешней средой. Объясняется это тем, что белки входят во все основные структурные компоненты клеток, тканей и органов тела человека и животных, выполняют ферментативные функции, участвуют в переносе веществ через мембраны и т.д. Важную роль в координации работы всех систем клеток играют белковые гормоны. Аминокислоты непосредственно участвуют в биосинтезе не только белков, но и большого количества других биологически активных соединений, регулирующих процессы обмена веществ в организме, таких как нейромедиаторы и гормоны - производные аминокислот. Аминокислоты служат донорами азота при синтезе всех азотсодержащих небелковых соединений, в том числе нуклео-тидов, тема, креатина, холина и других веществ. Катаболизм аминокислот может служить источником энергии для синтеза АТФ. Энергетическая функция аминокислот становится значимой при голодании, некоторых патологических состояниях (сахарный диабет и др.) и преимущественно белковом питании. Именно обмен аминокислот осуществляет взаимосвязь многообразных химических превращений в живом организме. Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 35-65 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг. Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки, за исключением высокоспециализированных (например, эритроцитов), используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов (катехоламинов, гистамина) и других соединений. Какой-либо специальной формы депонирования аминокислот, подобно глюкозе (в виде гликогена) или жирных кислот (в виде триацилглицеролов), не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц, поскольку их больше, чем всех остальных. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
-
Катаболизм углеродного скелета АК. Кетогенные и гликогенные аминокислоты.
Превращение углеродного скелета ак
Азот аминокислот, отщепляемый, как правило, на ранних стадиях катаболизма, включается в общий метаболический пул. В зависимости от потребностей организма он может рсутилизироваться в анаболических процессах или включаться в конечный продукт обмена азота — мочевину и экскретироваться из организма.
Безазотистые углеродные остатки аминокислот образуют кислоты, чаше всего кетокислоты, которые далее деградируют по общим путям катаболизма других окисленных углеводородов
Метаболиты, образующиеся из углеродных скелетов аминокислот, либо непосредственно включаются в цикл трикарбоновых кислот, либо превращаются в пируват и через ацетил-КоА деградируют до образования конечных продуктов — С02 и Н20
Катаболизм аминокислот включает два этапа:
1. дезаминирование, заключающееся в отщеплении аминогруппы с образованием a -кетокислоты
2. катаболизм углеродного скелета, то есть a -кетокислоты.
Катаболизм аминокислот в организме животных происходит в двух различных ситуация. В нормальных условиях, когда в диете присутствует избыточное количество белка, и, следовательно после переваривания и всасывания много аминокислот дезаминируются, а углеродный скелет ( a -кетокислота) или используется для конверсии в запасной жир, или для окисления и извлечения энергии. При голодании разрушаются белки тканей, и получившиеся после дезаминирования кетокислоты могут служить как для глюконеогенеза, так и для окисления.
Дезаминирование - это превращение аминокислот в соответствующие a -кетокислоты в результате отщепления аминогруппы в виде аммиака. Реакция сопровождается окислением, поэтому называется окислительным дезаминированием . Наиболее широко распространенной реакцией является окислительное дезаминирование глутаминовой кислоты, катализируемое NAD-зависимой дегидрогеназой:
|
|
Эта реакция обратима, но ее основная роль заключается в дезаминировании, хотя в некоторых органах она может протекать в сторону синтеза глутаминовой кислоты. В ходе дезаминирования глутамата аминогруппа сразу превращается в ион аммония, поэтому эта реакция называется прямое окислительное дезаминирование . Другие аминокислоты дезаминируются непрямым путем , включающим два этапа:
1. трансаминирование с a -кетоглутаратом с образованием глутамата
2. окислительное дезаминирование глутамата.
|
|
Катаболизм углеродных скелетов , полученных в результате дезаминирования аминокислот, приводит к образованию либо ацетил-СоА , а далее из него жиров или кетоновых тел ( кетогенные аминокислоты ), или образованию метаболитов, способных включаться в глюконеогенез ( гликогенные аминокислоты ) и поддерживать уровень глюкозы в крови при голодании.
Гликогенные и кетонные аминокислоты
В зависимости от потребностей организма безазотистые метаболиты могут включаться в синтез глюкозы (гликогенные аминокислоты) либо в синтез высших жирных кислот (кетогенные аминокислоты).
Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат
Аминокислоты, которые
превращаются в пируват и промежуточные
продукты ЦТК (α-КГ, сукцинил-КоА, фумарат)
и образуют в конечном итоге оксалоацетат,
могут использоваться в процессе
глюконеогенеза. Такие аминокислоты
относят к группе гликогенных аминокислот.

Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными. Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или гликокетогенными
-
Биогенные амины: гистамин, серотонин, катехоламины.
Биогенные амины – это вещества, которые образуются в организме животных или растений из аминокислот и обладают высокой биологической активностью. Выполняют функции гормонов и нейромедиаторов. К биогенным аминам относятся:
-катехоламины (дофамин, адреналин, норадреналинидр.)
-серотонин
-мелатонин
-гистаминидр
Катехоламины – это вещества, которые синтезируются из аминокислоты тирозина.

Синтезируются преимущественно в мозговом слое надпочечников и в нервных окончаниях симпатической нервной системы. Главная функция – помочь организму приспособиться к острым и хроническим стрессам. при многих заболеваниях катехоламины и их метаболиты (метанефрин и норметанефрин) секретируются в большом количестве, эти вещества удобно использовать для диагностических целей
-
адреналин– катехоламин, гормон мозгового вещества надпочечников. Его секреция резко повышается при стрессовых состояниях. Адреналин вызывает спазм сосудов, повышают артериальное давление, стимулирует работу сердца, является гормоном
-
Норадреналин -катехоламин, гормон мозгового вещества надпочечников. Действие сходно с действием адреналина. Обладает большим сосудосуживающим действием. в основном выполняет нейромедиаторные функции.
-
Дофамин - нейромедиатор, а так же гормон, вырабатываемый мозговым слоем надпочечников и другими тканями. Является предшественником норадреналина и адреналина. Участвует в поведенческих реакциях, сне, настроении, внимании, формировании ощущения удовлетворения. Один из «гормонов счастья». возбуждающий медиатор, при его дефиците развивается болезнь Паркинсона
Клиническое значение катехоламинов:
Увеличение концентрации:
-феохромацитома (в 10—100 раз),
-симпатобластома (в 2—10 раз),
-гипертоническая болезньI стадии (в 1,5 – 2 раза),
-гипертонический криз,
-почечная гипертензия,
-гипертензивная форма вегетососудистой дистонии,
-черепно-мозговая и другие виды травм,
-маниакальная стадия маниакально-депрессивного психоза,
-острый период инфаркта миокарда,
-хронический алкоголизм
!Уменьшение концентрации:
-почечная недостаточность
-депрессивнаястадияманиакально-депрессивногопсихоза-миастения-миопатия-гиперкинез
!Определение Допамина имеет особое значение для подтверждения диагноза нейробластомы у детей.
Серотонин– это биогенный амин, один из основных нейромедиаторов.
-при снижении серотонина повышается чувствительность болевой системы организма (даже самое слабое раздражение отзывается сильной болью)
-участвует в регуляции сосудистого тонуса
-снижение уровня серотонина в мозгу приводит к депрессивным состояниям и к тяжелым формам мигрени («Гормон удовольствия»).
Увеличение концентрации серотонина :
-злокачественные новообразования желудка, кишечника и легких (выше нормы 5-10 раз)
-медуллярный рак щитовидной железы,
-острая кишечная непроходимость,
-демпинг- синдром,
-муковисцидоз
-острый инфаркт миокарда.
Снижение уровня серотонина:
-болезньВерльгофа
-лейкозы
-гиповитаминоз В6
-паренхиматозные заболевания печени
-синдром Дауна.
Гистамин – биогенный амин, содержащийся главным образом в базофильных лейкоцитах и тучных клетках. Накопление гистамина в организме может привести к патологическим явлениям.
Гистамин высвобождается из клеток при анафилактических и аллергических реакциях, поэтому он является медиатором гиперчувствительности немедленного типа.
Клиническое использование:
-измерение количества высвобождаемого гистамина при гиперчувствительности немедленного типа
-количество гистамина в моче и плазме крови после проявления аллергической реакции.
Гистамин в пище
Гистамин является одним из биогенных аминов, образующихся в рыбе и некоторых других пищевых продуктах при декарбоксилировании гистидина, в том числе, в результате деятельности бактерий.
Продукты риска:
скумбрия, ставрида, сайра, макрель, тунец, сельдь, шпрот, лосось, сыр, мясо, шампанское, вино, пиво и кислая капуста.
!Уровень гистамина в пище свыше 50 мг/кг считается токсичным.
!Клиническое применение.
Повышенное поступление гистамина может вызвать:
-«гистаминовая» мигрень (синдром Хортона)
-эрозия Желудка
-головная боль
и другие симптомы


