
- •I. Мембраны
- •II. Строение, свойства и функции белков. (7)
- •III. Строение и функции ферментов. (5)
- •Простетические группы (фад, фмн, биотин, гем)
- •Коферменты (над, надф, кофермент а, атф)
- •Нуклеиновые кислоты и матричные биосинтезы. (6)
- •Регуляция экспрессии генов
- •Регуляция экспрессии генов у прокариот
- •Регуляция экспрессии генов у эукариот
- •Энергетический обмен (4)
- •VI. Обмен и функции углеводов (8)
- •VII. Обмен и функции липидов. (8)
- •Биологически активные вещества. Интеграция метаболических процессов (4)
-
Энергетический обмен (4)
-
Цикл лимонной кислоты: локализация, регуляция, функции.
Цикл лимонной кислоты (цитратный цикл, цикл Кребса, цикл трикарбоновых кислот, ЦТК) - заключительный этап катаболизма, в котором углерод ацетильного остатка ацетил-КоА окисляется до 2 молекул СО2. Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ, в результате чего происходят синтез воды и окислительное фосфорилирование АДФ. Связь между атомами углерода в ацетил-КоА устойчива к окислению. В условиях организма окисление ацетильного остатка происходит в несколько этапов, образующих циклический процесс из 8 реакций.
Цикл лиммоной кислоты открыт Х.Кребсом и У.Джонсоном (1937). Этот цикл явлляется основой метаболизма и выполняет две важных функции – снабжения организма энергией и интеграции всех главных метаболических потоков, как катаболических (биорасщепление), так и анаболических (биосинтез).
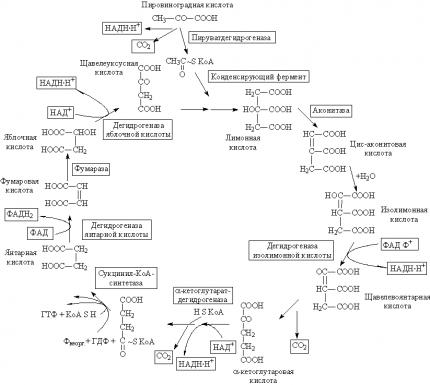
Цикл Кребса состоит из 8 стадий (в двух стадиях на схеме выделены промежуточные продукты), в ходе которых происходит: 1) полное окисление ацетильного остатка до двух молекул СО2, 2) образуются три молекулы восстановленного никотинамидадениндинуклеотида (НАДН) и одна восстановленного флавинадениндинуклеотида (ФАДН2), что является главным источником энергии, производимой в цикле и 3) образуется одна молекула гуанозинтрифосфата (ГТФ) в результате так называемого субстратного окисления.
цикл Кребса, локализованный в митохондриях, начинается с лимонной кислоты (цитрат) и заканчивается образованием щавелевоуксусной кислоты (оксалоацетата – ОА). К субстратам цикла относятся трикарбоновые кислоты – лимонная, цис-аконитовая, изолимонная, щавелевоянтарная (оксалосукцинат) и дикарбоновые кислоты – 2-кетоглутаровая (КГ), янтарная, фумаровая, яблочная (малат) и щавелевоуксусная. К субстратам цикла Кребса следует отнести и уксусную кислоту, которая в активной форме (т.е. в виде ацетилкофермента А, ацетил-SКоА) участвует в конденсации с щавелевоуксусной кислотой, приводящей к образованию лимонной кислоты. Окисляется именно ацетильный остаток, вошедший в структуру лимонной кислоты, подвергается окислению; атомы углерода окисляются до CO2, атомы водорода частично акцептируются коферментами дегидрогеназ, частично в протонированной форме переходят в раствор, то есть в окружающую среду.
Как исходное соединение для образования ацетил-КоА обычно указывается пировиноградная кислота (пируват), образующаяся при гликолизе и занимающая одно из центральных мест в перекрещивающихся путях обмена веществ. Под влиянием фермента сложной структуры – пируватдегидрогеназы (КФ1.2.4.1 – ПДГаза) пирувата окисляется с образованием CO2 (первое декарбоксилирование), ацетил-КоА и восстановливается НАД (см. схему). Однако окисление пирувата – далеко не единственный путь образования ацетил-КоА, который также является характерным продуктом окисления жирных кислот (фермент тиолаза или синтетаза жирных кислот) и других реакций разложения углеводов и аминокислот. Все ферменты, участвующие в реакциях цикла Кребса, локализованы в митохондриях, причем большинство из них растворимы, а сукцинатдегидрогеназа (КФ1.3.99.1) прочно связана с мембранными структурами.
Основная метаболическая роль ЦТК: 1) серия окислительно-восстановительных реакций, в результате которых ацетильная группа ацетил–СоА (в ней 2 атома углерода) окисляется до двух молекул СО2; 2) четырехкратное дегидрирование, ведущее к образованию 3 молекул НАДН+Н+ и 1 молекулы ФАДН2, доставляющих затем атомы водорода в ЦПЭ (цепь переноса электронов, встроенную во внутреннюю мембрану митохондрий, если кто забыл); 3) интегративная функция - цикл является связующим звеном между реакциями анаболизма и катаболизма (то есть реакциями синтеза и распада вещест
Реакции цикла Кребса Все ферменты цикла Кребса локализованы в митохондриях. 1. Цикл лимонной кислоты начинается с взаимодействия ацетил-СоА со оксалоацетатом (ОА или щавелевоуксной кислотой - ЩУК) с образованием цитрил-СоА, гидролиз которого приводит к образованию цитрата (лимонной кислоты). Энергия разрыва тиоэфирной связи идет на образование С-С- связи. Данный процесс катализирует цитратсинтетаза. 2. Под действием фермента цис-аконитазы происходит дегидратация и гидратация лимонной кислоты с образованием изоцитрата (изолимонной кислоты). 3. Изолимонная кислота под действием фермента изоцитратдегидрогеназы дегидрируется с образованием восстановленного NADН+Н+ и декарбоксилируется с образованием альфа-кетоглутаровой килоты. 4. Альфа-кетоглутаровая кислота является субстратом для альфакетоглутаратдегидрогеназной мультиферментой системы, которая работает по принципу пируватдегидрогеназной. Продуктом служит сукцинил-СоА. 5. В составе сукцинил-СоА имеется одна макроэргическая связь, гидролиз которой приводит к образованию ГТФ. Фермент катализирующий этот процесс - сукцинаттиокиназа. 6. Сукцинат (янтарная кислота) под действием фермента сукцинатдегидрогеназы дегидрируется с образованием фумарата (фумаровой кислоты). 7. Фумаровая кислота с отщеплением воды под действием фумаразы образует малат (яблочную кислоту). 8. Малат под действием фермента малатдегидрогеназы переходит в оксалоацетат (щавелевоуксусную кислоту) и цикл возобновляется.
Регуляция цикла трикарбоновых кислот Все реакции ЦТК протекают согласованно в одном направлении. Основное значение для регуляции ЦТК имеет синтез и распад АТФ. Кроме того, важнымрегулятором ЦТК является доступность оксалоацетата. Наличие оксалоацетата вовлекает в ЦТК ацетил-СоА и запускает процесс. Обычно в клетке имеется балансмежду образованием ацетил-СоА (из глюкозы, жирных кислот или аминокислот) и количеством оксалоацетата. Источникомоксалоацетата является глюкоза (синтез из пирувата в анаплеротической реакции), поступление из фруктовых кислот самого цикла (яблочной, лимонной), образование из
аспарагиновой кислоты в результате трансаминирования. Примером существенной роли оксалоацетата служит активация синтеза кетоновых тел и кетоацидоз плазмы крови при недостаточном количестве оксалоацетата в печени. Такое состояние наблюдается при инсулинзависимом сахарном диабете, при голодании, алкогольном отравлении или длительной физической нагрузке.
Входная реакция в цикл - взаимодействие ацетил-СоА с окалоацетатом - важная регуляторная реакция. Ее скорость находится в тесной связи с количеством АТФ (уровень АТФ, в свою очередь, определяется количеством и скоростью окисления НАДН+Н+). Так, при увеличении количества АТФ в клетке происходит уменьшение сродства цитратсинтазы к ацетил-СоА, поэтому скорость синтеза цитарата снижается. Подобным образом уменьшает сродство цитратсинтазы к ацетил-СоА избыток сукцинил-СоА. В зависимости от соотношения изменяется скорость ЦТК: при увеличении соотношения НАДН+Н+/НАД, АТФ/АДФ, Ацетил-СоА/HS-CoA, Сукцинил-СоА/HS-CoA скорость ЦТК замедляется. Цикл Кребса активируется под влиянием катехоламинов, глюкагона и йодтиронинов.
В норме скорости гликолиза и цикла трикарбоновых кислот тесно связаны: в пируват превращается лишь такое количество глюкозы, которое обеспечит цикл достаточным количеством «топлива» — ацетил-СоА. Концентрации пирувата, лактата и ацетил-СоА в норме поддерживаются постоянными. Скорость гликолиза связана со скоростью цикла трикарбоновых кислот не только через ингибирование гликолиза высокими уровнями ATP и NADH+Н+, которое характерно и для гликолиза, и для дыхательного этапа окисления глюкозы, но также и концентрацией цитрата. Цитрат, первый продукт цикла трикарбоновых кислот, является важным аллостерическим ингибитором фосфофруктокиназы.
а каждый цикл с участием одной молекулы ацетил – КоА образуется 3(NADН+Н+), 1 FADН2 и 1 ГТФ (что соответствует 1 АТФ). Так как одна молекула NADН+Н+ в дыхательной цепи дает 3 АТФ, то в сумме получается 9АТФ. Каждая молекула FAD дает 2 АТФ, в сумме 2АТФ. Общий энергетический баланс = 12 АТФ. Энергетическая роль общего пути катаболизма. 1. Окислительное декарбоксилирование 1 молекулы пирувата - 3 АТФ. 2. В ЦТК и сопряженных дыхательных цепях - 12 АТФ (в том числе 1 ГТФ в реакции субстратного фосфорилирования в ЦТК).
Под воздействием ряда важных вспомогательных ферментов некоторые промежуточные продукты цикла лимонной кислоты (α-кетоглутарат, сукцинат и оксалоацетат) могут удаляться из цикла и использоваться в качестве молекул-предшественников аминокислот.
-
Строение митохондрий и организация электрон-транспортной цепи.
За счёт своих довольно крупных размеров органеллы хорошо различимы в световом микроскопе. Максимальная длина – 10 мкм, диаметр не превышает 1 мкм.
Митохондрии присутствуют во всех эукариотических клетках. Это двумембранные органоиды обычно бобовидной формы. Также встречаются митохондрии сферической, нитевидной, спиралевидной формы.
Количество митохондрий может значительно варьировать. Например, в клетках печени их насчитывается около тысячи, а в ооцитах – 300 тысяч. Растительные клетки содержат меньше митохондрий, чем животные.
Каждая митохондрия отделена от цитоплазмы двумя мембранами. Наружная мембрана гладкая. Строение внутренней мембраны более сложное. Она образует многочисленные складки – кристы, которые увеличивают функциональную поверхность. Между двумя мембранами находится пространство в 10-20 нм, заполненное ферментами. Внутри органеллы располагается матрикс – гелеобразное вещество.

|
остав |
Описание |
Функции |
|
Внешняя мембрана |
Состоит из липидов. Содержит большое количество белка порина, который образует гидрофильные канальцы. Вся наружная мембрана пронизана порами, через которые в митохондрию попадают молекулы веществ. Также содержит ферменты, участвующие в синтезе липидов |
Защищает органеллу, способствует транспорту веществ |
|
Кристы |
Располагаются перпендикулярно оси митохондрии. Могут иметь вид пластинок или трубочек. Количество крист варьирует в зависимости от типа клеток. В клетках сердца их в три раза больше, чем в клетках печени. Содержат фосфолипиды и белки трёх типов: – катализирующие – участвуют в окислительных процессах; – ферментативные – участвуют в образовании АТФ; – транспортные – переносят молекулы из матрикса наружу и обратно |
Осуществляет вторую стадию дыхания с помощью дыхательной цепи. Происходит окисление водорода, образование 36 молекул АТФ и воды |
|
Матрикс |
Состоит из смеси ферментов, жирных кислот, белков, РНК, митохондриальных рибосом. Здесь находится собственная ДНК митохондрий |
Осуществляет первую стадию дыхания – цикл Кребса, в результате которого образуется 2 молекулы АТФ |
Главная функция митохондрии – генерация энергии клетки в виде молекул АТФ за счёт реакции окислительного фосфорилирования – клеточного дыхания. Некоторые подобные реакции идут с участием кислорода, а после других выделяется углекислый газ. И реакции эти происходят, как внутри самой митохондрии, то есть в ее матриксе, так и на кристах.
Если сказать иначе, то роль митохондрии в клетке заключается в активном участии в «клеточном дыхании», к которому относится множество химических реакций окисления органических веществ, переносов протонов водорода с последующим выделением энергии и т. д.
Помимо митохондрий в клетках растений присутствуют дополнительные полуавтономные органеллы – пластиды. В зависимости от функционального назначения различают три вида пластид:
хромопласты – накапливают и хранят пигменты (каротины) разных оттенков, придающих окраску цветков растений;
лейкопласты – запасают питательные вещества, например, крахмал, в виде зерён и гранул;
хлоропласты – наиболее важные органеллы, содержащие зелёный пигмент (хлорофилл), придающий окраску растениям, и осуществляющие фотосинтез.
Ферменты транслоказы внутренней мембраны митохондрий осуществляют транспортировку АДФ в АТФ. На головках, что состоят из ферментов АТФазы идет синтез АТФ. АТФаза обеспечивает сопряжение фосфорилирования АДФ с реакциями дыхательной цепи. В матриксе находится большая часть ферментов цикла Кребса и окисления жирных кисло
Организация электронно-транспортной цепи
Электрон-транспортные цепи
АТФ может синтезироваться в любой точке клетки в ходе самых разнообразных реакций. Однако эффективность фосфорилирования наиболее велика при аэробном дыхании, фотосинтезе и хемосинтезе. Эта эффективность достигается с помощью упорядоченного перемещения через мембраны электронов и протонов.
Источником энергии при переносе протонов против градиента концентрации является энергия электронов - поэтому цепи переноса называются электрон-транспортными цепями. Источником энергии для электронов служит энергия света (при фотосинтезе) или энергия химических связей (в остальных случаях).
Источниками электронов (донорами электронов, или восстановителями) служат: вода (при фотосинтезе), сероводород и водород (при бактериальном фотосинтезе), органические вещества (при дыхании и некоторых видах фотосинтеза), неорганические вещества (H2S, S, Fe2+, NH3 - при хемосинтезе). В конце электрон-транспортных цепей электроны поступают на акцепторы. Окончательными акцепторами служат органические вещества (НАДФ - при фотосинтезе), неорганические вещества (NO3-, SO42-, S0, Fe3+ - при хемосинтезе), кислород (при аэробном дыхании).
Свободные протоны образуются при электролитической диссоциации воды, при фотолизе воды (при фотосинтезе), при разложении сероводорода и других веществ (при хемосинтезе и бактериальном фотосинтезе), при разложении органических веществ (при дыхании и некоторых видах фотосинтеза и хемосинтеза).
Важнейшие переносчики протонов и электронов. Атомы водорода, протоны и электроны всегда связаны с неорганическими или органическими переносчиками. Все переносчики делятся на две группы: мембранные и немембранные.
Мембранные переносчики электронов и протонов можно разделить на три большие группы: цитохромы, хиноны и прочие.
Цитохромы - это хромопротеиновые комплексы, простетической группой которых является гем - порфириновое ядро, связанное с атомом железа с переменной степенью окисления: +2 или +3. Одна молекула цитохрома способна принимать или отдавать один электрон. Большинство цитохромов - это малоподвижные молекулы, зафиксированные на одной из сторон мембраны. Хиноны (убихинон в митохондриях; пластохинон и филлохинон в хлоропластах) - это группа коферментов, в основе которых лежит низкомолекулярное органическое вещество, которое называется KoQ (коэнзим Q, или кофермент Q). Особенностью КоQ является способность переносить до двух электронов и до двух протонов. Хиноны свободно перемещаются в толще мембраны. К прочим мембранным переносчикам электронов относятся: флавопротеины (гигантские белки мембран митохондрий), пластоцианин (белок мембран хлоропластов), ферредоксин (железосодержащий белок мембран хлоропластов) и другие.
Важнейшими немембранными переносчиками электронов и протонов являются коферменты НАД, НАДФ и ФАД. Каждый из этих переносчиков способен принимать и отдавать два электрона, а также переносить по одному протону.
Электронтранспортная цепь митохондрий.В рассмотренных реакциях цикла Кребса и при гликолизе молекулярный кислород не участвует. Потребность в кислороде возникает при окислении восстановленных переносчиков НАД-Н и ФАДН2, в которых заключена значительная энергия. Процесс высвобождения энергии, осуществляемый постепенно, заключается в передаче электронов от НАД-Н и ФАДН2 по ЭТЦ митохондрий на свободный кислород, который, таким образом, служит терминальным акцептором электронов. Таким образом, ЭТЦ митохондрий (как и тилакоидов) выполняет функцию окислительно-восстановительной Н+-помпы.
ЭТЦ растений состоит из четырех мультибелковых комплексов и двух небольших компонентов - убихинона и цитохрома с, расположенных как на внутренней мембране митохондрий, так и внутри нее. Комплексы I, III и IV представляют собой пункты сопряжения транспорта электронов с фосфорилированием. Компоненты дыхательной цепи (переносчики электронов) в определенной мере мобильны, поскольку они как бы представляют собой составную часть жидкого липидного бислоя и, по данным Б. Чанса, расположены в определенном порядке.
Следовательно, ЭТЦ представляет сложное образование, состоящее из нескольких десятков белковых молекул и лежащее между метаболитами ЦТК с одной стороны и кислородом воздуха с другой. Белки выполняют в основном структурную функцию, входят в состав сопрягающего фактора, а также являются переносчиками электронов. Простетическими группами белков-переносчиков служит, как отмечалось, наряду с флавином и гемом железо, имеющее переменную валентность и, следовательно, легко переходящее из одной формы в другую. Например, в гемсодержащих цитохромах поступающие к ним по ЭТЦ электроны восстанавливают железо, переводя его из Fe3+ в Fe2+. Каждый такой переносчик находится на несколько более низком уровне восстановленности, чем его предшественник, и в соответствии с этим содержит меньше энергии. Зная окислительно-восстановительный потенциал отдельных компонентов ЭТЦ, их можно расположить в порядке его убывания - от -0,32 у дыхательного субстрата до +0,82 у кислорода.
Электроны скатываются с этой «энергетической» горки благодаря разности потенциалов не сразу, а постепенно, что позволяет, во-первых, избежать неэффективного выброса энергии и, во-вторых, связать энергию в форме химических связей АТФ, образуемых из АДФ и Рн. В этом, по существу, и заключается физиологический смысл транспорта электронов.
-
Механизм сопряжения окисления и фосфорилирования. Разобщение процессов.
Перепад потенциалов от Н2 до О2 составляет 1,24 В, что теоретически достаточно для синтеза 6 молекул АТФ, однако реально синтезируется не более трёх.
SН2 + ½
О2 S
+ Н2О
(окисление)![]()
![]()
3АДФ
+ 3Н3РО4 3АТФ
(фосфорилирование)![]()
АТФ образуется путём присоединения к АДФ остатка фосфорной кислоты. Этот процесс называется фосфорилированием. Таким образом, два процесса: процесс биологического окисления (передача протонов и электронов по дыхательной цепи) и процесс фосфорилирования (образование АТФ) являются сопряжёнными, так как энергия, образующаяся при окислении, используется для фосфорилирования. Поэтому образование АТФ за счёт энергии, выделяющейся при прохождении электронов по дыхательной цепи, называется окислительным фосфорилированием.
Для количественной характеристики сопряжения окисления и фосфорилирования используется коэффициент фосфорилирования – отношение Р/О. Этот коэффициент показывает, какое количество атомов неорганического фосфора поглощается митохондрией при поглощении одного атома кислорода (или при переносе одной пары электронов на кислород).
Расчёты показывают, что для образования одной макроэргической связи АТФ, затраты на которую составляют не менее 40 кДж/моль, требуется перепад окислительно-восстановительных потенциалов между участниками дыхательной цепи примерно в 0,22 В на пару перенесённых электронов. В дыхательной цепи имеются только три участка с разницей о/в потенциалов, достаточной для синтеза АТФ (три участка сопряжения окисления и фосфорилирования):
I – между НАД∙Н2 и ФМН;
II – между цитохромами b и c;
III – между цитохромами a и a3.
На данных этапах выделение энергии достаточно для синтеза АТФ. На остальных этапах перепад о/в потенциалов недостаточен для синтеза АТФ и выделяющаяся энергия (около 40-50%) рассеивается в виде тепла. Таким образом, при прохождении двух электронов по дыхательной цепи, которая начинается НАД-зависимыми дегидрогеназами образуется три молекулы АТФ. В этом случае коэффициент Р/О = 3.
Некоторые субстраты окисления (сукцинат, жирные кислоты) имеют более высокий окислительно-восстановительный потенциал, чем НАД. Поэтому они окисляются не НАД-, а ФАД-зависимыми дегидрогеназами. При окислении таких веществ образуется только две молекулы АТФ, так как пропускается один пункт сопряжения окисления и фосфорилирования. Поэтому коэффициент Р/О = 2.
Приведённые значения коэффициентов фосфорилирования являются расчетными, реальное значение этого коэффициента в физиологических условиях составляет Р/О ≈ 2,5.
Коэффициент Р/О может иметь ещё более низкие значения (Р/О < 2,5), так как в митохондриях иногда происходит разобщение окисления и фосфорилирования. При этом окислительно-восстановительные процессы в дыхательной цепи протекают, но фосфорилирование (синтез АТФ) не происходит, т.е. дыхательная цепь работает как бы на холостом ходу. Вся энергия окисляемых веществ превращается в теплоту. Митохондрии становятся своеобразной клеточной «печкой», производящей теплоту. Это необходимо в тех ситуациях, когда потребность в теплоте для организма больше, чем потребность в АТФ, например, для поддержания температуры тела при охлаждении.
-
Токсичность активных форм кислорода. Свободные радикалы. Перекисное окисление. Механизмы антиоксидантной защиты.
Кислород, необходимый организму для функционирования ЦПЭ (цепь переноса электронов) и многих других реакций, является одновременно и токсическим веществом, если из него образуются так называемые активные формы:
ОН•- гидроксильный радикал;
![]() -
супероксидный анион;
-
супероксидный анион;
Н2О2- пероксид водорода.
Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода. Конечный продукт этих реакций - вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует таким образом цепные реакции окисления. Эти свободнорадикальные реакции окисления могут выполнять полезные функции, например, когда клетки белой крови с участием активных форм кислорода разрушают фагоцитированные клетки бактерий.
в остальных клетках свободнорадикальное окисление приводит к разрушению органических молекул, в первую очередь липидов, и, соответственно, мембранных структур клеток, что часто заканчивается их гибелью. Поэтому в организме функционирует эффективная система ингибирования перекисного окисления липидов.
Утечка электронов из ЦПЭ и непосредственное их взаимодействие с кислородом - основной путь образования активных форм кислорода в большинстве клеток.
Нашу потребность в 02 омрачает тот факт, что это токсичный, мутагенный газ; мы выживаем в его присутствии только потому, что от его вредного воздействия имеем широкий спектр антиоксидантной защиты, которая и позволяют нам его безопасное использование Рацион человека богат антиоксидантами. В основном это растительная пища. Растения синтезируют много антиоксидантов, чтобы защитить себя от высокого уровня 02, который они образуют в процессе фотосинтеза.
Более 80%, потребляемого нами 02 используется в митохондриях, остальной помогает осуществлять полезные метаболические преобразования (см. выше). Тем не менее, небольшой процент потребляемого 02 (1-2%), превращается в активные формы кислорода (АФК). АФК более реактивны, чем сам 02 и способные повреждать биологические молекулы. Некоторые АФК - свободные радикалы, такие как супероксидный радикал (02• - и гидроксильный радикал (ОН•), а другие нет ( табл. 1) .
|
Таблица 1 - Номенклатура активных форм кислорода (АФК) -примеры |
|
|
Свободные радикалы |
Не радикальные АФК |
|
Супероксид O2•- |
Перекись водорода |
|
Гидроксил OH• |
Хлорноватистая кислота (HOCl) |
|
Липидов пероксил, липид-OO• |
Гидроперекись липидов, липид-OOH |
|
Оксид азота, NO• Диоксид азота,NO2•, |
Пероксинит, ONOO- Азотистая кислота, HNO2 |
3)Перекисное окисление липидов (ПОЛ)
Реакции ПОЛ являются свободнорадикальными и постоянно протекают в организме, также как и реакции образования АФК.
В норме они поддерживаются на определенном уровне и выполняют ряд функций:
1. индуцируют апоптоз (запрограммированную гибель клеток);
2. регулируют структуру клеточных мембран и тем самым обеспечивают функционирование ионных каналов, рецепторов, ферментных систем;
3. обеспечивают освобождение из мембраны арахидоновой кислоты, из которой синтезируются биорегуляторы (простагландины, тромбоксаны, лейкотриены);
4. ПОЛ может выступать в качестве вторичного мессенджера, участвуя в трансформации сигналов из внешней и внутренней среды организма, обеспечивая их внутриклеточную передачу;
5. АФК участвуют в клеточном иммунитете и фагоцитозе
В результате ПОЛ происходит преобразование обычных липидов в первичные продукты ПОЛ (гидроперекиси липидов). Это приводит к появлению в мембранах участков («дыр»), через которые наружу выходит содержимое как самих клеток, так и их органелл.
Первичные продукты ПОЛ разрушаются с образованием вторичных продуктов ПОЛ: альдегидов, кетонов, малонового диальдегида, диеновых коньюгатов. Накоплением в крови малонового диальдегида (МДА) объясняется синдром интоксикации, сопровождающий многие заболевания внутренних органов. Реагируя с SH- и СН3-группами белков, МДА подавляет активность цитохром-оксидаз (угнетая тем самым тканевое дыхание) и гидроксилаз. МДА обуславливает также ускоренное развитие атеросклероза.
При взаимодействии МДА с аминогруппами фосфолипидов образуются конечные продукты ПОЛ – Шиффовы основания. Примером этих соединений является пигмент липофусцин, появляющийся на оболочке глаза, на коже с возрастом. Липофусцин представляет собой смесь липидов и белков, связанных между собой поперечными ковалентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, накапливается в клетках, нарушая их функцию.
Негативные последствия активации ПОЛ:
1. Повреждение липидного бислоя мембран, в результате чего в клетки проникает вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению.
2. Преждевременное старение клеток и организма в целом.
3. Взаимодействие высокореактивных продуктов ПОЛ с аминогруппами белков с образованием Шиффовых оснований.
4. Изменение текучести (вязкости) мембран, в результате чего нарушается транспортная функция мембран (функционирование ионных каналов).
5. Нарушение активности мембраносвязанных ферментов, рецепторов.
Активация ПОЛ характерна для многих заболеваний и патологических состояний:
1. атеросклероз и другие сердечнососудистого заболевания;
2. поражения ЦНС (болезнь Паркинсона, Альцгеймера);
3. воспалительные процессы любого генеза;
4. дистрофия мышц (болезнь Дюшенна);
5. онкологические заболевания;
6. радиационные поражения;
7. бронхолегочные патологии.
4) В организме токсическое действие активных форм кислорода предотвращается за счет функционирования систем антиоксидантной защиты. В норме сохраняется равновесие между окислительными (прооксидантными) и антиоксидантными системами. Антиоксидантная система защиты представлена ферментными и неферментативными компонентами.
Антиоксиданты — это молекулы, которые способны блокировать реакции свободнорадикального окисления, восстанавливая разрушенные соединения. Когда антиоксидант отдает свой электрон окислителю и прерывает его разрушительное шествие, он сам окисляется и становится неактивным. Для того чтобы вернуть его рабочее состояние, его надо снова восстановить. Поэтому антиоксиданты, как опытные оперативники, обычно работают парами или группами, в которых они могут поддержать окисленного товарища и быстро восстановить его. Например, витамин С восстанавливает витамин Е, а глютатион восстанавливает витамин С. Самые лучшие антиоксидантные кооперативы содержатся в растениях. Это растительные полифенолы или биофлавоноиды, которые сообща очень эффективно борются со свободными радикалами. Наиболее мощными антиоксидантными системами обладают растения, которые могут расти в суровых условиях, — облепиха, сосна, кедр, пихта и другие. Важную роль в организме играют антиокислительные ферменты. Это супероксиддисмутаза (СОД), каталаза и глютатионпероксидаза. СОД и каталаза образуют антиоксидантную пару, которая борется со свободными радикалами кислорода, не давая им возможности запустить процессы цепного окисления. Глютатионпероксидаза обезвреживает липидные перекиси, обрывая тем самым цепное перекисное окисление липидов. Для работы глютатионпероксидазы необходим селен. Поэтому пищевые добавки с селеном усиливают антиоксидантную защиту организма. Антиоксидантными свойствами в организме обладают многие соединения. Это токоферолы, каротиноиды, аскорбиновая кислота, антиокислительные ферменты, женские половые гормоны, коэнзим Q, тиоловые соединения (содержащие серу), некоторые аминокислоты, белковые комплексы, витамин К и многие другие. Однако несмотря такую мощную антиоксидантную защиту, свободные радикалы оказывают достаточно разрушительное действие на биологические ткани и, в частности, на кожу. Причиной этого являются факторы, которые резко усиливают продукцию свободных радикалов, что приводит к перегрузке антиоксидантной системы и окислительному стрессу. Наиболее серьезным фактором является УФ-излучение.
Ферменты антиоксидантной системы:
супероксиддисмутаза, каталаза, пероксидаза (глутатионпероксидаза), глутатионредуктаза. Наиболее активны эти ферменты в печени, почках и надпочечниках.
Супероксиддисмутазапревращает супероксидные анионы в пероксид водорода:
2О2-+ 2Н+→ Н2О2+ О2
Супероксидисмутаза является мощным ингибитором свободнорадикального окисления в организме, защищающим биополимеры (белки, нуклеиновые кислоты и др.) от окислительной деструкции. Супероксидисмутаза – индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется ПОЛ.
Каталаза катализирует реакцию разложения пероксида водорода:
2Н2О2→ 2Н2О + О2
В клетках каталаза локализована в пероксисомах, где образуется наибольшее количество пероксида водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва».
Глутатионпероксидаза– важнейший фермент, обеспечивающий инактивацию пероксида водорода и пероксидных радикалов. Он катализирует восстановление пероксидов при участии трипептида глутатиона. SH-группа глутатиона служит донором электронов и, окисляясь образует дисульфидную форму глутатиона:
Н2О2+ 2НS-глутатион → 2Н2О + глутатион-S-S-глутатион
Окисленный глутатион восстанавливается глутатионредуктазой:
глутатион-S-S-глутатион + НАДФН+Н+→ 2 HS-глутатион + НАДФ+
Глутатионпероксидаза в качестве кофермента использует селен. При его недостатке активность антиоксидантной защиты снижается.
Неферментативные антиоксиданты:
Природные водорастворимые антиоксиданты (витамин С; карнозин; таурин; восстановленные тиолы, Во-первых, он восстанавливает окисленную форму витамина Е и поддерживает необходимую концентрацию этого антиоксиданта в мембранах клеток. Во-вторых, витамин С взаимодействует как восстановитель с водорастворимыми активными формами кислорода и инактивирует их.
витамин Е; β-каротин; КоQ; нафтахоиноны Витамин Е – наиболее распространенный антиоксидант в природе, способен инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и тем самым предотвращать развитие цепи перекисного окисления. -каротин, предшественник витамина А, также ингибирует ПОЛ. Уменьшение содержания этого антиоксиданта в тканях приводит к тому, что продукты ПОЛ начинают производить вместо физиологического патологический эффект.
Растительная диета, обогащенная витаминами Е, С, каротиноидами, уменьшает риск развития атеросклероза и заболеваний сердечно-сосудистой системы, обладает антиканцерогенным действием. Действие этих витаминов связано с ингибированием ПОЛ и кислородных радикалов и, следовательно, с поддержанием нормальной структуры компонентов клеток.
