
- •Определение изменения энтропии при плавлении олова
- •Теоретические положения
- •1. Теплоемкость твердых тел
- •2. Плавление и кристаллизация
- •3. Изменение энтропии при плавлении твердого тела.
- •Методика эксперимента
- •Экспериментальная установка.
- •Порядок выполнения работы
- •Результаты эксперимента
- •Контрольные вопросы
- •Библиографический список
3. Изменение энтропии при плавлении твердого тела.
Любое изменение
состояния тела или системы тел можно
представить как результат бесконечно
большого числа бесконечно малых
изменений. При каждом таком бесконечно
малом изменении состояния система либо
поглощает, либо выделяет бесконечно
малое количество теплоты
![]()
Количество теплоты, поглощенное или выделенное системой при переходе из одного состояния в другое, зависит от способа перехода и не является функцией состояния. Но если взять отношение теплоты к тем температурам, при которых она были отдана или поглощена, то окажется, что эти величины, так называемые приведенные теплоты, равны между собой:
![]() . (10)
. (10)
Эта особенность
приведенной теплоты позволяет ввести
особую термодинамическую величину –
энтропию, имеющую фундаментальное
значение в физике. Однозначная функция
состояния, полным дифференциалом которой
является приведенная теплота
![]() ,
называется энтропией:
,
называется энтропией:
![]() . (11)
. (11)
Согласно определению, изменение энтропии при обратимом процессе
![]() (12)
(12)
Каждое состояние системы характеризуется определенным значением энтропии. В любом замкнутом обратимом процессе изменение энтропии равно нулю:
![]() . (13)
. (13)
В термодинамике
доказано, что при необратимом процессе
энтропия системы возрастает:
![]() .
.
Подсчитаем изменение энтропии при необратимом процессе плавления твердого тела. Процесс перехода вещества из твердого состояния в жидкое состоит из двух этапов:
1. Нагревание твердого тела от начальной температуры Т0 до температуры плавления Тпл. При этом
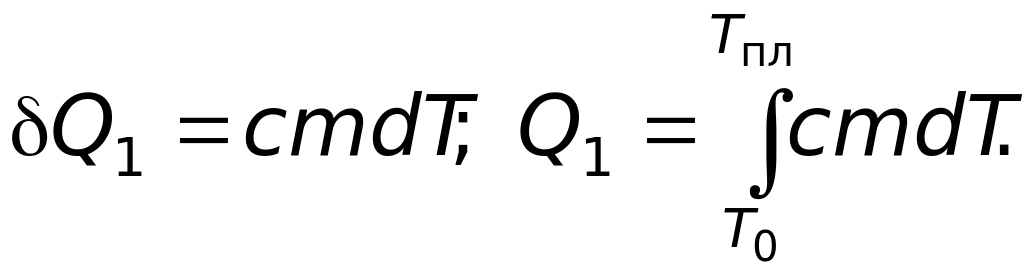 (14)
(14)
Изменение энтропии на этом этапе
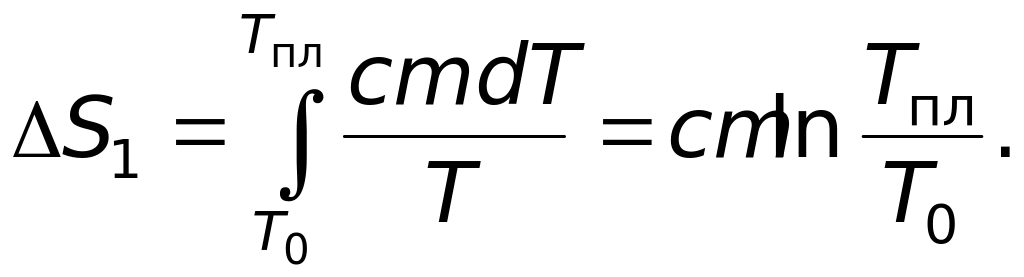 (15)
(15)
2. Плавление тела. Температура остается постоянной (Тпл=const). Количество теплоты, необходимое для плавления:
![]() . (16)
. (16)
Изменение энтропии системы при этом изотермическом процессе
![]() . (17)
. (17)
Поскольку энтропия – величина аддитивная, то полное изменение энтропии системы в процессе плавления
![]() (18)
(18)
Методика эксперимента
В ходе выполнения лабораторной работы изучаются процессы нагрева твердого тела, его плавления, нагрева и охлаждения жидкого олова, его кристаллизация и охлаждение твердого тела. Для первых двух процессов определяется изменение энтропии, а по пято- му – температура плавления олова. Для определения изменения энтропии необходимо опытным путем найти значение удельной теплоемкости в процессе нагрева твердого олова и значение удельной теплоты плавления – в процессе его плавления.
Характеристики исследуемого образца приведены в табл.1.
Таблица 1
Материал |
Масса m, кг |
Температура плавления Тпл.Т, К |
Удельная теплоемкость ст, Дж/кгК |
Удельная теплота плавления Т, кДж/кг |
Олово |
0,150 |
505 |
230 |
59 |
Методика
эксперимента заключается в получении
зависимости температуры исследуемого
образца от времени и построении графика
этой зависимости; в расчетном определении
теплофизических характеристик материала
– удельной теплоемкости и удельной
теплоты плавления. По графику зависимости
температуры от времени определяются
время нагрева t1=![]() t1
образца до температуры
плавления, время плавления
t2
и температура плавления
tпл.
С целью повышения точности температуру
плавления определяем на этапе
кристаллизации, так как эта температура
стабильна в течение всего времени
процесса.
t1
образца до температуры
плавления, время плавления
t2
и температура плавления
tпл.
С целью повышения точности температуру
плавления определяем на этапе
кристаллизации, так как эта температура
стабильна в течение всего времени
процесса.
Получив время нагрева, подсчитаем количество теплоты, выделившейся в нагревателе на первом этапе:
Q3 = UIt1, (19)
где U – |
напряжение, подаваемое на нагреватель; |
I – |
сила тока в нагревателе. |
Но, ввиду неидеальности установки, на нагрев олова пойдет лишь часть этого количества теплоты, остальная передается в окружающую среду. Уравнение теплового баланса для первого этапа:
Q1 = Q3, (20)
где
|
КПД установки (=0,33); |
Q1 – |
количество теплоты, необходимое для нагревания олова от температуры окружающей среды t0 до температуры плавления tпл: |
Q1 = cm(Тпл-Т0). (21)
Подставив выражения (19) и (21) в уравнение (20), получим
cm(Тпл-Т0) = UIt1. (22)
Отсюда выразим теплоемкость:
![]() . (23)
. (23)
Получив по графику момент начала t1 и конца плавления t2, время плавления можно определить по формуле
t2 = t2 – t1. (24)
Количество теплоты, выделившейся в нагревателе на этом этапе:
Q4 = UIt2. (25)
Вследствие потерь на плавление олова пойдет только часть этого количества теплоты – Q2, ее можно определить по формуле (16).
Уравнение теплового баланса для второго этапа:
Q2 = Q4. (26)
Подставив уравнения (16) и (25) в уравнение (26), получим
m= UIt2. (27)
Выразим удельную теплоту плавления
![]() . (28)
. (28)
Получив экспериментальным путем теплофизические характеристики образца, по формуле (18) можно подсчитать изменение энтропии.
