
ТЕМА ЧЕТВЕРТАЯ ДЫХАНИЕ РАСТЕНИЙ
Понятие "дыхание" включает в себя сложный комплекс биологических окислительно-восстановительных процессов, в ходе которых образуется много промежуточных продуктов, необходимых для специфических синтезов органических веществ, характеризующих данный вид растений, освобождается энергия, запасаемая в форме АТФ и градиента электрохимического потенциала.
Внешним наиболее общим проявлением дыхания является поглощение кислорода и выделение С02. Итоговое уравнение:
С6Н1206 + 602 -> 6С02 +6Н20+ 686 ккал
Работа 1. Определение интенсивности дыхания прорастающих семян
ХОД РАБОТЫ
В данном случае интенсивность дыхания определяют по количеству С02, выделенного 100 г сырой навески растительного материала за 1 час. Берут стеклянную банку на 300 мл, закрытую корковой пробкой, с крючком внутри для подвешивания марлевого мешочка с прорастающими семенами. Наливают из герметично закрытого сосуда 25 мл раствора барита - Ва(ОН)2 в концентрации 7 граммов чистого гидрата окиси на 1 л дистиллированной воды, предварительно несколько суток настоянного. В мешочек из марли отвешивают 10 г проросших семян или зеленых органов растений и закрепляют на крючке над раствором барита.
После этого оставляют баночку при комнатной температуре на 20-30 минут. В течение этого времени надо осторожно взбалтывать барит, не обжигая семена, для разрушения образующейся при этом пленки ВаС03, препятствующей полноте поглощения С02. По окончании опыта быстро вынимают мешочек с семенами и титруют этот раствор щавелевой кислотой в присутствии 2Х-3Х капель фенолфталеина до появления исчезающего слаборозового окрашивания (титр Н2С204 -2,8636 г на 1 л дистиллята. 1 мл этого раствора, пошедшего на титрование, как раз соответствует 1 м'г СОг).
Для определения интенсивности дыхания при других условиях параллельно ставят баночки в сосуды с термостатированной водой (Т=+30°С и +4°С - вода со льдом). Одновременно закладывают контрольный опыт с баритом, но без семян. Если анализируются объекты, содержащие хлорофилл, то их на все время опыта помещают в темноту, для исключения фотосинтеза.
Результаты опыта занести в таблицу:
Объект |
Варианты опыта |
Навеска |
Прилито Ва(ОН)2 |
Количество Н2С2О4 при титровании |
Разность при титровании контроля и опыта, мг СОг |
Интенсивность дыхания, мг С02 на 100 г сырого веса в час |
|
|
|
|
|
|
I |
Разность количества мл щавелевой кислоты, пошедшей на титрование контрольной и опытной колб, дает величину С02 в мг, которую выражают на 100 г навески в час.
Вычисления ведут по формуле:
Г1 „ (Амл - Вмл)х 100 г х бОмин
И.Д. = ■ = ... мг выделенного ССК / на 100 г сырой навески/ч
t мин х Д г
где А - количество мл кислоты в контрольном опыте: В - количество мл Н2С204, пошедшей на титрование в опытной банке;
Д - взятая навеска.
Зарисовать установку. Сделать вывод, сопоставив интенсивность дыхания различных объектов в различных условиях.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) баночки на 300 мл; 2) раствор Ва(0Н)2, 3) щавелевая кислота; 4) фенолфталеин, 5) бюретки для титрования; 6) герметичная установка для барита; 7) проросшие семена или зеленые части растений; 8)весы
Работа 2. Определение дыхательного коэффициента
Дыхательным коэффициентом (ДК) называют отношение количества выделенного при дыхании С02 к поглощенному кислороду (С02/02). Величина ДК может зависеть от характера окислительного обмена изучаемого объекта, содержания кислорода в среде. В значительной степени величина ДК'зависит от химической природы окисляемого при дыхании вещества '(субстрата). Если окисляются углеводы, то дыхательный коэффициент близок к 1. Для полного окисления дыхательного субстрата с меньшей степенью окисленности углерода (как, например, белки и жиры) потребуется больше кислорода и ДК будет всегда меньше 1, и наоборот, при окислении субстрата с большей степенью окисленности (например, органические кислоты) ДК будет больше 1.
Рассчитайте и сравните ДК при окислении органических кислот, например пировйноградной, щавелевой, аминокислот, жирны* кислот.
ДК может быть определен любым методом, позволяющим учесть и 02 и С02. ДК прорастающих семян можно определить очень простым методом Рихтера с помощью прибора, состоящего из пробирки с каучуковой пробкой, в которую вставлена изогнутая прд прямым углом капиллярная трубка. К задней стороне трубки прикрепляется полоска миллиметровой бумаги. Пробирка во время опыта должна находиться в термостатических условиях. Для этого ее ставят в ванну с постоянной температурой, при отсутствии ванны ставят в банку с ватой.
ХОД РАБОТЫ
2/3 объема пробирки заполняют проросшими семенами и плотно закрывают ее пробкой с измерительной трубкой. Необходимо как можно меньше нагревать пробирку рукой. После того как пробирку закрыли, ее ставят в условия с постоянной температурой.
После 10-минутного термостатирования в наружный конец измерительной трубки кисточкой вносят большую каплю (так, чтобы она заняла в капилляре 1-1,5 см) вазелинового или другого масла Изменение положения капли в измерительной трубке указывает на изменение объема воздуха в приборе Направление изменений объема воздуха в пробирке зависит от величины ДК исследуемого объекта. Если ДК меньше 1, объем воздуха в пробирке будет уменьшаться, и капля масла будет смещаться в сторону пробирки; при увеличении объема воздуха (если ДК больше 1) движение капли обратное.
После капли от конца капилляра отмечают положение внутреннего мениска капли и засекают время. Через 1-2 минуты вновь отмечают на миллиметровой бумаге положение капли. Так отмечают положение капли через равный промежуток времени 3-5 раз и рассчитывают среднюю скорость движения капли. В случае, когда капля смещается в сторону пробирки, скорость движения капли (А) соответствует разности между объемами поглощаемого кислорода и выделяемого СО2:
А= V -V
о, с.с, (1)
После этого пробирку открывают Из измерительной трубки удаляют масло, для чего к концу трубки, ближнему к пробке, подводят воздух, а к противоположному концу прикладывают кусочек фильтровальной бумаги, который впитывает масло.
Полоску фильтровальной бумаги свертывают в копьцо по диаметру пробирки, держа его пинцетом, смачивают концентрированным раствором КОН и укрепляют его над семенами
Кольцо
хорошо держится на стекле. Необходимо
следить, чтобы щелочь не попадала на
семена, а также, чтобы кольцо не мешало
закрыть пробирку пробкой. Снова вводят
в капилляр каплю вазелинового масла и
определяют скорость (расстояние)
движения капли. Теперь выделяемый
семенами С02
поглощается
щелочью и скорость движения капли (В)
соответствует
объему поглощаемого при дыхании
кислорода:
В
= V
02
Согласно
уравнению (1),
объем
выделенного за единицу времени С02
соответствует
С02
= В - А, следовательно
ДК
может
быть рассчитан по уравнению:
COj
В-А
О,
Ж
Сравнивают
ДК
семян,
у которых в качестве дыхательного
субстрата могут быть использованы
различные вещества. Заполняют таблицу:
Объект
Скорость
движения капли
В-А
ДК
А (без
щелочи)
В (со
щелочью)
отсчеты
среднее
отсчете
среднее
Теоретически
рассчитать ДК
при
окислении С02
и
Н20
какого-либо
жира, например, триолеина с формулой
СэуН^Ое. Сделать вывод о зависимости
ДК
от
природы окисляемых веществ. Нарисовать
прибор.
МАТЕРИАЛЫ
И ОБОРУДОВАНИЕ:
1)
пробирка
с герметичной газоотводной трубкой;
2)
пипетка;
3)
линейка
из миллиметровой бумаги; 4)
прорастающие
семена подсолнечника.
Кольцо
хорошо держится на стекле. Необходимо
следить, чтобы щелочь не попадала на
семена, а также, чтобы кольцо не мешало
закрыть пробирку пробкой. Снова вводят
в капилляр каплю вазелинового масла и
определяют скорость (расстояние)
движения капли. Теперь выделяемый
семенами С02
поглощается
щелочью и скорость движения капли (В)
соответствует
объему поглощаемого при дыхании
кислорода:
В
= V
02
Согласно
уравнению (1),
объем
выделенного за единицу времени С02
соответствует
С02
= В - А, следовательно
ДК
может
быть рассчитан по уравнению:
COj
В-А
О,
Ж
Сравнивают
ДК
семян,
у которых в качестве дыхательного
субстрата могут быть использованы
различные вещества. Заполняют таблицу:
Теоретически
рассчитать ДК
при
окислении С02
и
Н20
какого-либо
жира, например, триолеина с формулой
СэуН^Ое. Сделать вывод о зависимости
ДК
от
природы окисляемых веществ. Нарисовать
прибор.
Объект
Скорость
движения капли
В-А
ДК
А (без
щелочи)
В (со
щелочью)
отсчеты
среднее
отсчете
среднее
МАТЕРИАЛЫ
И ОБОРУДОВАНИЕ
1)
пробирка
с герметичной газоотводной трубкой;
2)
пипетка;
3)
линейка
из миллиметровой бумаги; 4)
прорастающие
семена подсолнечника.
Изучение ферментных систем дыхания
Работа 3. Окислительные ферменты дыхания
Из многих окислительно-восстановительных ферментов,вырабатываемых растениями, в данной работе исследуются только два:
1, Полифенолоксидаза- фермент, повышающий окислительный потенциал молекулярного кислорода, соединяя его с водородом, отщепляемым от полифенолов по схеме: нарисовать
2. Пероксидаза - фермент, активизирующий кислород воздуха окисляющий полифенолы и ароматические амины кислородом в присутствии перекиси водорода, например:
дифенол + Н202 хинон + 2Н20
Обнаружить эти ферменты можно при помощи раствора гваяколовой смолы, которая при окислении активированным (атомарным) кислородом меняет свою окраску из коричневой в синюю Работу удобно проводить на двух срезах исследуемой части растений, нанося на первый срез раствор гваяколовой смолы, а на второй -раствор гваяколовой смолы и перекись водорода. Посинение первого среза свидетельствует о присутствии в клетках полифенолоксидазы, тогда как посинение второго среза есть результат совместного действия двух ферментов: полифенолоксидазы и пероксидаэы или в случае отсутствия в данном объекте первого фермента - одной пероксидазы
ХОД РАБОТЫ
Поместить на тарелку 2 куска исследуемого объекта и облить оба куска одновременно раствором гваяколовой смолы, причем второй срез дополнительно обработать каплей раствора перекиси водорода. Для контроля обработать таким же образом материал, предварительно подвергнутый кипячению. Исследовать несколько объектов, не допуская при этом попадания сока из одного объекта на срез другого.
Результаты занести в таблицу:
Объект |
Посинение при действии |
|||
гваяколовая смола |
гваяколовая смола +NaCI |
гваяколовая смола +Н202 |
гваяколовая смола + H202+NaCI |
|
Картофель сырой |
|
|
|
|
Картофель вареный |
|
|
|
|
Редька |
|
|
|
|
Луковица |
|
|
|
|
Можно ингибировать полифенолоксидазу хлоридами, посыпав поверх среза клубня NaCI или BaCI, KCI, CaCI и т.д. Пероксидаза хлоридами ингибируется в меньшей степени, поэтому при добавлении перекиси водорода на срез, где была нанесена соль и добавлена гваяколовая смола, посинение все же происходит, хотя и менее интенсивно.
В целом данная работа подтверждает теорию А.Н. Баха об активации ферментами-оксидазами 02 воздуха в заключительной стадии дыхания.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) клубни картофеля, корнеплоды редьки, корни хрена и др.; 2) 1%-ный спиртовой раствор гваяколовой смолы; 3) 3%-ный раствор перекиси водорода; 4) тарелки; 5) скальпель.
Работа 4. Обнаружение редуцирующих ферментов при дыхании семян
ХОД РАБОТЫ
10 пророщенных семян гороха очищают от кожуры и разделяют на семядоли. Половину всех семян помещают в колбочку с водой и кипятят в течение 3 минут, считая после закипания, чтобы убить ферменты. Затем обе порции семядолей помещают в две пробирки с раствором
метиленовой синьки и оставляют на несколько минут до посинения поверхности семядолей.
Семядоли отмывают водопроводной водой и заливают дистиллированной водой в пробирке так, чтобы слой воды был выше семян на 2 см, помещают на водяную баню с температурой 30-35°С.
Через несколько минут наблюдают полное исчезновение синей окраски у семядолей, не подвергавшихся кипячению вследствие превращения метиленовой синьки в бесцветное лейкосоединение.
В данном опыте метиленовая синька выступает в роли акцептора водорода.
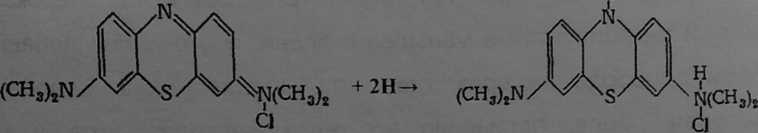
структурная формула восстановленная
метиленовой сини метиленовая синь
(окрашенная, базоформа) (бесцветная, лейкоформа)
Подобный эксперимент можно проводить с зелеными частями высших растений, например, с элодеей, пеларгонией, колеусом и др.
Здесь четко прослеживается взаимосвязь восстановительной активности с возрастом растения.
В практической агрономии этот метод используется для определения жизнеспособности семян и отдельных органов растений, где об этом свидетельствует степень окрашенности (интенсивность) семян метиленовой синью (метод Нелюбова).
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
спиртовка; 2) пробирки; 3) баня; 4) колбочки на 50 мл; 5) раствор метиленовой синьки; 6) семена гороха или фасоли.
Работа 5. Обнаружение дегидрогеназ при спиртовом брожении
В нормальных условиях спиртового брожения образовавшийся в процессе декарбоксилирования пировиноградной кислоты уксусный альдегид
пируватдекарбоксилаза СНз-СО-СООН > СНзСОН +С02
восстанавливается с помощью фермента алкогольдегидрогеназы и ее кофермента НАДН2 в спирт этанол:
алкогольдегидрогеназа СН3СОН + НАДН2 > СН3СН2ОН + НАД
Если ввести второй акцептор водорода, например, метиленовую синь, то последняя, присоединяя водород, будет переходить в лейкосоединение и раствор обесцветится.
ХОД РАБОТЫ
Убедиться в наличии дегидрогеназ при спиртовом брожении можно следующим образом В колбу емкостью 100 мл внести 2 г прессованных дрожжей, прилить 20-30 мл 3%-ного сахара и хорошо взболтать. Затем прилить еще 40-50 мл раствора и снова взболтать. Взять 2 пробирки. Одну из них заполнить почти доверху раствором с дрожжами. Оставшийся раствор в колбе перекипятить в течение 3 минут, остудить и налить во вторую пробирку (контрольную). В обе пробирки внести 3-5 капель раствора метиленовой сини и закрыть ватными пробками. Поместить в водяную баню с температурой около 35°С.
Восстановление метиленовой сини в опытной пробирке начинается через несколько минут и вскоре раствор полностью обесцвечивается (20-25 минут). Раствор в контроле остается без изменения. Если, вынув ватную пробку из опытной пробирки, хорошо взболтать раствор либо продуть воздухом, то синяя окраска снова возвращается вследствие окисления кислородом воздуха образовавшегося лейкосоединения.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) колбы на" 50 мл; 2) 3%-ный раствор сахара 3) прессованные или сухие дрожжи; 4) водяная баня; 5) пробирки-6) спиртовка; 7) метиленовая синь; 8) ватные пробки.
Работа 6. Метод определения активности дегидрогеназ с помощью вакуум-инфильтрации (по Пыльневу)
В основу метода положена способность дегидрогеназ восстанавливать бесцветные соли тетразолия с образованием окрашенного формазана. Бесцветный ТТХ - 2,3,5-трифенилтетразолий хлорид, присоединяя водород, восстанавливается до формазана красного цвета. Формазан нерастворим в воде, но хорошо растворяется в ацетоне или изопропиловом спирте. Метод позволяет работать с малыми навесками материала и выявлять активность дегидрогеназ как бесцветных (что удобнее), так и окрашенных пигментами биологических тканях.
ХОД РАБОТЫ
При работе нужно выбирать однородный материал и разрезать крупные объекты на пластинки толщиной 1,5-2 мм. В маленькие бюксы берут навески по 30-100 мг предварительно разрезанного на пластинки растительного материала. Для навески заливают 5 мл раствора 2,3,5-трифенилтетразолия, приготовленного на буферной смеси; третью (контрольную) погружают в 5 мл чистой буферной смеси. Исследуемый материал сверху придавливают небольшим грузом (стеклянной пробкой) и помещают в вакуум-эксикатор, из которого масляным насосом выкачивают воздух, под давлением которого раствор начинает проникать в ткани. Бюксы закрывают крышками и переносят на 30 минут в термостат с температурой 31 °С, где ткани приобретают красный цвет, интенсивность которого зависит от активности дегидрогеназ.
Затем каждую пробу вынимают из бюкса и тщательно растирают в ступке с небольшим количеством ацетона или изопролилоаого спирта. Содержимое ступки переносят в мерный цилиндр и доводят до 5-10 мл, в зависимости от интенсивности окраски, Остатки измельченной ткани должны полностью обесцветитьоя, После растирания все пробы центрифугируют в течение 3 минут при 1 500 оборотов в минуту и полученный окрашенный формаэаном акстракт сразу колориметрируют на ФЭК при синем светофильтре, Если контрольная вытяжка зеленая, то чтобы снять цвет хлорофилла, колориметрируют при зеленом светофильтре. Активность дегидрогеназ вычисляют по разнице оптической плотности между показаниями ФЭК а опытных и контрольных пробах. Эта разница, выраженная в целых числах, названа индексом активности дегидрогеназ.
Результаты опыта записывают по следующей схеме:
Объект |
Навеска ткани, |
Оптичвоквя плотность |
Индекс |
|
|
мг |
контроль |
опыт |
активности дегидрогеназ |
|
|
|
|
|
Все три выполняемые в практикуме работы (4, 5, в) служат ярким подтверждением теории В,И, Палладина об активации водорода (отщеплении от дыхательного субстрата) в анаэробной стадии дыхания,
МАТЕРИАЛ И ОБОРУДОВАНИЕ
1) проростки злаковых, клубни картофеля или другой растительный материал; 2) 1/15 М буферная смесь Серенсена III с рН 7,17; 3) 2,3,5-трифенилтетразолий хлористый, 0,25-0,5%-иый раствор, приготовленный на буферной смеси Серенсена III; 4) 85%-ный ацетон или изопропиловый спирт; 5) бюкоы; 6) мерные цилиндры на 10 мл; 7) лезвия безопасной бритвы; 8) фарфоровые ступки; 9) весы торзионные или аналитические; 10) вакуум-зксикаторы; 11) насос Камовского; 12) термостат; 13) центрифуга; 14) ФЭК,
Работа 7. Определение активности каталаэы в раотительных объектах
Каталаза - очень распространенный дыхательный фермент присутствующий практически в любом биологическом материал* растений и животных.
В процессе дыхания в качестве побочного продукта окиолания веществ образуется перекись водорода, оказывающая i высоких концентрациях токсичное действие на цитоплазму, Обеэврежимние перекиси происходит при участии фермента каталаэы (одна hi его функций), разлагающей ее на воду и молекулярный кислород по уравнению:
каталаза 2Н202 ► 2Н20+02
Об активности каталаэы судят по объему кислорода, выделяющегося в результате разложения перекиси водорода.
Для определения пользуются прибором, который состоит из каталазника, бюретки емкостью 50 мл и стеклянной груши, соединенных каучуковыми трубками и стеклянным тройником, каучуковпл трубка на конце тройника снабжена винтовым замком, Бюретки и стеклянная груша закреплены на штативе. Их заполняют дистиллированной водой до половины объема.
ХОД РАБОТЫ
0,5 г листьев растирают в фарфоровой ступка о кварцевым пвоком и добавляют 0,5 г мела для создания щелочной реакции (рН»7,7 оптимальная для данного фермента).
Во время растирания вливают небольшими порциями 20 мл воды, смесь вносят в одно колено каталазника. В другое колено помещают 5 мл 3%-ной перекиси водорода. Каталазник соединяют с каучуковой трубкой, не допуская смешивания жидкостей.
Открывают зажим и перемещением воронки устанавливают уровень воды в бюретке на нуле. Закрывают зажим и быстрым изменением положения каталазника смешивают жидкость в обоих коленах. Затем все время потряхивая каталазник по снижению уровня воды в бюретке отмечают объем кислорода в мл, выделенного в течении 3 минут на 1 г массы сырого материала.
Во время опыта каталазник нельзя держать всей ладонью, так как при нагревании от руки воздух в колбе расширяется, что может повлиять на точность отсчета. При отсчете вода в круглой воронке и бюретке должна быть на одном уровне.
Определяют активность каталазы в листьях верхнего и нижнего ярусов. Можно использовать также проростки различных сортов сельскохозяйственных культур, различающихся по скороспелости к неблагоприятным воздействиям.
Результаты опыта заносят в таблицу:
Ярусы листьев на растении |
Навеска листьев, г |
Выделилось 02за3 минуты |
Активность каталазы, мл 02 на 1 г сырого материала |
Верхний |
0,5 |
|
|
Нижний |
0,5 |
|
|
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) растение с несколькими ярусами листьев, проростки пшеницы или другой культуры; 2) промытый речной песок; 3) порошок мела; 4) 3%-ный раствор перекиси водорода; 5) фарфоровые ступки с пестиком; 6) мерные цилиндры на 25 мл; 7) прибор для определения каталазы; 6) часы; 9) весы с разновесами.
Тема пятая минеральное питание растений
Минеральные элементы являются составной частью обмена веществ в растении Роль их многообразна и сводится к включению в состав органических соединений, образующих тело растения, они активируют процессы, входя в состав ферментов, физиологически важных соединений или даже будучи эффекторами отдельны/ ферментативных реакций. Минеральные элементы обеспечивают осмотические процессы клеток, определенное значение рН клетки, электрический заряд мембран, регулируют поступление других элементов и пр. В конечном счете, поэтому минеральному питанию принадлежит решающее место в формировании урожая.
Анализ элементарного состава сухой массы растений показывает, что в среднем они содержат С - 45%, О - 42%, Н - 6,5%, N - 1,5%. Эти четыре элемента, так называемые органогены, в составе золы не присутствуют. Оставшиеся 5% сухой массы приходятся на зольные элементы, среди которых кроме названных по последней информации важную роль играют макроэлементы (содержание их в золе от процентов до сотых долей) - Р, S, К, Са, Mg, Fe, и микроэлементы, содержащиеся в золе от тысячных долей процента до миллионных, к ним относят Мп, Си, Zn, В, Мо. Кроме того, некоторые авторы выделяют и ультрамикроэлементы, содержание которых ниже миллионных долей процента. Их роль до сих пор не выяснена. Элементы относят к необходимым, если без них растение не может закончить нормальный жизненный цикл,
Дополнительно
была выделена группа «полезных» элементов
Nb.
CI,
8i,
Со, которые
могут быть необходимы лишь отдельным
видам растений (например,
Na;
и
CI
- галофитам, Si
- хвощам, Со - бобовым и т.д.)
Особенность минерального обмена растений - накопление элементов в тканях в гораздо более высокой концентрации, чем во внешней среде. Другая особенность - специфичность потребности в элементах, в том числе иногда токсичных для человека (тяжелых металлов, нитратов и др.). В то же время важным является использование растений в фиторемедиации (т.е. в очистке окружающей среды) - разделе науки, которая в настоящее время интенсивно развивается.
Благодаря минеральным элементам синтезируются такие классы соединений как белки, углеводы, жиры, нуклеиновые кислоты, высокоэнергетические биомолекулы и другие вещества, образующие конституцию тела растений, работают электрон-транспортные цели фотосинтеза и дыхания и т.д.
В настоящее время наукой о минеральном питании изучаются механизмы поступления ионов в интактное (целостное) растение, их распределение в органах, исследуется роль и функция элементов, выясняются системы регуляции минерального питания и взаимодействия органов. Доказывается роль корневой системы не только как органа закрепления на субстрате, поглощения элементов, но и как органа синтезирующего ряд специфических веществ (например, алкалоиды и фитогормоны), выделительная функция ее при взаимодействии с другими организмами (фитоалексины) и преобразующими окружающий субстрат (кислые фосфатазы. органические кислоты, фитосидерофоры).
Работа 8. Подача с пасокой аминокислот и амидов, синтезированных корневой системой из поглощенных неорганических соединений азота.
Очень важно и то, что корневая система не только орган поглощения воды и минеральных веществ, но и орган первичного синтеза многих органических соединений, При поглощении из наружной среды минеральных соединений мота (ионов NH и NO3') часть их подается в надземные органы а неизменном виде, но, как впервые доказано ДА. Сабининым, большая часть минеральных соединений азота уже в тканях корня превращается в органические соединения, аминокислоты, амиды, белки. Аминокислоты и амиды подаются в надземные органы, что можно обнаружить, анализируй пасоку растений.
Для работы используют метод определения в растворах суммарной концентрации всех аминокислот и амидов (метод Н.А. Бояркина). Метод основан на сравнении интенсивности окрашивания пятен, полученных на фильтровальной бумаге после реакции с нингидрином стандартных растворов аминокислот и испытуемой пасоки содержащей то или иное количество азотистых соединений. Нингидрин реагирует с большинством а-кислот, дезаминируя и декарбоксилируя их . В результате реакции образуются окрашенные продукты, цвет которых колеблется от сине-фиолетового до розово-фиолетового.
Интенсивность окрашивания пропорциональна концентрации аминокислот.
В качестве стандартных используют два раствора: аланин и глютаминовую кислоту. Алании дает с нингидрином сине-фиолетовое окрашивание, а глютаминовая кислота – розово- фиолетовое.
ХОД РАБОТЫ
1. У 10-15-дневных проростков кукурузы, тыквы или других растений, выращенных на питательной смеси Кнопа, срезают надземные органы. Через короткий промежуток времени на поверхности стебля из порезанных сосудов ксилемы появляются капли пасоки. Алюминиевой петлей их переносят на полоски хроматогрефической бумаги. Можно на пенек плотно надеть стеклянный капилляр, а него поднимется пасока.
2. Приготавливают: а) 0,5%-ный раствор нингидрина в 96%-ном этаноле; б) серию растворов аланина и глютаминовой кислоты с равным содержанием аминогрупп.
Концентрации растворов следующие: глютаминовая кислота: 10 5 2,5 1,25мг/мл аланин: 6,4 3,2 1,6 0,8 мг/мл
3. Из хроматографической бумаги нарезают полоски размером 8*1,5 см. На трех полосках бумаги ставят обычным карандашом 4 точки на расстоянии 1 см друг от друга. Алюминиевой петлей (d=2 мШ) наносят на одну полоску растворы глютаминовой кислоты, на вторую - аланина (разных концентраций), на третью - четыре капли пасоки (пасоку предварительно из капилляра переносят в часовое стекло). Высушивают полоски на воздухе, после чего при помощи ватной кисточки быстрым движением пропитывают их раствором нингидрина. Снова высушивают их на воздухе. Кладут полоски бумаги между двумя стеклами, нагретыми до 40-60°С, и оставляют при этой температуре 3-10 минут. Все операции для полосок с пасокой и для полосок со стандартными растворами должны быть строго одинаковыми.
Сравнение интенсивности окрашивания пятен пасоки с интенсивностью окрашивания пятен стандартных растворов позволяет сделать заключение о суммарной концентрации аминокислот и амидов в пасоке. Пятна сравнивают с пятнами раствора аланина и глютаминовой кислоты в зависимости от оттенка окраски пятен пасоки. Концентрацию аминокислот в пасоке выражают в мг/мл и в мг азота аминогрупп/мл.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) 10-15-дневные проростки кукурузы или других растений; 2) питательная смесь Кнопа; 3) хроматографическая бумага; 4) алюминиевая петля, 5) часовые стекла; 6) 0,5%-ный раствор нингидрина на 96%-ном этаноле; 7) аланин; 8) глютаминовая кислота; 9) стеклянные капилляры.
