
- •Лекция7 Второе начало термодинамики. Энтропия. Тепловой двигатель
- •4.1. II начало термодинамики
- •4.2. Обратимые и необратимые процессы
- •4.3. Круговые процессы. Коэффициент полезного действия тепловой машины.
- •4.4. Энтропия
- •4.5. Примеры вычисления энтропии
- •Энтропия идеального газа.
- •4.6. Цикл Карно
- •4.7. Термодинамическая диаграмма т – s и её применение
- •1) Cвязь между температурой и энтропией идеального газа в четырех простейших его процессах
4.7. Термодинамическая диаграмма т – s и её применение
При изучении термодинамических процессов и некоторых общих вопросов термодинамики широко используется Т — S-диаграмма, в которой по осям абсцисс и ординат отложены соответственно энтропия S и термодинамическая температура Т рассматриваемого тела (системы).
Р ассмотрим
некоторый обратимый процесс, который
в этой диаграмме
изображается линией DE
(рис. ).
ассмотрим
некоторый обратимый процесс, который
в этой диаграмме
изображается линией DE
(рис. ).
![]()
На диаграмме Т — S
- элементарная
теплота
![]() изображается площадью, закрашенной
на рисунке.
изображается площадью, закрашенной
на рисунке.
- количество
теплоты![]() ,
сообщаемое системе в процессе DE,
пропорционально площади фигуры SDDESE
(коэффициент пропорциональности
зависит от выбора масштабов по осям
координат) :
,
сообщаемое системе в процессе DE,
пропорционально площади фигуры SDDESE
(коэффициент пропорциональности
зависит от выбора масштабов по осям
координат) :
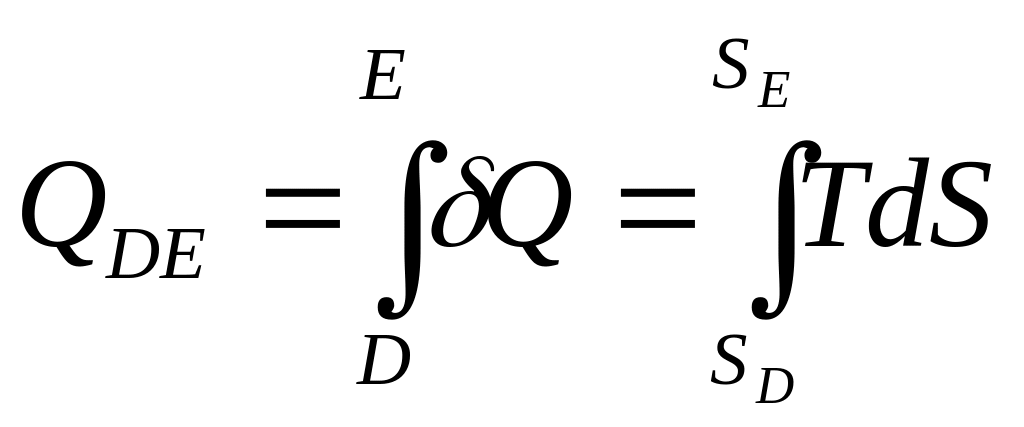
1) Cвязь между температурой и энтропией идеального газа в четырех простейших его процессах
Построим соответствующие им линии в Т — S-диаграмме.
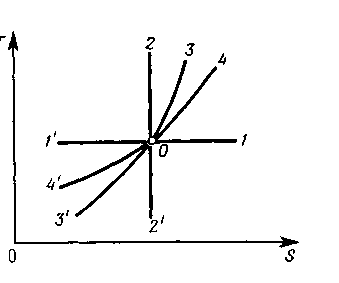 Пусть
Пусть
точка О в диаграмме Т — S изображает начальное состояние идеального газа
прямая 1 – 1/ проходящая через точку О параллельно оси абсцисс, соответствует изотермическому процессу:
0—1 — изотермическое расширение (теплота подводится, так что dS>0),
0—1' - изотермическое сжатие (теплота отводится, так что dS<0).
прямая 2'—2, проходящая через точку О параллельно оси ординат, изображает адиабатный (изоэнтропийный) процесс:
0—2— адиабатное сжатие (dТ>0)
0—2'—адиабатное расширение (dТ<0).
линия 3'—3 - изохорный процесс е:
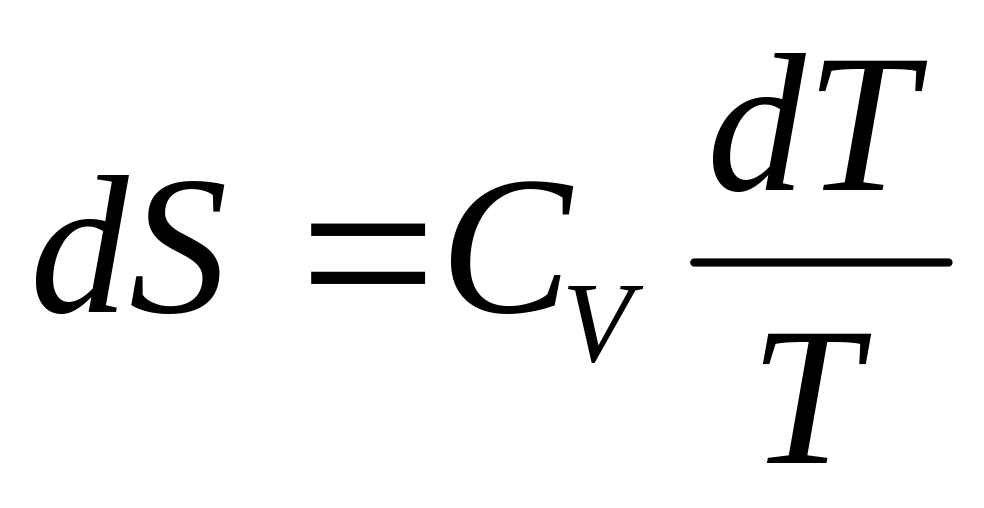
0—3 — изохорное нагревание (dS>0 и dТ>0),
0—3'—изохорное охлаждение (dS<0 и dТ<0).
в конечном изохорном
процессе
![]()
линией 4'—4 - изобарный процесс, так как
 ,
то изобарный
процесс показан,
идущей положе
изохоры З'—З.
,
то изобарный
процесс показан,
идущей положе
изохоры З'—З.
В изобарном
процессе,
![]()
в конечном изобарном
процессе
![]()
-изобарному расширению газа соответствует участок изобары 0—4 (dS>0 и dT>0),
- изобарному сжатию — участок 0—4' (dS<0 и dT<0).
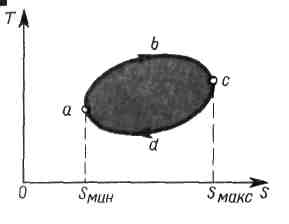
2) На рисунке изображен в Т — S-диаграмме произвольный (обратимый!) прямой цикл abcda.
С
 остояния
а
и
с
соответствуют
наименьшему
(Smin)
и наибольшему
(Smax)
значениям энтропии рабочего тела в
цикле.
остояния
а
и
с
соответствуют
наименьшему
(Smin)
и наибольшему
(Smax)
значениям энтропии рабочего тела в
цикле.в процессе аbс теплота подводится:
 >0
>0в процессе cda — отводится:
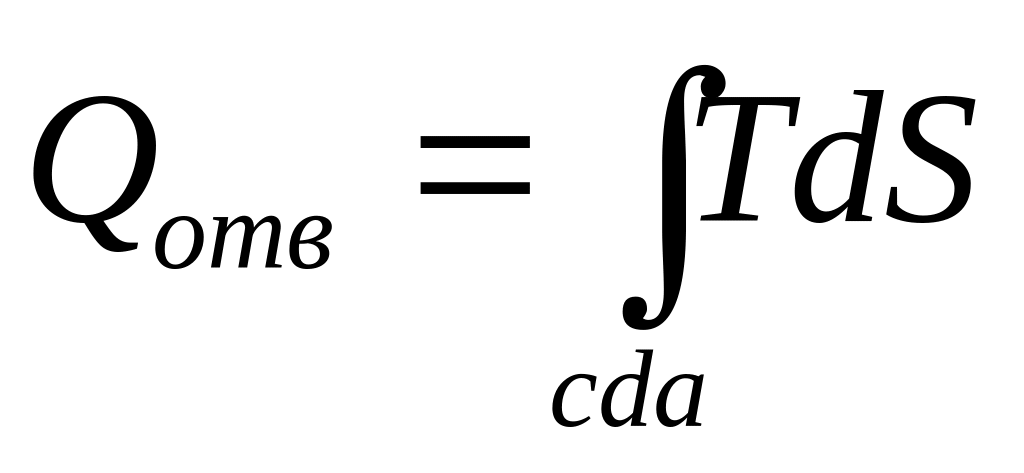 <0.
<0.
Работе за цикл А =
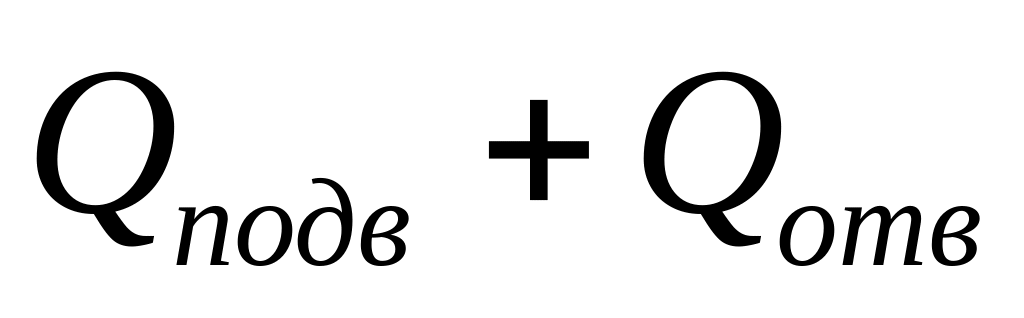 соответствует
площадь цикла,
т. е. площадь, ограниченная замкнутой
кривой abcda
процесса:
соответствует
площадь цикла,
т. е. площадь, ограниченная замкнутой
кривой abcda
процесса:
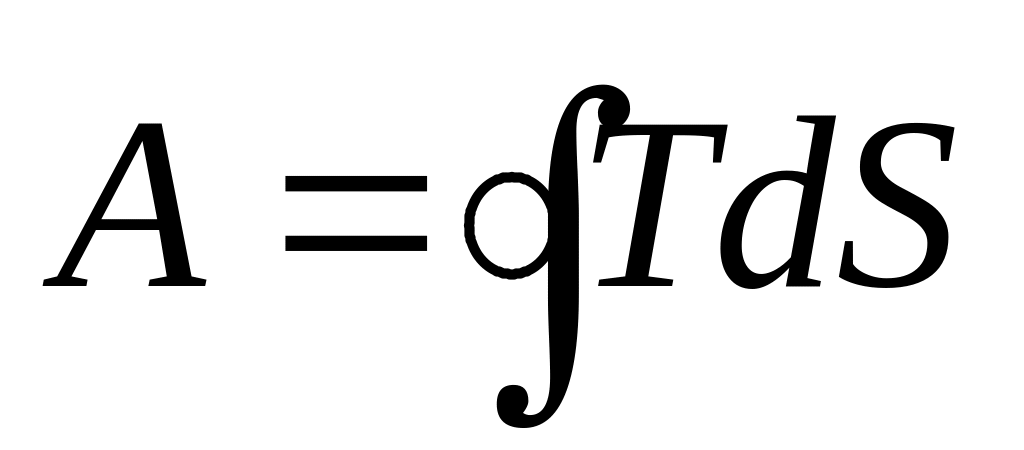 >0
>0Термическому КПД цикла соответствует отношение площади цикла к площади под кривой abc
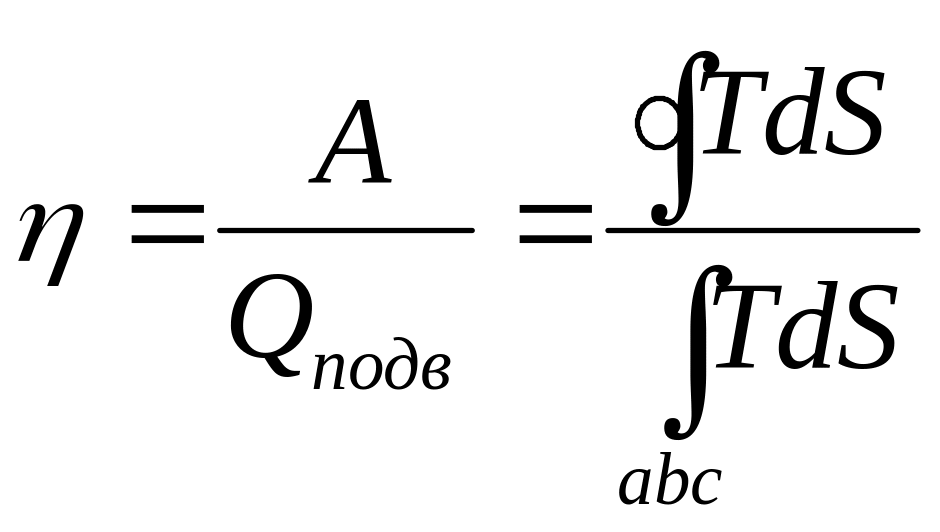
3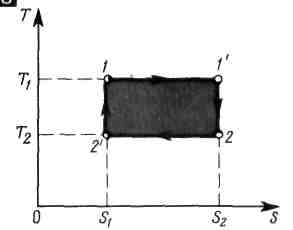 )
Прямой
цикл Карно
независимо от природы рабочего тела
изображается в Т — S-диаграмме
в виде прямоугольника, стороны
которого параллельны осям координат
)
Прямой
цикл Карно
независимо от природы рабочего тела
изображается в Т — S-диаграмме
в виде прямоугольника, стороны
которого параллельны осям координат
Термический КПД цикла Карно не зависит от природы рабочего тела и определяется только температурами нагревателя и холодильника
![]()
Таким образом мы доказали важное положение термодинамики, называемое теоремой Карно:
Теорема Карно и формула служат основанием для установления термодинамической шкалы температур:
![]()
Таким образом, для сравнения температур Т1 и Т2 двух тел нужно осуществить обратимый цикл Карно, в котором эти тела являются нагревателем и холодильником. Отношение температур тел равно отношению абсолютных значений количеств теплоты, отданных или полученных телами в этом цикле. По теореме Карно, химический состав рабочего тела, осуществляющего цикл, не влияет на результаты сравнения температур. Поэтому установленная таким образом термодинамическая шкала температур не связана со свойствами какого-либо определенного термометрического тела. В этом состоит большое достоинство такой шкалы.
Однако вследствие необратимости реальных термодинамических процессов такой способ сравнения температур практически неосуществим и имеет лишь принципиальное значение.
