
- •Термодинамика
- •3.7. Теплоемкость идеального газа. Применение первого начала термодинамики к различным процессам.
- •3.8. Адиабатический процесс
- •3.9. Политропические процессы
- •3.1. Квазистатические и нестатические процессы.
- •3.2. Гипотеза о равнораспределении энергии по степеням свободы
- •3.3. Внутренняя энергия системы.
- •3.4. Работа и теплота.
- •3.5. Полное изменение энергии равновесной системы. Первое начало термодинамики.
- •3.6. Работа, совершаемая макросистемой.
- •Графически можно изображать только равновесные процессы. Для неравновесных процессов нельзя говорить о параметрах состояния для всего тела (или системы) в данном состоянии.
- •3.7. Теплоемкость идеального газа. Применение первого начала термодинамики к различным процессам.
- •3.8. Адиабатический процесс
- •3.9. Политропические процессы
- •Работа, совершаемая идеальным газом при изопроцессах
- •Рассмотрим различные процессы
3.8. Адиабатический процесс
Большой практический интерес представляет адиабатный процесс — термодинамический процесс, в котором система не обменивается теплотой с окружающей средой.
Адиабатическим (адиабатным ) называется процесс, происходящий без теплообмена с внешней средой.
Из этого определения следует, что в адиабатном процессе δQ=0. Следует отметить, что условие отсутствия теплообмена нельзя формулировать в виде Q = 0. Это равенств говорит лишь о том, что в целом за вес процесс алгебраическая сумма теплот, подведенных к системе и отведенных от нее равна нулю.
Условие Q = 0 вовсе не исключает теплообмена между системой и внешней средой на отдельных участках рассматриваемого процесса. Практически адиабатный процесс осуществляется при достаточно быстром расширении или сжатии газа.
Из первого закона термодинамики имеем для адиабатного процесса δА=-dU, т.е. в адиабатном процессе систем совершает работу за счет убыли внутренне энергии системы.
Для адиабатного
процесса идеального газа из следует,
что
![]()
Рассмотрим поведение идеального газа при адиабатическом процессе.
Из первого начали
термодинамики имеем
![]() ,
для адиабатического процесса
,
для адиабатического процесса
![]() ,
,
Поэтому
![]()
Из уравнения
состояния идеального газа выразим
давление
![]() ,
,
Поэтому
![]() ,
,
или
![]()
Проинтегрируем, получим:
![]() ,
,
Но
![]() ,
,
поэтому
![]() –
уравнение адиабаты в переменных
T и V.
–
уравнение адиабаты в переменных
T и V.
Если подставить
Т из уравнения Менделеева - Клапейрона,
![]() ,
,
то получим:
![]() (29)
(29)
– уравнение адиабатного процесса или уравнение адиабаты в переменных р и V (Уравнение Пуассона).
Уравнение изотермы в тех же переменных pV=const.
Постоянная называется коэффициентом Пуассона.
 Покажем,
что адиабата идет круче изотермы.
Покажем,
что адиабата идет круче изотермы.
Для этого сравним производные dp/dV для обоих процессов.
Д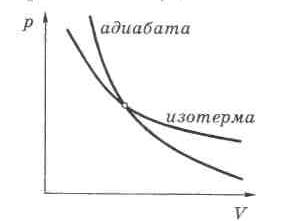 ля
изотермического процесса
ля
изотермического процесса
![]() ,
,
Откуда
![]() .
.
Для
адиабатного процесса
![]() ,
,
откуда
![]() .
.
Поскольку
![]() ,
то адиабаты действительно идут круче
изотерм.
,
то адиабаты действительно идут круче
изотерм.
3.9. Политропические процессы
Политропическими (политропными) называются процессы, при которых теплоемкость тела остается постоянной.
Уравнение процесса
![]() (30),
(30),
Где n- произвольное число, положительное, отрицательное или равное нулю.
Любой процесс, уравнение которого можно свести к виду (30), является политропическим. Соответствующую кривую называют политропой.
Отличительной
особенностью всех политропических
процессов является то, что в ходе этих
процессов то
![]() .
.
Убедимся в этом, воспользовавшись формулой
![]() ,
(31)
,
(31)
 найдем
с помощью уравнения политропического
процесса в переменных Т и V
найдем
с помощью уравнения политропического
процесса в переменных Т и V
Продифференцируем последнее уравнение:
![]()
Откуда
![]()

Подставив это выражение в (31) , получим
![]() (32)
(32)
Видно, что в ходе политропических процессов
Если n = γ , то
 -
адиабатический процесс
-
адиабатический процесс
При n = 1
 -
изотермический процесс
-
изотермический процессИзобарическому процессу соответствует n = 0,
Интересный результат обнаруживается в случае

Перепишем (32) в виде
![]() (33)
(33)
Видно, что в этом
случае
![]() .
Это значит, что мы сообщаем тепло системе,
а она охлаждается , поскольку знаки
и
.
Это значит, что мы сообщаем тепло системе,
а она охлаждается , поскольку знаки
и
![]() должны
быть противоположными. Это относится
ко всем политропическим процессам,
«промежуточным» между изотермическим
и адиабатическим.
должны
быть противоположными. Это относится
ко всем политропическим процессам,
«промежуточным» между изотермическим
и адиабатическим.
Из формулы (32) можно получить выражение, определяющее n через теплоемкость
![]() (34)
(34)
Величина n называется показателем политропы.
Чтобы установить характер политропического процесса
при
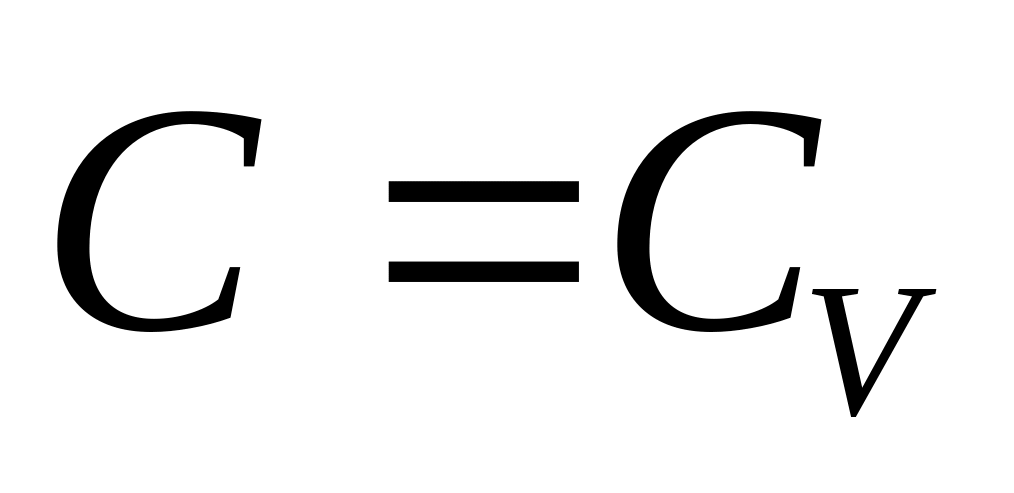 ,
обратимся к уравнению (29).
,
обратимся к уравнению (29).
При это уравнение принимает вид (С − Сp) ln V = const,
откуда следует, что V в ходе процесса остается постоянным.
Таким образом, политропический процесс с теплоемкостью является изохорическим процессом.
Значения показателя политропы n для перечисленных процессов даны в табл1.
Решив уравнение (10) относительно Сс, получим формулу для теплоемкости идеального газа при политропическом процессе:
![]() .
.
Подстановка n = γ обращает это выражение в нуль
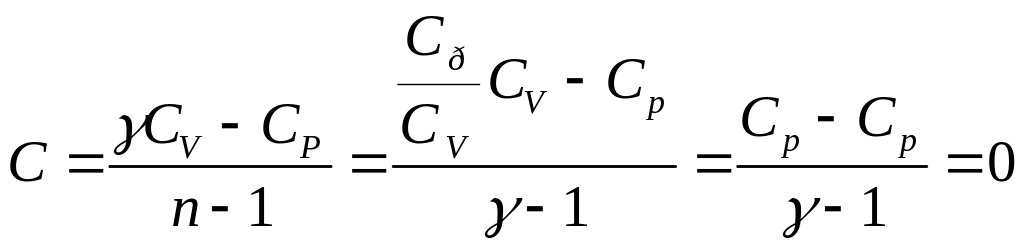 .
.
Следовательно, теплоемкость идеального газа при адиабатическом процессе равна нулю.
При адиабатическом процессе теплоемкость равна нулю для всех тел.
Это вытекает из того, что при адиабатическом процессе d'Q = 0, в то время как изменение температуры dT отлично от нуля.
При n = 1
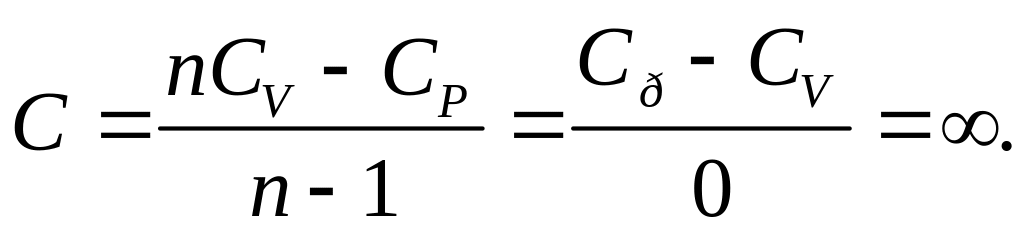
Таким образом, при изотермическом процессе теплоемкость бесконечно велика.
Это объясняется тем, что при изотермическом процессе dT = 0, в то время как теплота d'Q отлична от нуля.
