
- •Термодинамика
- •3.7. Теплоемкость идеального газа. Применение первого начала термодинамики к различным процессам.
- •3.8. Адиабатический процесс
- •3.9. Политропические процессы
- •3.1. Квазистатические и нестатические процессы.
- •3.2. Гипотеза о равнораспределении энергии по степеням свободы
- •3.3. Внутренняя энергия системы.
- •3.4. Работа и теплота.
- •3.5. Полное изменение энергии равновесной системы. Первое начало термодинамики.
- •3.6. Работа, совершаемая макросистемой.
- •Графически можно изображать только равновесные процессы. Для неравновесных процессов нельзя говорить о параметрах состояния для всего тела (или системы) в данном состоянии.
- •3.7. Теплоемкость идеального газа. Применение первого начала термодинамики к различным процессам.
- •3.8. Адиабатический процесс
- •3.9. Политропические процессы
- •Работа, совершаемая идеальным газом при изопроцессах
- •Рассмотрим различные процессы
3.2. Гипотеза о равнораспределении энергии по степеням свободы
Степени свободы - называют число независимых координат, определяющих положение системы, или в интересующем нас случае — молекулы.
Д ля
определения положения центра масс
молекулы необходимо задать три координаты.
Это означает, что молекула имеет три
поступательных степени свободы.
ля
определения положения центра масс
молекулы необходимо задать три координаты.
Это означает, что молекула имеет три
поступательных степени свободы.
Если молекула двухатомная и жесткая («гантель»), то, кроме трех поступательных степеней свободы, она имеет и две вращательные, связанные с углами поворота вокруг двух взаимно перпендикулярных осей 1-1 и 2-2, проходящих через центр масс С, как показано на рисунке. Вращение вокруг оси молекулы для материальных точек лишено смысла.
Таким образом, жесткая двухатомная молекула имеет пять степеней свободы: три поступательных и две вращательных.
Если молекула упругая, то возможны колебания атомов и необходима еще одна степень свободы (расстояние между атомами). Ее называют колебательной.
В ряде задач
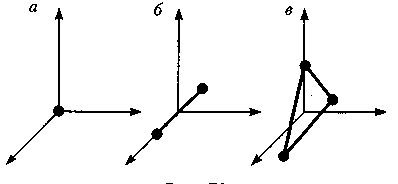
молекулу одноатомного газа (рис. а) рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать.
Таким образом; одноатомный газ обладает тремя степенями свободы (i=3).
![]() ,
,
Где I- момент инерции для материальной точки
В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис. б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла.
Таким образом; двухатомный газ обладает пятью степенями свободы (i= 5).
Трехатомная (рис. в) и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
Независимо
от общего числа степеней свободы молекул
три степени
свободы всегда поступательные.
Ни одна из поступательных степеней
свободы: имеет преимущества перед другим
поэтому на каждую из них приходит в
среднем одинаковая энергия, равна 1/3
значения
![]()
![]() (1)
(1)
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул:
для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую
поступательную и вращательную степени свободы приходится в среднем
кинетическая
энергия, равная -![]() ,
,
колебательную степень свободы — в среднем энергия, равная

Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы.
Таким образом, средняя энергия молекул
![]() (2)
(2)
где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
![]() (3)
(3)
Число i совпадает с числом степеней свободы только для жестких молекул.
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Еще о степенях свободы. Приведем некоторые важные результаты для числа степеней свободы у линейных и нелинейных молекул, учитывая, что полное число степеней свободы у системы из N материальных точек равно 3N. Эти результаты приведены в таблице:

Следует отметить, что закон Больцмана является приближенным (получен на основе классических представлений о характере движения молекул) и пересмотрен в квантовой статистике.
