
- •Термодинамика
- •3.7. Теплоемкость идеального газа. Применение первого начала термодинамики к различным процессам.
- •3.8. Адиабатический процесс
- •3.9. Политропические процессы
- •3.1. Квазистатические и нестатические процессы.
- •3.2. Гипотеза о равнораспределении энергии по степеням свободы
- •3.3. Внутренняя энергия системы.
- •3.4. Работа и теплота.
- •3.5. Полное изменение энергии равновесной системы. Первое начало термодинамики.
- •3.6. Работа, совершаемая макросистемой.
- •Графически можно изображать только равновесные процессы. Для неравновесных процессов нельзя говорить о параметрах состояния для всего тела (или системы) в данном состоянии.
- •3.7. Теплоемкость идеального газа. Применение первого начала термодинамики к различным процессам.
- •3.8. Адиабатический процесс
- •3.9. Политропические процессы
- •Работа, совершаемая идеальным газом при изопроцессах
- •Рассмотрим различные процессы
3.6. Работа, совершаемая макросистемой.
Найдем работу, совершаемую макросистемой.
Если объем макросистемы (например, газа) получает приращение dV,
а давление, оказываемое ею на соседние тела (стенки), равно р,
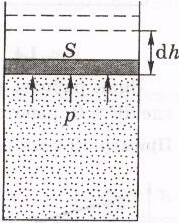 то
элементарная работа сил,
действующих со стороны газа на стенки,
равна
то
элементарная работа сил,
действующих со стороны газа на стенки,
равна
![]() .
.
Это легко получить для случая, когда система (газ) находится в цилиндре с поршнем (рис. 1.)
Элементарная
работа, совершаемая газом при
перемещении поршня на
![]() ,
равна
,
равна
![]() ,
,
где F — сила, с которой газ действует на поршень.
Площадь сечения последнего S,
поэтому F = pS и
![]() ,
где
,
где
![]() .
.
Отсюда .
При поднятии поршня давление газа, вообще говоря, может меняться.
 Поэтому работа,
совершаемая газом при конечных изменениях
объема, например от
Поэтому работа,
совершаемая газом при конечных изменениях
объема, например от
![]() до V2, должна быть представлена в
виде интеграла:
до V2, должна быть представлена в
виде интеграла:
A=![]() pdV
(13)
pdV
(13)
Р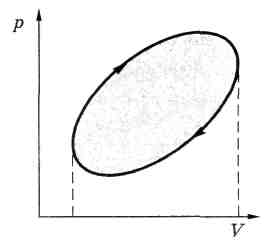 абота
А существенным
образом зависит от процесса
(или «пути»), по которому
система переводится из состояния
1 в состояние 2.
абота
А существенным
образом зависит от процесса
(или «пути»), по которому
система переводится из состояния
1 в состояние 2.
Это наглядно видно из графика на рис.1, где изображен процесс изменения объема на диаграмме р, V.
Геометрическая интерпретация интеграла (7) — это «площадь» под кривой 1—2, а эта площадь зависит от вида кривой, т. е. от процесса.
Если в результате изменений макросистема возвращается в исходное состояние, то говорят, что она совершила круговой процесс или цикл.
На диаграмме р, V такой процесс имеет вид замкнутой кривой .
Работа, совершаемая системой за цикл, численно равна площади внутри цикла, тонированной на рисунке. При этом,
если точка, изображающая состояние системы, описывает цикл
- по часовой стрелке (как на рисунке), то работа системы А > 0.
- против часовой стрелки, то А < 0.
Знак работы зависит от знака dV. на тех участках процесса, где
- dV > 0, работа А > 0,
 -
dV
< 0,
и
А <
0.
-
dV
< 0,
и
А <
0.
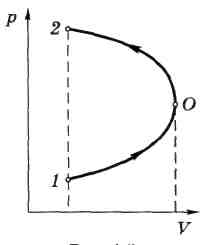
Пример. Найдем графически работу, совершенную системой в процессе, показанном на рисунке.
На участке 1 – 0 работа А10 > 0 и равна площади под кривой 1- 0.
На участке же 0 - 2 работа А02 < 0.
Суммарная работа А будет равна площади, охватываемой кривой 1 – О – 2 – 1 , причем в данном случае эта работа А < 0.
Графически можно изображать только равновесные процессы. Для неравновесных процессов нельзя говорить о параметрах состояния для всего тела (или системы) в данном состоянии.
3.7. Теплоемкость идеального газа. Применение первого начала термодинамики к различным процессам.
Одним из основных тепловых свойств тел, широко используемых в термодинамическом методе исследования, является теплоемкость.
Теплоемкостью тела называется физическая величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на 1 Кельвин:
![]() .
(14)
.
(14)
Теплоемкость С является функцией процесса.
Теплоемкость, зависит
от вида процесса и в разных процессах различна, так же как и количество теплоты Q
от его химического состава,
массы тела
термодинамического состояния.
Эта величина, как зависит от процесса. Без указания процесса не имеет смысла.
Тепловые свойства однородных тел характеризуются понятиями удельной (с) и молярной (С) теплоемкости.
Теплоемкость однородного тела равна произведению массы тела m на удельную теплоемкость (с) вещества:
![]() или
или
![]() (15)
(15)
Таким образом, связь между и dT для однородного тела имеет вид:
![]() (16)
(16)
Удельная теплоемкость - теплоемкость единицы массы вещества

Молярная теплоемкость - теплоемкость моля вещества С, - физическая величина С, численно равная теплоте, которую нужно сообщить одному молю вещества для изменения его температуры на 1 К в рассматриваемом термодинамическом процессе
![]() (17)
(17)
![]() -
молярная масса вещества, с –
его удельная теплоемкость в том же
процессе.
-
молярная масса вещества, с –
его удельная теплоемкость в том же
процессе.
Выражении (16) можно записать:
![]() (18)
(18)
Формулы
![]() и
(17) позволяют записать первое начало
термодинамики для равновесных процессов
изменения состояния газа:
и
(17) позволяют записать первое начало
термодинамики для равновесных процессов
изменения состояния газа:
![]() (19)
(19)
Особое значение
имеют теплоемкости для двух процессов:
при постоянном объеме
![]() и постоянном давлении
и постоянном давлении
![]() .
.
Определим значение
молярных теплоемкостей при постоянном
объеме
![]() и при постоянном давлении
и при постоянном давлении
![]() для однородного идеального газа.
для однородного идеального газа.
Е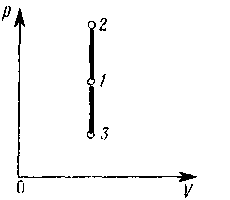 сли
нагревание происходит
сли
нагревание происходит
при постоянном объеме, V =const,
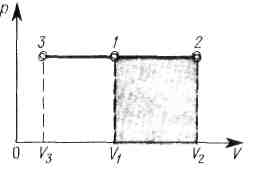
На рисунке показаны процессы:
- изохорного нагревания (прямая 1 – 2 )
- и охлаждения (прямая 1—3).
Практически изохорный процесс осуществляется при изменении температуры газа, находящегося в толстостенном сосуде постоянного объема.
Газ не совершает работы: δА = р dV = 0, или система не совершает работы над внешними телами
и первое начало термодинамики запишем в виде
![]() (
или
(
или![]() )
)
все тепло идет на приращение внутренней энергии тела.
Теплоемкость любого тела при постоянном объёме
![]() (20)
(20)
При дифференцировании U по Т объём следует считать постоянным (это частная производная).
Молярная теплоемкость равна
![]() (21)
(21)
Здесь i –число степеней свободы молекул газа.
Для одноатомного газа i=3 и

Для двухатомного
газа i=6 ,
![]() ,
т.е. в два раза больше, чем для одноатомного
газа.
,
т.е. в два раза больше, чем для одноатомного
газа.
При комнатных температурах для двухатомного газа i можно считать равным 5, поэтому
 (отсутствует одна вращательная степень
свободы).
(отсутствует одна вращательная степень
свободы).
многоатомных газов
 (если отсутствует колебательная степень
свободы, и молекулы можно считать
точками)
(если отсутствует колебательная степень
свободы, и молекулы можно считать
точками)
Из опытов установлено, что теплоемкость зависит
от химического состава газа
от его температуры.
Однако в не очень широкой области изменения температуры можно считать, что =const.
Соответственно при изохорном нагревании газа от температуры T1 до Т2 изменение внутренней энергии газа и сообщенная ему теплота равны
![]()
![]() (22)
(22)
Данные соотношения справедливы для любого процесса изменения состояния идеального газа. Внутренняя энергия такого газа зависит только от его массы, химического состава и температуры.
Этот важнейший вывод был подтвержден опытами, которые осуществили независимо друг от друга Ж. Гей-Люссак и Д. Джоуль.
Для любого равновесного процесса изменения состояния идеального газа первое начало термодинамики имеет вид:
![]() (23)
(23)
п
 ри
постоянном давлении, р
=const.
ри
постоянном давлении, р
=const.
Практически он осуществляется.
Например, при нагревании или охлаждении газа, находящегося в цилиндре с подвижным поршнем, на который действует постоянное внешнее давление.
На рисунке изображены процессы
изобарного расширения газа при его нагревании (процесс 1—2)
изобарного сжатия газа при его охлаждении (процесс 1—3).
Элементарная теплота δQ, сообщаемая газу в изобарном процессе,
![]() (24)
(24)
где С, молярная теплоемкость газа при постоянном давлении, которую также называют изобарной теплоемкостью
Газ в этом случае
будет расширяться и совершать работу
над внешними телами, значит, для повышения
температуры газа на 1К понадобиться
больше тепла, чем при постоянном объёме,
т.е.
![]() .
.
Элементарная работа δА, совершаема: идеальным газом в изобарном процессе
![]() (25)
(25)
где использовано выражение рdV из уравнения Клапейрона - Менделеева при р =const.
Соотношение позволяет выяснить физический смысл универсальной газовой постоянной R:

т. е. она численно равна работе, совершаемой одним молем идеального газа при его изобарном нагревании на 1 К.
Установим связь между молярными теплоемкостями и .
Для этого подставим выражение (24) и (25) в уравнение первого начала термодинамики (19)
![]() ,
,
Отсюда следует,
![]() (26)
(26)
- уравнением Майера: выражает связь изобарной и изохорной теплоемкостей.
С учетом формулы (21) можно получить выражение для :
![]() (27)
(27)
Таким образом, универсальная газовая постоянная численно равна работе, которую совершает моль идеального газа при повышении его температуры на один Кельвин при постоянном давлении.
Физический смысл уравнения Майера заключается в том, что при изобарном нагревании газа к нему должна быть подведена большая теплота, чем для такого же изохорного нагревания. Разность теплот должна быть равна работе, совершенной газом при изобарном расширении.
Далее под теплоемкостью мы будем понимать только молярную теплоемкость.
Важной характеристикой
газов является отношение
![]() -
постоянная адиабаты.
-
постоянная адиабаты.
Обозначим
![]() .
И
.
И
![]()
Тогда
![]() ,
и
,
и
![]() .
.
Для одноатомных
газов
![]() .
.
Для двухатомных
газов
![]()
Работа, которую
совершает газ при изобарном процессе
расширения 1—2 , равна

Она измеряется площадью, закрашенной на рисунке.
Для идеального
газа работу можно выразить также формулой
![]()
Если в интервале температур ΔТ = Т2 — Т1, молярную теплоемкость Сv можно считать постоянной, то теплота Q 1-2, сообщаема: газу в изобарном процессе 1—2
![]() (28)
(28)
изотермический процесс, Т=const
р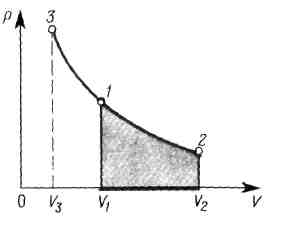 асширения
или сжатия газа может происходить в
условиях, когда теплообмен между газом
и внешней средой осуществляется при
постоянной разности температур.
асширения
или сжатия газа может происходить в
условиях, когда теплообмен между газом
и внешней средой осуществляется при
постоянной разности температур.
Для этого теплоемкость внешней среды должна быть достаточно велика и процесс расширения (или сжатия) должен происходить весьма медленно.
Изотермическими являются процессы кипения, конденсации, плавления и кристаллизации химически чистых веществ, происходящие при постоянном внешнем давлении.
Для идеального газа в процессе при Т = const выполняется закон Бойля— Мариотта
pV = const и в диаграмме p — V такой процесс графически изображается изотермой, имеющей вид равнобочной гиперболы
Внутренняя энергия идеального газа в изотермическом процессе не изменяется:
![]() ,
т.к. Т=const
и
dT=0
,
т.к. Т=const
и
dT=0
Вся теплота, сообщаемая газу, расходуется на совершение газом работы против внешних сил:

Если газ изотермически расширяется (V2>V1), то к нему подводится теплота (Q1-2>0)и газ совершает положительную работу (A,2>0), которая измеряется площадью, закрашенной на рисунке.
При изотермическом сжатии газа (процесс 1—3) работа А1-3, совершаемая газом, отрицательна (А1-3<0). Положительную работу совершают внешние силы. При этом от газа отводится теплота Q1-3 (Q1-3 <0).
Теплоемкость
газа в изотермическом процессе
Ст=
±![]() ,
так как
,
так как![]() ,
a
dТ
= 0
,
a
dТ
= 0
молекула |
Характер связи между атомами |
Число степеней свободы |
i |
CV |
Cp |
γ |
||
Поступат. |
Вращат. |
Колебат. |
||||||
одноатомная |
– |
3 |
– |
– |
3 |
|
|
1,67 |
двухатомная |
жесткая |
3 |
2 |
– |
5 |
|
|
1,40 |
двухатомная |
упругая |
3 |
2 |
1 |
7 |
|
|
1,29 |
С числом атомов три и больше |
жесткая |
3 |
3 |
– |
6 |
|
|
1,33 |
