
- •Термодинамика
- •3.7. Теплоемкость идеального газа. Применение первого начала термодинамики к различным процессам.
- •3.8. Адиабатический процесс
- •3.9. Политропические процессы
- •3.1. Квазистатические и нестатические процессы.
- •3.2. Гипотеза о равнораспределении энергии по степеням свободы
- •3.3. Внутренняя энергия системы.
- •3.4. Работа и теплота.
- •3.5. Полное изменение энергии равновесной системы. Первое начало термодинамики.
- •3.6. Работа, совершаемая макросистемой.
- •Графически можно изображать только равновесные процессы. Для неравновесных процессов нельзя говорить о параметрах состояния для всего тела (или системы) в данном состоянии.
- •3.7. Теплоемкость идеального газа. Применение первого начала термодинамики к различным процессам.
- •3.8. Адиабатический процесс
- •3.9. Политропические процессы
- •Работа, совершаемая идеальным газом при изопроцессах
- •Рассмотрим различные процессы
Лекция 6
Термодинамика
Вопросы:
Термодинамика.
3.1. Квазистатические и нестатические процессы.
3.2. Гипотеза о равнораспределении энергии по степеням свободы
3.3. Внутренняя энергия системы.
3.4. Работа и теплота.
3.5. Полное изменение энергии равновесной системы. Первое начало термодинамики.
3.6. Работа, совершаемая макросистемой.
3.7. Теплоемкость идеального газа. Применение первого начала термодинамики к различным процессам.
3.8. Адиабатический процесс
3.9. Политропические процессы
Термодинамика явилась первой наукой, на основе которой стало возможным статистическое изучение макросвойств и процессов для произвольных систем с числом частиц N>>1.
При термодинамическом подходе о макросвойствах системы судят на основе обобщенных исследований. К числу этих исследований относятся изучения:
1) процессов взаимопревращения теплоты и работы;
2) обратимых и необратимых процессов;
3) процессов при низких температурах.
Аналитическое обобщение такого рода опытов позволяет сформулировать три закона термодинамики, которые можно записать в виде дифференциальных уравнений и которые составляют его фундамент. Такой метод исследования называют феноменологическим. Он присущ и другим разделам физики (механика, электростатика и др.). При феноменологическом подходе полностью используются молекулярно-кинетические представления, поэтому выводы, полученные в этих рамках, не позволяют глубоко вскрыть природу изучаемых явлений. Оставаясь в рамках термодинамики невозможно обосновать законы термодинамики. Это свидетельствует об ограниченности феноменологического подхода. Эти законы термодинамики можно лишь обосновать на основе статистического метода.
3.1. Квазистатические и нестатические процессы.
Процессы, при которых макроскопическая система все время находится в равновесии (или точнее, в ходе которых система проходит через последовательный ряд равновесных состоянии) называется равновесным или квазистатическими.
Состояние считается равновесным, если во всех точках системы параметры состояния (p,V,T) одинаковы.
Если какой - либо параметр состояния системы в её различных точках неодинаковы, то состояние является неравновесным. Если такую систему предоставить самой себе, то параметр выровняется, и система придет в состояние равновесия.
Квазистатический
процесс легко представить, если реальная
скорость процесса
![]() много меньше скорости восстановления
равновесия. В этом случае при реальных
изменениях с малой скоростью равновесие
восстанавливается с большой скоростью,
и при реальном изменении состояния
макроскопической системы эта система
проходит через ряд равновесных состояний.
много меньше скорости восстановления
равновесия. В этом случае при реальных
изменениях с малой скоростью равновесие
восстанавливается с большой скоростью,
и при реальном изменении состояния
макроскопической системы эта система
проходит через ряд равновесных состояний.
Рассмотрим макроскопическую систему А, взаимодействующую с термостатом В.
Будем считать
- давление макроскопической системы А равным р,
-давление термостата
(р+![]() ).
).
1) Тогда за счет бесконечно малого перепада давление начинается процесс выравнивания давления - система А начинает сжиматься. Если бы переход давления был равен нулю, то процесс отсутствовал бы, и его скорость была бы равна нулю.
При бесконечно малом перепаде скорость процесс бесконечно мала, а скорость
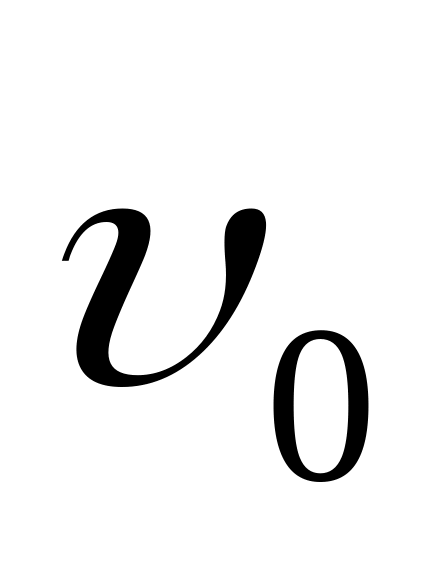 процесса восстановленного равновесия
в газе конечна, т.е.
процесса восстановленного равновесия
в газе конечна, т.е.
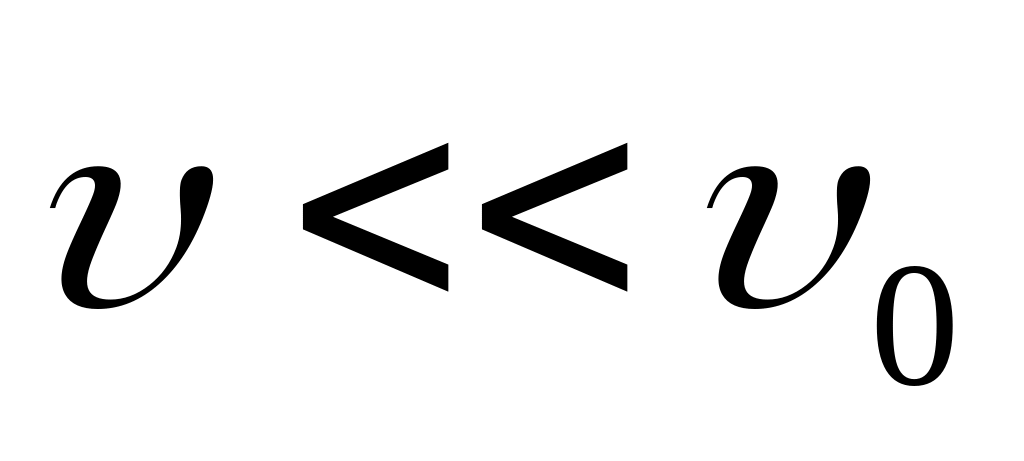 ,
и процесс сжатия газа будет проходить
через последовательность равновесных
состояний, т.е. квазистатически.
,
и процесс сжатия газа будет проходить
через последовательность равновесных
состояний, т.е. квазистатически.
Такой процесс называют обратимым, т.к. достаточно бесконечно малых условий, и процесс потечет в обратном направлении, то есть если давление газа будет p+ , а термостата р, то газ будет расширяться, проходя квазистатически через те же состояния, но в обратном порядке.
В термодинамике обратимыми процессами называют такие процессы, которые могут протекать как в прямом, так в обратном направлениях без заметных (конечных) изменений в окружающей среде.
Если же скорость протекания процесса много больше скорости восстановления равновесия,
 ,
то процесс
называется нестатическим
или неравновесным.
,
то процесс
называется нестатическим
или неравновесным.
В этом случае система проходит ряд неравновесных состояний. Физически такая ситуация встречается тогда, когда имеет место конечный перепад (градиент) параметров системы А и термостата В. Такие процессы называют еще необратимыми, т.к. бесконечно малых изменений условий в конечном состоянии будет недостаточно, чтобы вернуть систему в исходное состояние, т.е. процесс нельзя обратить без конечных изменений в окружающей среде.
