- •Модуль I
- •Классификация спиртов
- •Гомологический ряд одноатомных спиртов.
- •Радикало-функциональная и заместительная номенклатуры спиртов.
- •Изомерия спиртов.
- •Строение спиртов.
- •Химические свойства
- •Многоатомные спирты
- •Физические свойства спиртов.
- •Классификация фенолов.
- •Номенклатура и изомерия.
- •Строение фенола, взаимное влияние бензольного кольца и гидроксильной группы.
- •Физические свойства.
- •Химические свойства.
- •Фенол. Резорцин. Адреналин. Применение в медицине. Трехатомные фенолы.
- •По характеру углеводородного радикала различают:
- •Строение молекулы амина
- •Диамины.
- •Аминоспирты
- •Вопросы для самоконтроля:
- •Упражнения
- •Лабораторная работа
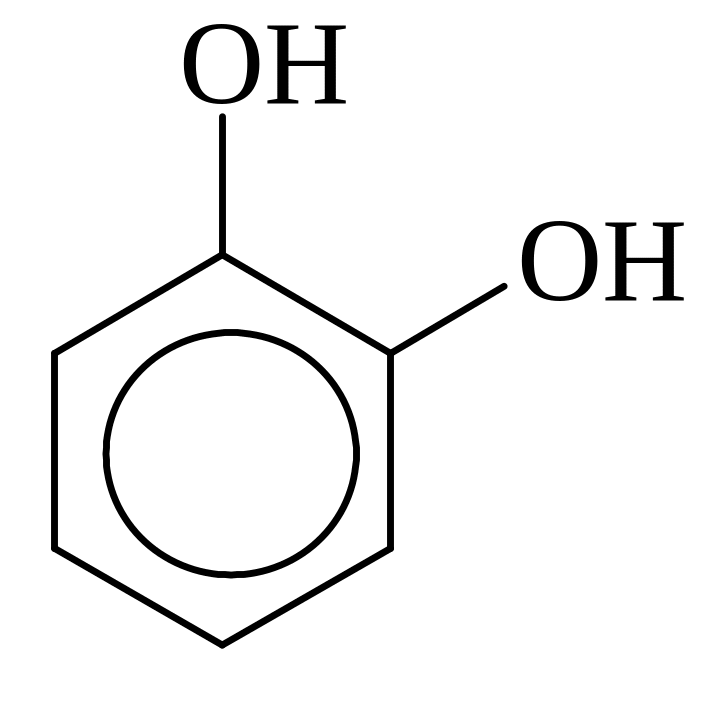
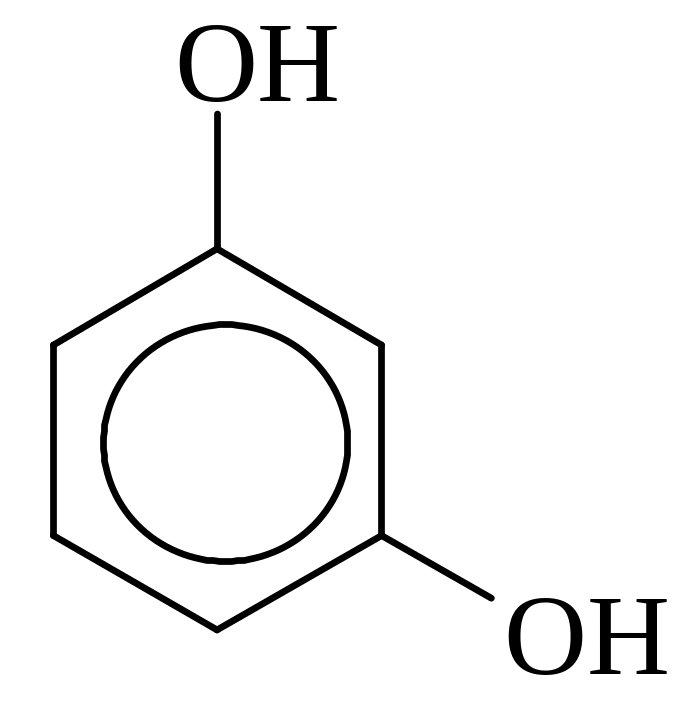
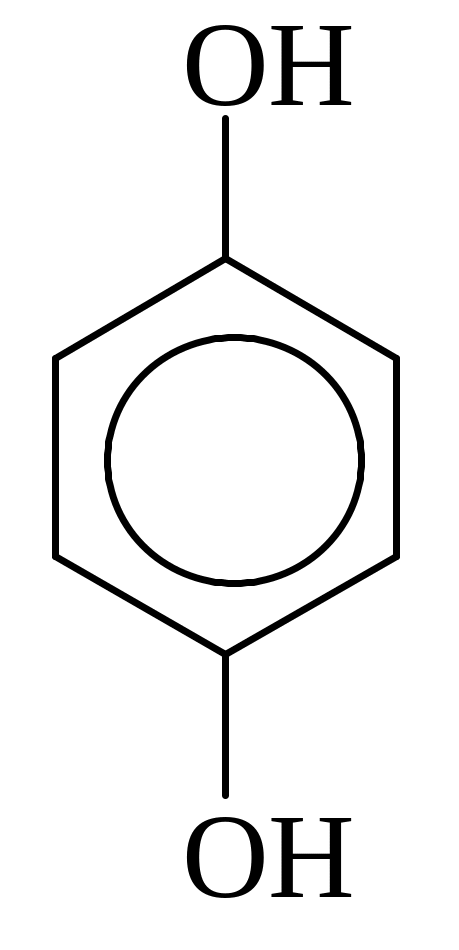
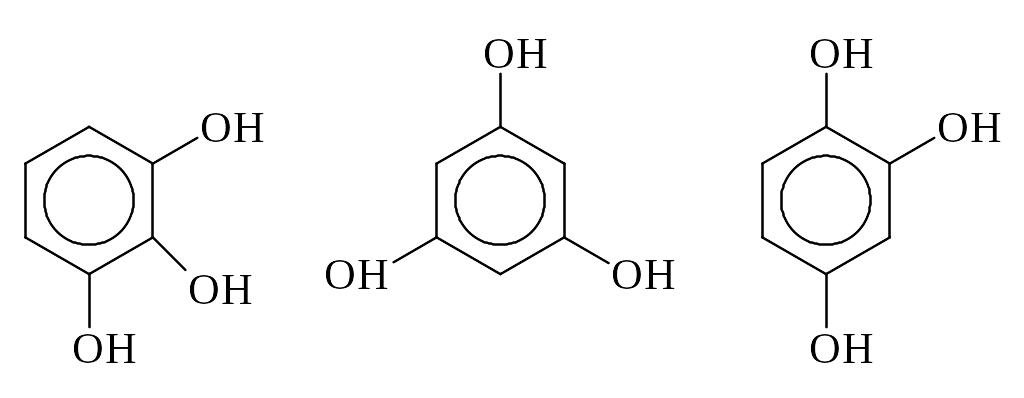
Классификация фенолов.
В зависимости от числа групп ОН фенолы делятся на: одноатомные и
двухатомные
фенолы:
|
|
|
|
|
Пирокатехин, 1,2-Дигидрокси- бензол |
|
Резорцин, 1,3-Дигидрокси- бензол |
|
Гидрохинон, 1,4-Дигидрокси- бензол |
трехзамещенные фенолы: (пирогаллол), симметричный и несимметричный
.
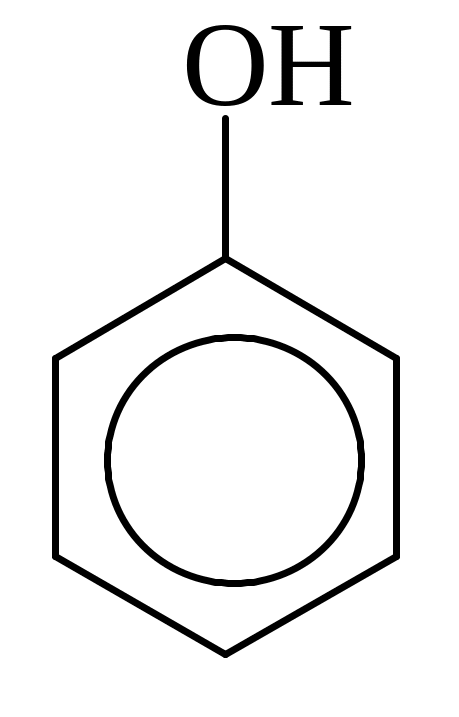
Номенклатура и изомерия.
Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название «фенол». Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с группой ОН и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
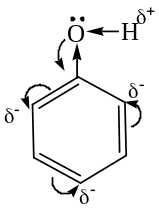
Строение фенола, взаимное влияние бензольного кольца и гидроксильной группы.
В молекуле фенола бензольное кольцо и группа ОН взаимно влияют друг на друга. Неподеленная пара электронов атома кислорода группы ОН находится в р, π-сопряжение с бензольным кольцом. Поэтому в феноле группа ОН, помимо отрицательного индуктивного эффекта проявляет положительный мезомерный эффект. Величина +М-эффекта больше, чем –I-эффекта. Поэтому группа ОН является электронодонором (Э.Д) по отношению к бензольному кольцу и повышает полярность связи О – Н и, следовательно происходит увеличение подвижности атома водорода и тем самым усиливаются кислотные свойства.
Кроме того, +М-эффект группы ОН повышает электронную плотность в орто-и пара-положениях бензольного кольца и в положениях 2, 4, 6 возникает частичный отрицательный заряд что облегчает реакции электрофильного замещения.
Кислотный центр
 –I<
+М, ЭД
–I<
+М, ЭД
Физические свойства.
Фенол – это бесцветное кристаллическоевещество с резким запахом, плохо растворим в воде при обычной температуре, а при температуре выше 660 смешивается с водой в любых соотношениях. На воздухе окисляется и становится розовым. Фенол – токсичное вещество, вызывает ожоги кожи, его 10% водный раствор называется карболовой кислотой и применяется как антисептик.
Химические свойства.
Химические свойства фенолов обусловлены наличием группы ОН и бензольного кольца.
Реакции с участием гидроксильной группы.
Диссоциация в водных растворах:
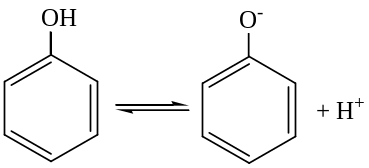 фенолят
- ион
фенолят
- ион
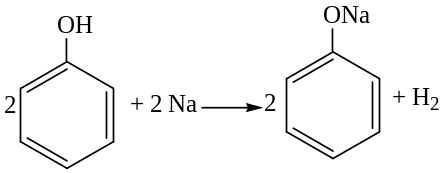
Взаимодействие с активными металлами (сходство с простыми спиртами):
Взаимодействие со щелочами (отличие от спиртов):
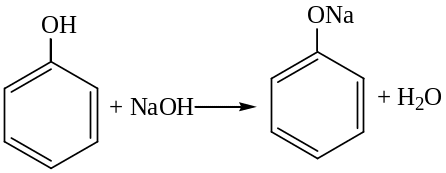
Образующиеся феноляты легко разлагаются при действии кислот. Поэтому при действии Н2СО3 (СО2 + Н2О) и др. кислот феноляты легко разлагаются и обратная реакция не возможна.
С6Н5ОNа + СО2 + Н2О С6Н5ОН + NаНСО3
Взаимодействие с галогеналканами с образованием простых эфиров:
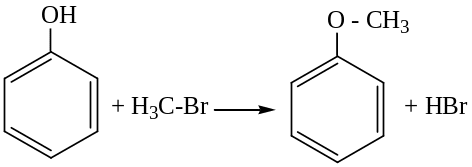 метилфениловый
эфир
метилфениловый
эфир
Взаимодействие с ангидридами кислот с образованием сложных эфиров:
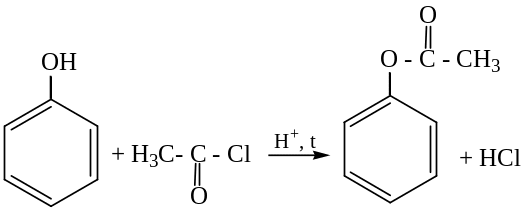 фенилацетат
фенилацетат
Взаимодействие с солями (хлоридом железа III). Данная реакция является качественной реакцией на фенольный гидроксид
Каждый фенол дает свое характерное окрашивание в качественной реакции с FеС13:
Фенол Фиолетовое, Гидрохинон Грязно-зеленое,
Пирокатехин Зеленое, Пирогаллол Красное.
Резорцин Фиолетовое
3С6Н5ОН + FеС13 (С6Н5О)3Fе + 3НС1
Фиолетовое окрашивание
Р-ция восстановления с цинковой пылью при нагревании:
С6Н5ОН
+ 3Н2
![]() С6Н12
+ ZnО
С6Н12
+ ZnО
.Р-ции по бензольному кольцу (SЕ )
Как было сказано выше, –ОН группа – ориентант I рода, облегчает реакции по бензольному кольцу, направляя атаку электрофильного реагента преимущественно в орто- и пара- положения:
Галогенирование фенола:
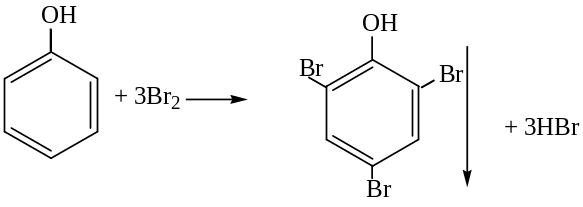 2,4,6-трибромфенол
2,4,6-трибромфенол
Происходит обесцвечивание бромной воды и образование белого осадка. Эта реакция используется как качественная реакция на фенол.
Нитрование фенола. Под действием 20% раствора азотной кислоты на холожу фенол превращается в смесь орто- и пара-нитрофенол:
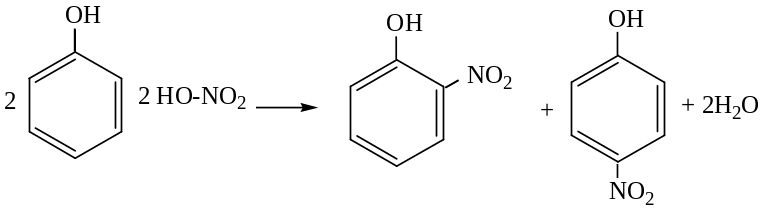
2-нитрофенол – 40% 4-нитрофенол – 10%
Для получения 2,4,6-тринитрофенола (пикриновой кислоты) фенол предварительно растворяют в концентрированной серной кислоте, а зате6м подвергают нитрованию концентрированной азотной кислотой:
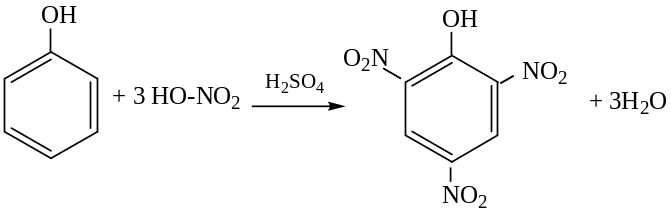 пикриновая
кислота
пикриновая
кислота
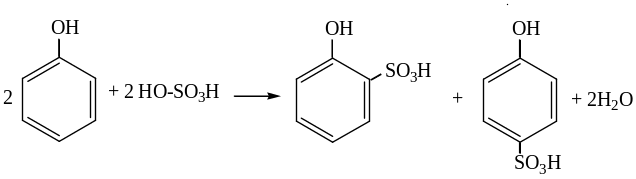
Сульфирование фенола:
Р-ция конденсации. При взаимодействии с формальдегидом фенол образует полимеры различного строения (линейного, разветвленного, сетчатого) – фенолформальдегидные смолы.
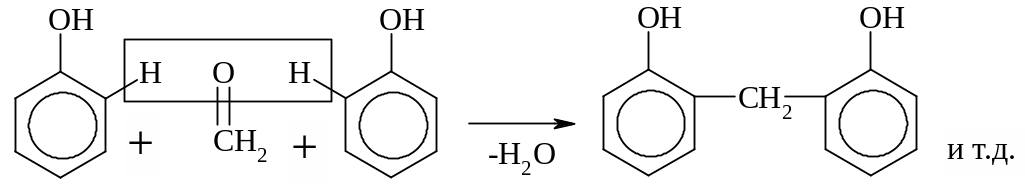

Фрагмент
фенолоформальдегидной
смолы
5.Р-ция гидрирования (восстановление):
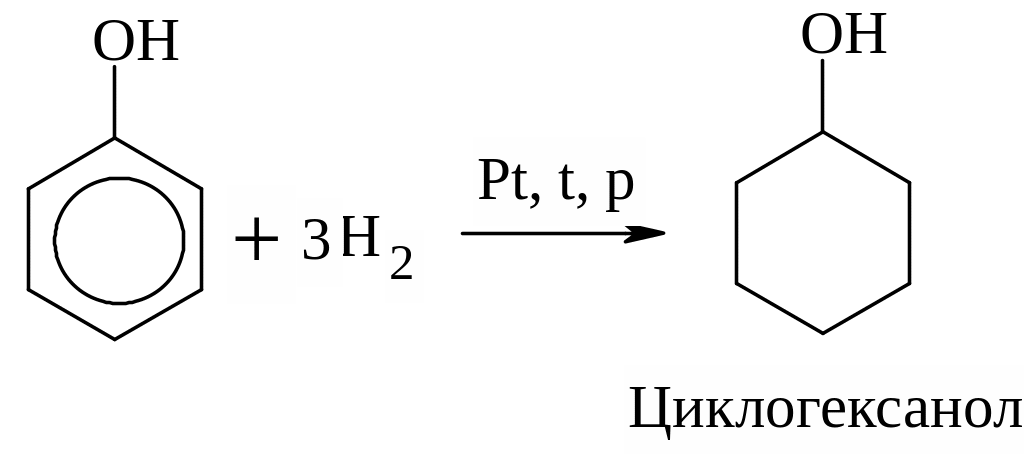
Окисление. Фенолы легко окисляются под действием кислорода воздуха:
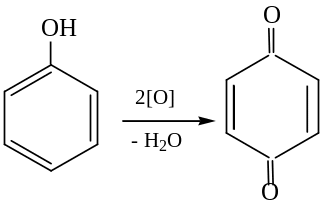 хинон
хинон
Многие биологические вещества содержат «хиноидную» систему: витамин К2 (фактор свертываемости крови), окислительно-восстановительные ферменты тканевого дыхания – убихиноны.