
- •Введение
- •I. Уровни и состояния квантовых систем.
- •I. Уровни и состояния квантовых систем.
- •Если его недостаточно, число индексов и немного символов. Эти сведения введены в школьную программу в 1970-х годах по инициативе академика а.Н. Колмогорова.
- •Одна частица. Состояния - орбитали, орбитальные уровни.
- •Числа заполнения электронных орбиталей.
- •Диаграмма уровней (энергетическая диаграмма).
- •Коллектив из многих частиц. Орбитальные уровни и конфигурации.
- •Правила заполнения для основной конфигурации. Символ конфигурации.
- •Возбуждённые конфигурации.
- •V. Простейшие квантовые системы. Спектральные переходы (2-й семинар).
Возбуждённые конфигурации.
Возбуждённые конфигурации возникают при перемещении одного или нескольких электронов с занятых на вакантные орбитали.
В представленной последовательности орбитальных уровней первой возбуждённой конфигураций будет a2 b2 c2 d 0 e1, где один электрон просто перемещён на один орбитальный уровень выше, но при этом образовалась вакансия на орбитали ниже самого верхнего из заполненных уровней. Можно было бы представить и возбуждённую конфигурацию типа a2 b2 c1 d 1e 1 g 0 h 0. По одной вакансии возникает на орбиталях c и d , поскольку каждая из орбиталей может быть дважды заполненной.
Если под высшим из занятых уровней остаётся хотя бы одна вакантная орбиталь, возникает ВОЗБУЖДЁННАЯ КОНФИГУРАЦИЯ. Энергия основной конфигурации минимальная изо всех возможных конфигураций электронной оболочки. В зависимости от размещения частиц по орбитальным уровням и в зависимости от числа орбитальных вакансий появляются конфигурации различного порядка (степени) возбуждения – ПЕРВАЯ ВОЗБУЖДЁННАЯ конфигурация, вторая, третья и т.д. Не существует никаких отличий в способах формального анализа конфигураций. Все они строятся одинаковыми приёмами.
Различным конфигурациям отвечают и различные коллективные уровни нулевого приближения. В этом начальном приближении энергией взаимодействия между частицами полностью пренебрегают.
Коллективный уровень энергии рассчитывается простейшим способом в виде суммы орбитальных энергий всех электронов.
Возбуждение
Примеры основных и возбуждённых конфигураций атомов и молекул.
Преподаватель может выбрать примеры по своему вкусу. Простейшие примеры конфигураций удобно строить для оболочек атомов лёгких элементов.
Коллективные состояния и уровни. Термы атомов и молекул.
Этот вопрос целесообразно обсуждать в соответствующем месте в своё время.
II. Возбуждение и дезактивация квантовой системы.
Основное и возбуждённые квантовые состояния.
Переход частицы с основного уровня на возбуждённый уровень происходит при поглощении энергии и называется возбуждением. Возбуждение может осуществляться разными способами.
Тепловое возбуждение частицы возникает при её соударении с другими частицами. Оно реализуется при высокой температуре. Некоторые из соударений могут сообщить частице энергию, достаточную для возбуждения разных и даже электронных состояний.
При облучении частицы светом, в котором содержатся подходящие кванты излучения – фотоны с определённой энергией, они будут поглощаться, почти целиком передавая свою энергию – массу возбуждаемой частице.
Возбуждающее излучение может быть монохроматическим, и все кванты поля – фотоны имеют почти строго одну и ту же частоту, которая подходит для резонансного поглощения атомами или молекулами.
Возбуждающее излучение может быть полихроматическим, и содержит кванты поля – фотоны с различной энергией.
Полихроматическое излучение характеризуется распределением по частоте, или по длине волны, или по энергии фотонов, и т.д.. При прохождении через вещество полихроматическое излучение поглощается лишь частично, а именно лишь на тех частотах, которые в точности отвечают условию Планка-Эйнштейна.
На кривой распределения интенсивности прошедшего излучения возникают провалы около частот спектральных переходов. Области распределения энергии на кривых поглощения оказываются из кривой распределения интенсивности прошедшего излучения как бы «вырезанными»-вещество их не пропустило – поглотило.
Экспериментальный спектр поглощения получается из сравнения кривых распределения интенсивности излучения падающего и излучения прошедшего через образец.
Переходя с возбуждённого уровня на более низкий, частица теряет энергию. Это может происходить разными способами. Во-первых, при соударении с другими частицами. Во-вторых, излучая фотон.
III. Поглощение и эмиссия фотонов.
Квантовый переход.
Спектральный переход происходит между двумя уровнями. Зам счёт этого поглощается или излучается фотон. Энергия спектрального перехода равна разности квантовых уровней, а характеристики излучения определяются по формуле Планка-Эйнштейна.
Энергия прямо пропорциональна частоте, размерность которой обратная секунда, . [] =С-1 = Гц (Герц),
или волновой частоте, размерность которой радиан в секунду
[] = радГц,
или волновому числу. Его нередко тоже именуют «частотой», но это всё же вольность – профессиональный жаргон. Его размерность обратный сантиметр, т.е.
[![]() ]=[1/]
= см-1.
]=[1/]
= см-1.
Длина волны измеряется в СМ или в М.
Все единицы связаны между собой цепочкой равенств.
![]()
Ниже представлены фундаментальные константы (константа Планка, циклическая константа Планка, заряд электрона, масса электрона):

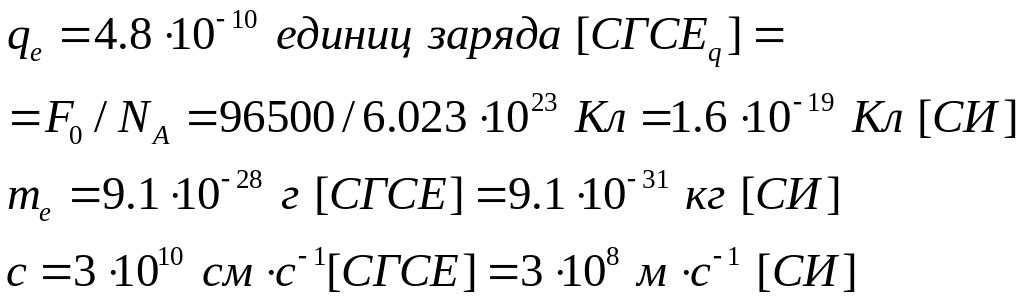
Спектральный терм.

Спектральный терм системы - это уровень энергии, выраженный в единицах волнового числа. Этот способ представления уровней принят в атомной спектроскопии.
Поглощение и испускание фотонов (абсорбция и эмиссия). Флуоресценция. Рассеяние фотонов.
Матрица спектральных переходов и электромагнитный спектр квантовой системы.
