
- •Рассмотрено на заседании
- •Методические указания и контрольные задания
- •Раздел 1 Общие методические рекомендации по изучению дисциплины
- •Выполнение контрольной работы
- •Раздел 2 задания и методические указания по выполнению контрольной работы Тема 1. Основные классы неорганических соединений
- •Задания
- •Тема 2 Эквиваленты. Закон эквивалентов
- •Задания
- •Тема 3. Строение атома
- •Задания
- •Тема 4 Периодическая система д.И. Менделеева
- •Задания
- •Тема 5 Энергетика химических процессов
- •Задания
- •Тема 6 Химическое сродство
- •Задания
- •Тема 7 Химическая кинетика и равновесие
- •Задания
- •Тема 8 Способы выражения концентрации раствора
- •Определение массовой доли вещества в растворе
- •Определение молярной концентрации раствора
- •Определение эквивалентной или нормальной концентрации
- •Определение моляльной концентрации раствора
- •Вычисления, связанные с взаимным переходом одних форм выражения концентрации в другие
- •Молярная масса эквивалента серной кислоты
- •Отношение между эквивалентными концентрациями и объемами растворов реагирующих веществ
- •Смешивание растворов разных концентраций
- •Задания.
- •Тема 9 Ионные реакции обмена
- •Задания
- •Тема 10 Гидролиз солей
- •Электролитическая диссоциация воды. Водородный показатель
- •Гидролиз солей
- •Гидролиз соли, образованной сильным основанием и слабой кислотой
- •Совместный гидролиз двух солей
- •Задания
- •Тема 11 Окислительно-восстановительные реакции
- •Классификация окислительно-восстановительных реакций
- •Задания
- •Тема 12 Гальванические элементы. Аккумуляторы
- •Задания
- •Тема 13 Электролиз. Законы Фарадея
- •Электролиз расплава
- •Электролиз водного раствора
- •Задания
- •Тема 14 Коррозия металлов
- •Задания
- •Тема 15 Химические свойства некоторых металлов и их соединений
- •Задания
- •Тема 16 Органические соединения. Полимеры
- •Стандартные электродные потенциалы некоторых окислительно-восстановительных систем
- •Варианты контрольных работ
Тема 6 Химическое сродство
При решении задач см. таблицу 2.
Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты.
Система с одной стороны стремится к упорядочению (агрегации), к уменьшению энтальпии, с другой – к беспорядку (деагрегации). Первая тенденция растет с понижением, а вторая с повышением температуры. Тенденцию к беспорядку характеризует величина энтропия (S).
Она отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает при нагревании, испарении, плавлении, расширении газа и т.п. Процессы, связанные с упорядочением системы: конденсация, кристаллизация, сжигание и т.п. – ведут к уменьшению энтропии.
Энтропия являются функцией состояния, т.е. ее изменение ΔS зависит только от начального и конечного состояния и не зависит от пути перехода.
По закону Гесса и следствию из него
ΔS298 = Σ νS0298 (продук.) - Σ νS0298 (исход)
Т.к. энтропия изменяется с повышением температуры, то можно считать, что мера беспорядка ΔS. Энтропия выражается в Дж/моль. Движущая сила процесса складывается из 2 стремлений - к упорядоченности (Н) и стремлению к беспорядку (S).
Движущая сила процесса называется изобарно-изотермическим потенциалом (энергией Гиббса) ΔG
ΔG = ΔН - ТΔS
Мерой химического сродства является убыль энергии Гиббса (Δ G), которая зависит от природы вещества, его количества, и от температуры. Энергия Гиббса – это функция состояния системы.
ΔGх.р. = Σ νΔG0298 (обр.)(прод) - Σ νΔG0298обр(исх).
Самопроизвольно идут процессы в сторону уменьшения энергии Гиббса (ΔG<O) т.е. если ΔG<O, то процесс практически осуществим, если ΔG>O, то процесс самопроизвольно протекать не может.
Пример 1 Прямая или обратная реакция будет протекать при стандартных условиях в системе СН4(г) + СО2(г) = 2СО(г) + 2 Н2(г)
Р е ш е н и е: Вычислим ΔG прямой реакции
ΔG298 = Σ νΔG02988 прод. - Σ νΔG0298исх
ΔG298 = 2х (- 137,27 + 210) – (- 50,79 – 394,38) = + 170,63 кДж
т.к. Δ G298 > O – процесс самопроизвольно протекать не может при 298 К, следовательно протекать может обратная реакция.
Пример 2. На основании данных таблицы, вычислите ΔH, ΔS и ΔG реакции, протекающей по уравнению
Fe2O3(к) + 3С(графит) = 2 Fe(к) + 3CO (г)
Возможна ли реакция восстановления Fe2O3 при температуре 500 и 1000 К.
Р е ш е н и е: ΔНх.р.= [3(-110,52) +2,0] -[-822,10 + 3,0] = - 331,56 – 882,0 = + 490,54 кДж
ΔSх.р. = (2х27,2 + 3х197,91) – (89,96 + 3х5,69) = 541,1 Дж/К
Энергия Гиббса при 500 К
ΔG = 490.54 кДж –500 541,1/1000= + 219,99 к Дж, ΔG > O - процесс не возможен.
Энергия Гиббса при 1000 К
ΔG = 490,54 - 1000 х541,1/1000= - 50,56 кДж, ΔG < O - процесс возможен
Пример 3. Восстановление Fe2O3 водородом протекает по уравнению
Fe2O3(к) + 3H2(г) = 2Fe(к) + 3Н2О(г); ΔНо = +96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии ΔSo =+0,1387 кДж/моль-град? При какой температуре начнется восстановление оксида железа(III)?
Решение. Вычисляем изменение энергии Гиббса реакции:
ΔGo = ΔHo – TΔSo = +96,61 - 298· 0,1387 = +55,28 кДж.
Так как ΔG° > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой ΔG° = 0:
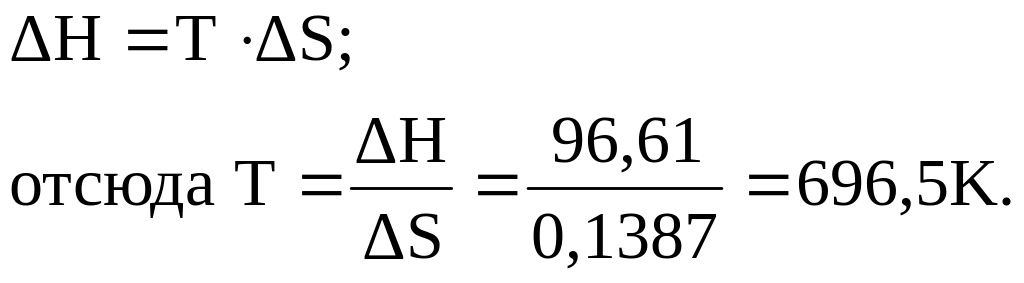
Следовательно, при температуре ≈696,5К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
