
Галогениды углерода
В связи с тем, что электроотрицательности углерода и галогенов имеют близкие значения и сами по себе высоки, это определяет ковалентный характер связи С – Г в тетрагалогенидах углерода. Из таблицы видно, что в соответствии с их молекулярной структурой тетрафторид углерода – газ, тетрахлорид – жидкость при обычных условиях, а тетрабромид и тетрайодид – твердые легкоплавкие кристаллические вещества. Реакционная способность СГ4 увеличивается от тетрафторида к тетрайодиду, энергия связей С – Г в том же ряду уменьшается.
CГ4 |
Tпл ºС |
Tкип ºС |
Реакционная способность |
ΔfНº298, кДж/моль |
Энергия связи С-Г, кДж/моль |
Окраска |
CF4 |
−184 |
−128 |
Химически инертен |
−933, 7 |
487 |
Бесцветная |
CCl4 |
−23 |
+77 |
Реагирует с оксидами, гидридами, нерастворим в воде |
−102, 9 |
340 |
Бесцветная |
CBr4 |
+94 |
+187 |
Растворяется в неполярных растворителях |
+79, 5 |
285 |
Бледно-желтая |
CI4
|
+171 |
Раз-лагает-ся |
При нагревании разлагается |
− |
214 |
Светло-красная |
Галогениды углерода, особенно фторид и хлорид, устойчивы к гидролизу. С термодинамической точки зрения, процесс СГ4 (г.)+ 2Н2О(г.) = СО2 (г.) + 4HCl (г.)
возможен, но кинетически затруднен в обычных условиях – координационно насыщенный атом углерода не склонен присоединять молекулы воды.
Ценным свойством CCl4 является его способность растворять малополярные соединения. Негорючесть CCl4 (в отличие от большинства малополярных растворителей) позволяет использовать его как рабочее вещество в огнетушителях.
Соединения с серой, азотом.
Дисульфид углерода CS2 в обычных условиях - летучая бесцветнвя жидкость (Тпл= – 111,6ºС, Ткип= + 46,3ºС). Получают его взаимодействием паров серы с раскалённым углём. Сероуглерод - эндотермическое соединение, легко окисляется, при небольшом нагревании воспламеняется на воздухе:
CS2 + 3O2 = CO2 + 2SO2
В воде CS2 не растворяется, при 150ºС гидролизуется до CO2 и H2S. Сероуглерод - хороший растворитель органических веществ, фосфора, йода, серы. Основная масса CS2 применяется в производстве шёлка, а также в качестве средства для борьбы с вредителями сельского хозяйства. Токсичен.
Сульфидокарбонаты (тиокарбонаты) можно получить взаимодействием сероуглерода с основными сульфидами: К2S + CS2 = K2[CS3]
Тиокарбонат водорода H2CS3 – маслянистая жидкость(Тпл= -31ºС). Образуется при действии на соответствующие соли соляной или серной кислот:
K2CS3 + 2HCl = H2CS3 + 2KCl
Водный раствор H2CS3 - слабая тиоугольная кислота, постепенно разлагается водой, образуя угольную кислоту и сероводород: H2CS3 + 3H2O = H2CO3 + H2S
Строение аниона CS32–:
┌ S
S┐2-
S
S┐2-
│
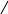 С │
С │
└ S ┘
Азотсодержащие соединения
Дициан (CN)2 – бесцветное легковоспламеняющееся газообразное вещество. Молекула имеет линейное строение, содержит две тройные связи азот-углерод, образуется из двух радикалов •CN.
:N ≡ C − C ≡ N:
По химическим свойствам похож на галогены: растворяется в воде и щелочах с диспропорционированием: (CN)2 + H2O = HCN + HOCN.
Однако в отличие от галогенов дициан обладает ярко выраженными восстановительными свойствами, благодаря углероду, который здесь имеет степень окисления +2:
(CN)2 + О2 = СО2 + N2; (CN)2 + Cl2 = CNCl.
Дициан проявляет и окислительные свойства: (CN)2 + Н2 = 2НCN.
Дициан получают: AgCN→(CN)2+Ag; CuSO4 + KCN→(CN)2 + CuCN + K2SO4
Цианистый водород – газ, хорошо растворяется в воде с образованием синильной кислоты НCN. В водных растворах синильная кислота диссоциирует слабо (Кд = 7∙ 10−10), поэтому ее соли подвергаются гидролизу.
Получение: СО + NH3 → НCN + Н2О или СН4 +О2 + NH3 → НCN + H2O
Синильная кислота и ее соли характеризуются восстановительными свойствами: 2НCN + О2 = 2 HOCN; HCN + S = HSCN.
Ион CN− изоэлектронен с молекулой СО, значит является активным σ- донором и π-акцептором и поэтому образует прочные связи с донорами, выступая в роли лиганда. СО и CN− - сильнейшие яды, разрушающие гемоглобин и лишающие тем самым кровь переносить кислород.
Fe+3 + 6CN− → [Fe(CN)6]3─
Оксо- и тиоцианаты (роданиды) и цианамиды
Оксо- и тиоцианаты (роданиды) и цианамиды – это соединения, в состав которых входят ионы OCN− , SCN− и NCN−2 соответственно. Эти ионы изоэлектронны молекуле СО2 и имеют такую линейную форму, т.к. атом углерода находится в sp-гибридном состоянии.
Благодаря склонности атомов серы к образованию гомоцепочек может получиться соединение диродан NCS – SCN, которое проявляет свойства несильного окислителя и несильного восстановителя:
(SCN)2 +O2 +H2O → HCN + H2SO4; (SCN)2 + H2 → 2HSCN.
Соответствующие этим анионам тиоциановая HSCN, циановая HOCN и цианамидная H2NCN кислоты – соответственно сильная, слабая и очень слабая кислоты. Роданид- и оксоцианат-ионы могут выступать в роли лигандов в комплексных соединениях.
Для циановой HOCN кислоты известны две таутомерные формы:
H–O–C≡N ↔ H–N=C=O и это равновесие при комнатной температуре смещено вправо.
Карбамат аммония, карбамид
При взаимодействии аммиака и угольной кислоты в водной среде образуется карбонат аммония (NH4)2CO3: 2NH3 + Н2CO3 ↔ (NH4)2CO3.
Если реакция взаимодействия углекислого газа и аммиака проходит в газовой фазе, то образуется так называемый карбамат аммония:
2NH3 + CO2 = NH4ОCONH2.
В карбамате аммония протон одной гидроксильной группы угольной кислоты замещен на ион аммония, а вторая гидроксильная группа целиком замещена на амидную группировку – NH2.
Если в угольной кислоте обе гидроксогруппы замещены на амидогруппу, то получается мочевина или карбамид (NH2)2CO, азотсодержащее удобрение, особо ценное для кислых почв.
