
- •Технічний аналіз, стандартизація і сертифікація неорганічних речовин
- •3 Аналіз неорганічних речовин методом 42
- •4 Аналіз неорганічних речовин методом 48
- •Охорона праці та техніка безпеки в хімічних лабораторіях
- •Основні вимоги техніки безпеки під час виконання лабораторних робіт
- •1Аналіз неорганічних речовин методом кислотно-основного титрування
- •1.1Визначення концентрації розчинів кислот та лугів
- •1.2Аналіз аміачної води методом зворотного титрування
- •1.6 Визначення вмісту фосфорної та сульфатної кислот у їх суміші
- •2Аналіз неорганічних речовин методом комплексонометричного титрування
- •3Аналіз неорганічних речовин методом титрування осадження
- •Стислі теоретичні відомості
- •4Аналіз неорганічних речовин методом окислення-відновлення
- •Стислі теоретичні відомості
- •4.1 Аналіз сульфурвмісної руди на вміст сірки йодометричним методом
- •4.2 Визначення купруму у мідному купоросі
- •4.3 Аналіз суміші сульфіду, сульфату та тіосульфату натрію
- •5Потенціометричний аналіз у хтнр
- •Стислі теоретичні відомості
- •5.1 Пряма потенціометрія (йонометрія)
- •5.1.1 Вимірювання рН розчину лугу за допомогою Іонометру ев-74
- •5.2 Потенціометричне титрування однокомпонентних розчинів
- •5.3 Визначення фторидів з використанням фтор-селективного електрода
- •5.4 Визначення нітрату методом добавок
- •6Оптичні методи у хтнр
- •Стислі теоретичні відомості
- •6.1 Визначення показника заломлення
- •6.2 Колориметрія та фотометрія в аналізі неорганічних речовин
- •6.3 Візуальний аналіз
- •6.5 Мікроскопія
- •7Аналіз газових сумішей
- •Стислі теоретичні відомості
- •7.1 Газоволюметрія
- •7.2 Аналіз so2 в газовій суміші
- •7.3 Визначення вмісту компонентів газової суміші. Метод поглинання та спалювання
- •7.4 Визначення вмісту аміаку та оксидів азоту в апс. Метод евакуйованих колб
- •8Аналіз нафтопродуктів
- •Стислі теоретичні відомості
- •8.1 Визначення температури спалаху і займання у відкритому приладі
- •8.2 Визначення температури спалаху в закритому приладі
- •8.3 Визначення в’язкості нафтопродуктів
- •8.4 Визначення вмісту механічних домішок
- •9Гравіметричний аналіз неорганічних речовин
- •Стислі теоретичні відомості
- •9.1 Визначення вмісту кристалізаційної води в хлориді барію
- •9.2 Визначення гігроскопічної води
- •9. 3 Визначення вмісту заліза в солі Мора
- •9.4 Визначення кальцію в карбонатах
5Потенціометричний аналіз у хтнр
Мета роботи: ознайомитися з теоретичними основами методу потенціометричного титрування, вивчити основні різновиди методу, що застосовуються в хімічній технології неорганічних речовин, провести хімічний аналіз досліджуваних сполук із застосуванням даного методу, виконати необхідні розрахунки та зробити висновки.
Стислі теоретичні відомості
Потенціометричний метод аналізу оснований на використанні залежності електричного сигналу (потенціалу) спеціального датчика, який називають вимірювальним електродом, від складу аналізованого розчину.
Потенціал електрода E пов'язаний з активністю та концентрацією речовин, що беруть участь в електродному процесі, рівнянням Нернста:
-
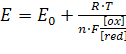 ,
,(5.1)
де E0 – стандартний потенціал редокс-системи;
R – універсальна газова стала, рівна 8,312 Дж / (моль·К);
T – абсолютна температура, К;
F – стала Фарадея, рівна 96485 Кл/моль;
n – число електронів, які беруть участь в електродній реакції;
[Ox], [red] – молярні концентрації окиcненої та відновленої форм редокс-системи.
Підставивши T = 298,15 і числові значення констант, отримаємо для 25° C:
-
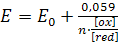 ,
,(5.2)
Для потенціометричних вимірів використовують електрохімічні ланцюги, що мають два електроди: індикаторний і електрод порівняння. Якщо обидва електроди занурені в аналізований розчин, то такий ланцюг називається ланцюгом без переносу. Якщо ж електрод порівняння з’єднують з аналізованим розчином через рідинний контакт (солевий місток), то ланцюг називається ланцюгом з переносом.
Розрізняють пряму потенціометрію – безпосереднє вимірювання рівноважного потенціалу і знаходження активності йонів в розчині, і побічну – потенціометричне титрування – реєстрування зміни потенціалу в процесі проходження реакції між досліджуваною речовиною і титрантом. В потенціометричному титруванні використовують реакції основних типів: кислотно-основні, окисно-відновні і комплексоутворення, а також процеси осадження. Індикаторний електрод при цьому обирають в залежності від типу хімічної реакції і природи потенціалвизначаючих іонів.
Пряма потенціометрія (іонометрія)
 Для
визначення електрорушійної сили (ЕРС)
гальванічних елементів з йонселективним
електродом (ІСЕ) найбільш часто
використовують електронні вольтметри
з високим вхідним опором (іонометри,
рН-метри) різних марок.
Для
визначення електрорушійної сили (ЕРС)
гальванічних елементів з йонселективним
електродом (ІСЕ) найбільш часто
використовують електронні вольтметри
з високим вхідним опором (іонометри,
рН-метри) різних марок.
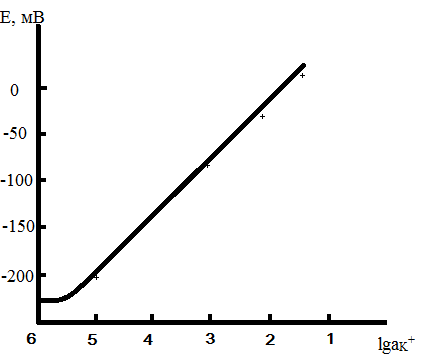
Рисунок 5.1 – Електродна функція калій-селективного електроду
При роботі з ІСЕ необхідна його попередня калібровка – визначення залежності між потенціалом електрода і активністю або концентрацією досліджуваних йонів. Для побудови градуюваного графіку в координатах Е-раі (Е-рсі) використовують стандартні розчини досліджуваних речовин. Найчастіше використовують метод послідовного розбавлення початкового розчину дистильованою водою.
За даними калібровки ІСЕ визначають наступні електрохімічні характеристики:
а) область Нернста електродної функції – інтервал прямолінійної залежності потенціалу від активності (концентрації) потенціалвизначаючих йонів;
б) крутизну електродної функції – кутових коефіцієнт нахилу графіка;
в) межу виявлення потенціал визначаючого йона;
г) час відгуку ІСЕ – час досягнення стаціонарного потенціалу;
д) селективність електроду відносно досліджуваного іону в присутності сторонніх йонів.
Визначення pH розчину з використанням скляного електрода
Для визначення pH використовують гальванічний елемент, що складається з скляного індикаторного електрода і хлорид-срібного електрода порівняння.
Перед початком визначення pH новий скляний електрод повинен бути витриманим не менше доби в 0,1 М розчині HCl або в дистильований воді. Хлорид-срібний електрод, в свою чергу, має бути витриманий в насиченому розчині KCl.
Перевірку електродів і налаштування pH-метра проводять за буферними розчинами. Якщо використовується один буферний розчин, то бажано вибирати той, pH якого знаходиться в тому ж діапазоні, що і pH досліджуваного розчину. Похибка вимірювання не повинна бути більшою за 0,05 pH.
Перед визначенням прилад підключають до мережі і дають прогрітися протягом 30 хв. Прилад налаштовують за двома буферними розчинами – в кислій і лужній областях pH. Для цього наливають в стакан відповідний буферний розчин, занурюють в нього електроди, фіксують значення pH і, якщо необхідно, коректують його за допомогою спеціальних важелів (кнопок), що знаходяться на панелі приладу. Перед кожним зануренням в буферний або досліджаваний розчин електроди промивають дистильованою водою і обережно видаляють надлишок води з їх поверхні фільтрувальним папером. Вимірюють величину pH в аналізованому розчині. Після завершення роботи виключають прилад. Електроди промивають дистильованою водою і залишають їх зануреними у воду.
Потенціометричне титрування
За перебігом більшості реакцій можна простежити потенціометрично. Для цього необхідно тільки, щоб в реакції приймав участь будь-який йон (вводиться або виводиться), для якого існує підходящий електрод.
Потенціометричне титрування грунтується на реєстрації зміни потенціалу між досліджуваним компонентом і титрантом. Кінцеву точку титрування (КТТ) знаходять за стрибком потенціалу, що відповідає моменту закінчення реакції.
Аналіз слід починати з проведення орієнтуючого титрування і знаходження об’єму титранту, що приблизно відповідає КТТ, провівши наступні операції.
1. Прилад (рН-метр, іонометр) приводять в робочий стан відповідно інструкції.
2. Отриманий аналізований розчин розводять до мітки в мірній колбі і ретельно перемішують.
3.
Аліквоту розчину переносять піпеткою
в чистий стакан місткістю 100![]() 150 см3
і, якщо це передбачено методикою, додають
необхідні компоненти.
150 см3
і, якщо це передбачено методикою, додають
необхідні компоненти.
4. Стакан з розчином розміщують в центрі столику для титрування, що обертається, в стакан занурюють індикаторний електрод і електрод порівняння, центрують електроди.
5. Бюретку заповнюють розчином титранту і закріплюють в штативі таким чином, щоб кінчик бюретки був опущений в стакан, але не торкався до поверхні розчину, що титрується.
6.
Включають магнітну мішалку і проводять
орієнтуюче титрування, додаючи до
бюретки по 1,00 см3
розчину титранта і вимірюючи E
(рН)
після кожної його порції. Відліки ЕРС
проводять тільки після досягнення
постійного значення (зміна ЕРС не повинна
перевищувати 2 ![]() 3 мВ протягом 1 хв). Титрування продовжують
до тих пір, поки зміна ЕРС або рН не
досягне свого максимального значення,
а при подальшому додаванні нових порцій
розчину реагенту поступово не зменшить
до малої величини. Результати титрування
записують по формі, приведеній в таблиці
3.1.
3 мВ протягом 1 хв). Титрування продовжують
до тих пір, поки зміна ЕРС або рН не
досягне свого максимального значення,
а при подальшому додаванні нових порцій
розчину реагенту поступово не зменшить
до малої величини. Результати титрування
записують по формі, приведеній в таблиці
3.1.
Таблиця 5.1 – Форма бланку для запису результатів орієнтовного титрування
Об’єм розчину титранту V, см3 |
ЕРС, мВ (рН) |
ΔЕ, мВ (ΔрН) |
0 |
|
|
1 |
|
|
2 |
|
|
Після проведення орієнтовного титрування приступають до точного титрування в області стрибка Е (рН), для цього після промивання електроду порівняння і індикаторного електроду в чистий стакан вносять нову аліквоту досліджуваного розчину і виконують операції, що описані вище.
До титрованого розчину додають титрант в об’ємі на 1 см3 менший (V1), ніж це відповідає значенню КТТ, знайденому при орієнтовному титруванні. Після досягнення постійного значення потенціалу продовжують титрування розчином реагенту по краплинах для знаходження КТТ при мінімально можливому об’ємі додавання титранта. Результати титрування записують по формі, вказаній в таблиці 3.2, виражаючи об’єм титранта кількістю крапель. Після досягнення стрибка Е, впевнюються в зменшенні і малій зміні ΔЕ(ΔрН) при подальшому титруванні краплинами. Відмічають загальний об’єм розчину затраченого на титрування (V2).
Таблиця 5.2 – Форма бланку для запису результатів точного титрування
Об'єм розчину титранту V, краплі |
ЕРС, мВ (рН) |
ΔЕ, мВ (ΔрН) |
V1 |
|
|
2 к |
|
|
4 к |
|
|
… |
|
|
V2 |
|
|
При диференційному визначення суміші двох і більше компонентів в процесі орієнтовного титрування (порціями розчину по 1 см3) визначають відповідну кількість стрибків потенціалу в області кожної КТТ. Далі в цих областях проводять точне титрування. Вміст другого компоненту знаходять за різницею: від загального об’єму розчину титранта, витраченого на сумарне визначення двох компонентів, віднімають об’єм, витрачений для досягнення першої КТТ.
Розрахунковий та графічний способи визначення ККТ
Знаючи додану кількість крапель (N), розраховують об’єм однієї краплі (см3):
-
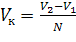 ,
,(5.3)
Об’єм розчину реагенту, що точно відповідає КТТ (Vктт) розраховують за формулою:
-
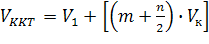 ,
,(5.4)
де m – кількість крапель, доданих до стрибка потенціалу;
n – кількість крапель, що складають порцію розчину титранту, що викликає стрибок ΔЕ.
Кількість досліджуваного компоненту m (г) розраховують за формулою:
-
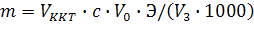
(5.5)
де ![]() – місткість мірної колби з аналізованим
розчином;
– місткість мірної колби з аналізованим
розчином;
![]() –
концентрація розчину титранта, М;
–
концентрація розчину титранта, М;
![]() – молярна маса еквіваленту визначуваного
компоненту;
– молярна маса еквіваленту визначуваного
компоненту;
V3 – об’єм аліквотної частини аналізованого розчину, взятої для титрування.
Окрім розрахункової, існують графічні способи визначення КТТ, що полягають в побудові кривих титрування трьох типів.

Рисунок 5.2 – Інтегральна крива потенціометричного титрування
Графічно зображують залежність E (pH) від об’єму титранта (V), тобто будують інтегральну криву (рисунок 5.2).Точка перегину кривої відповідає КТТ. Для знаходження перегину проводять дві паралельні дотичні до верхньої і нижньої частин кривої і з’єднують їх прямою таким чином, щоб точка перетину її з кривою титрування ділила її на дві рівні частини (точка А на рисунку 5.2).
Точка перетину перпендикуляра, опущеного з точки А, з віссю абсцис дає об’єм титранта, що відповідає КТТ.
Більш простим і точним способом находження КТТ є графічне зображення залежності величин першої похідної ΔЕ/ΔV від об’єму доданого титранта – диференціальна крива (рисунок 5.3 А).
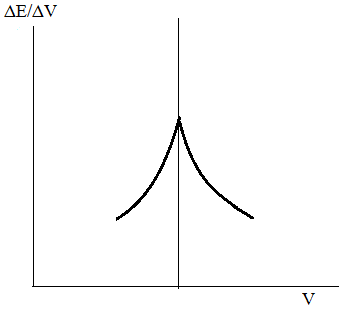

А Б
Рисунок 5.3 – Диференціальна крива потенціометричного титрування (А) та крива титрування за другою похідною (Б)
В такому випадку крива має максимум, що відповідає точці КТТ. Перпендикуляр опущений з точки максимуму на вісь абсцис, показує об’єм титранта, що витрачається для закінчення реакції.
Для найбільш точного знаходження КТТ, особливо у випадку асиметричних кривих титрування, або при малому стрибку потенціалу, необхідно користуватись другою похідною Δ2Е/ΔV2.
Для знаходження КТТ за кривою залежності Δ2Е/ΔV2 від V з’єднують кінці обох гілок кривої, що знаходяться з різних сторін вісі абсцис. Точка перетину отриманої кривої з віссю абсцис дає об’єм титранта, що відповідає КТТ (рисунок 5.3 Б).
Потенціометрична індикація КТТ дозволяє диференційовано титрувати суміші кислот і основ, або багатоосновних кислот (основ) з похибкою до 0,1%, якщо К1:К2 ≥ 104, при цьому константа дисоціації слабкої кислоти (основи) повинна бути не нижче n·10-8.
Кислотно-основне титрування виконується з використанням рН-метра або в автоматичних режимах на автотитраторах.
В окисно-відновному титрування в якості індикаторного зазвичай використовують електрод з інертного металу (платина, золото). Для отримання чіткого стрибка на кривій титрування необхідно, щоб різниця стандартних потенціалів окисно-відновних пар титрованого компоненту і титранту була досить великою ΔЕ0 > 0,36 В при титруванні з похибкою 0,1%, якщо n1 = n2 = 1.
Для здійснення диференційного визначення компонентів в суміші необхідне здійснення двох умов:
1. Титровані компоненти повинні належати до оборотних окисно-відновних систем.
2. Стандартні потенціали окисно-відновних пар, що відповідають послідовно титрованим компонентам, повинні достатньо відрізнятися як між собою, так і від Е0 титранта (Е0т).
Окисно-відновне титрування виконують з використанням потенціометра, іонометра, або рН-метра (в режимі вимірювання потенціалу).
Для проведення осаджувального титрування використовують електроди першого і другого роду, або іон-селективні електроди, обернені до аналізованого іону або титранту.
Диференційне визначення суміші декількох іонів можливе, якщо значення добутків розчинності, що послідовно утворюються при титруванні осадів, відрізняються не менше, ніж в 1000 разів (похибка титрування 0,1%) при рівності початкових концентрацій титрованих компонентів.
Для проведення комплексонометричного титрування в якості індикаторних електродів можна використовувати відповідні електроди І-го роду, або ІСЕ, обернені відносно досліджуваного компоненту. В ряді випадків необхідне додавання в аналізований розчин потенціометричних індикаторів, що вводяться в невеликій кількості і викликають відгук індикаторного електрода, або до, або після досягнення КТТ.
