
- •6. Квантовые числа
- •7.Типы атомных орбиталей.
- •8. Распределение электронов в атоме
- •12. Электронные конфигурации атомов и ионов.
- •13. Периодический закон д. И. Менделеева.
- •15. Структура периодической системы: период, ряд, группа и подгруппа.
- •17. Энергия ионизации, сродство к электрону, электроотрицательность Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •19.Механизм образования ковалентной связи. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •20 Метод валентных связей
- •21 Свойства ковалентной связи
- •22. Гибридизация атомных орбиталей, геометрическая структура молекул.
- •23. Ковалентная связь полярная и неполярная
- •24. Полярность молекул.
- •25. И 26 ионная связь. Ионная химическая связь
- •28. Окислительно- восстановительные процессы.
- •29. 30 Окислители и восстановители.
- •33Основные термодинамические понятия: система, гомогенная и гетерогенная система, изолированная закрытая система, система открытая, параметры состояния системы, термодинамические функции.
- •34 Внутренняя энергия и энтальпия
- •36 Эндотермические и экзотермические процессы.
- •37 Закон Гесса и следствия вытекающие из него Закон Гесса
- •Следствия закона Гесса
- •38 Стандартная энтальпия образования сложного вещества.
- •39Тепловой эффект реакции
- •40 41 Энтропия и изобарно-изотермический потенциал.
- •42 Химическая кинетика.
- •43 Скорость химических реакций
- •44.45 Энергия активации. Уравнение Аррениуса Уравнение Аррениуса
- •46 Зависимость скорости реакции от концентрации реагирующих веществ и давления.
- •47 Закон действующих масс
- •48 И 49 кинетическое уравнение. Константа скорости реакции.
- •50.Влияние темпер. На скорость хим реакции, правило Вант-Гоффа. Влияние температуры на константу скорости реакции
- •51 52. Влияние катализатора на скорость реакции. Катализ
- •53, 54 И 55 Процессы обратимые и необратимые. Химическое равновесие. Константа химического равновесия.
- •56 И 57. Принцип Ле- Шателье. Влияние темпер, концентрации, давления и катализатора на смещение равновесия
- •58 Общая характеристика растворов .
- •59 Способы выражения концентрации растворов
- •60 Молярная, моляльная концентрация, массовая доля, молярная концентрация эквивалентов.
- •61 И 62 давление пара растворов. Закон Рауля для растворов неэлектролитов. Замерзание и кипение растворов
- •63 И 64 Понижение температуры замерзания и повышение температуры кипения раствора. Криоскопия и эбуллиоскопия.
- •65 И 66 осмос, осмотическое давление. Закон вант-Гоффа. Осмотическое давление
- •67 Теория электролитической диссоциации Аррениуса.
- •69Степень и константы диссоциации
- •68 Электролиты сильные и слабые.
- •70 Электролитическая диссоциация сильных и слабых электролитов: кислот, оснований, солей в воде
- •71 Ступенчатая диссоциация.
- •72 Ионные реакции. 73 условия течения реакций обмена в растворах электролитах.
- •74 Электролитическая диссоциация воды. Ионно-молекулярные равновесия
- •Правила составления уравнений ионно-молекулярных реакций
- •75 Ионное произведение воды(kw) 77 pH кислот и оснований. Кислотно-основные равновесия. Водородный показатель рН
- •76 Водородный показатель pH как мера кислотности и щелочности среды.
- •78Понятия об индикаторах.
- •79 Окраска индикаторов в различных средах.
- •80 Гидролиз солей
- •81 Соли гидролизующиеся по аниону катиону, не гидролизирующиеся соли.
- •82 Изменение пш среды при гидролизе.
- •83 Влияние внешних факторов на степень полноты гидролиза
- •84 Электродный потенциал, механизм его возникновения.
- •85 Уравнение Нернста. Уравнение Нернста
- •86 Электрохимический ряд напряжений металлов.
- •87 Типы электродов
- •Механизм возникновения электродных потенциалов и определение их величин
- •88 Гальванические элементы. 90 поляризация
- •89 Измерение электродвижущей силы.
- •91 Химические источники тока: аккумуляторы, топливные элементы.
- •92 Коррозия металлов.
- •93 Виды коррозии.
- •Химическая коррозия
- •94 Механизм Электрохимической коррозии Электрохимическая коррозия
- •95.Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •97 Аналитический сигнал
- •98. Основы качественного и количественного анализа.
- •Количественный химический анализ
- •99 Качественные реакции на ионы
23. Ковалентная связь полярная и неполярная
1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например в молекуле PH3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
24. Полярность молекул.
Электрический момент диполя является мерой полярности молекулы. Между взаимодействующими атомами, которые различаются по электроотрицательности, возникают полярные связи. В результате смещения электронной плотности в сторону более электроотрицательного партнера происходит разделение «центров тяжести» положительного и отрицательного зарядов и возникает диполь, представляющий собой систему из двух равных и противоположных по знаку зарядов + и ‾, находящихся на определенном расстоянии l (длина диполя) друг от друга. Диполь выражают через электрический момент диполя , который представляет собой произведение заряда на длину диполя l: = l.
Например, строение линейной молекулы СО2, можно представить следующим образом:
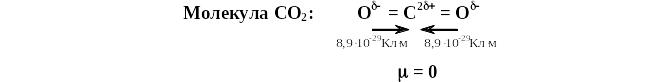
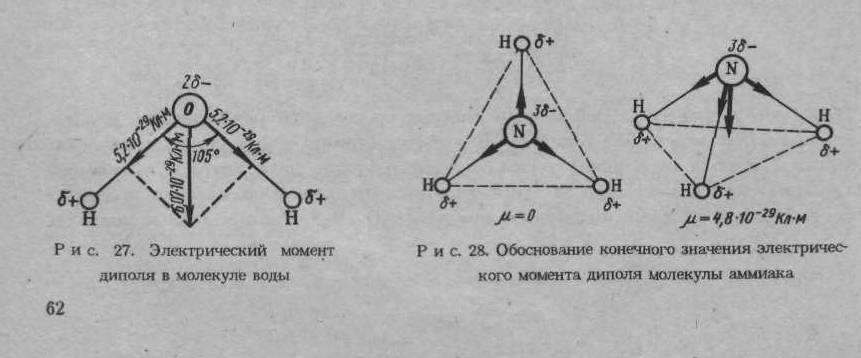
Направление электрического момента диполя условно принимают от отрицательного к положительному полюсу диполя. Классическим примером диполя могут служить угловая молекула воды, в которой электрические моменты диполя каждой связи О – Н равны 5,2 10-29 Кл м, а электрический момент диполя молекулы воды в целом составляет 6,07 10-29 Кл м. Следовательно, электрические моменты диполя связей складываются геометрически и связи О – Н должны быть направлены под углом 105 ° друг к другу (рис. 1.3.). Таким образом, существование электрических моментов диполей в молекулах и их величина определяются пространственной направленностью химической связи.
25. И 26 ионная связь. Ионная химическая связь
В
1916 г. В. Косселем была высказана идея о
том, что при химическом взаимодействии
разнородные атомы стремятся приобрести
конфигурацию внешней оболочки благородных
газов. Это достигается отдачей или
присоединением электронов нейтральными
атомами химических элементов. Атомы,
отдающие свои электроны, превращаются
в положительно заряженные ионы (катионы).
Атомы, присоединяющие электроны,
превращаются в отрицательно заряженные
ионы (анионы). Химическая связь
осуществляется за счет электростатического
притяжения образовавшихся разноименных
ионов. В этом заключается сущность
теории ионной связи.

Рис. 1.4. Основные виды химической связи.
Такая связь возникает лишь в случае большой разности ЭО атомов, например между катионами s – металлов первой и второй групп ПС и анионами неметаллов VI и VII групп (LiF, CsCl, K2O и др.)
Са0 − 2ē = Са2+
1s2 2s2 2р6 3s2 3р64s2 1s2 2s2 2р63s2 3р6 [Ar]
2 ē 8 ē
О0 + 2 ē = О2‾
1s22s2 2р4 1s22s2 2р6 [Ne]
6 ē 8 ē
Са2+ = О2‾
Самопроизвольная передача электрона от металлического атома к атому неметалла в действительности вряд ли осуществляется. Дело в том, что потенциал ионизации первого порядка даже для наиболее активных щелочных металлов больше, чем сродство к электрону типичных электроотрицательных элементов. С этой точки зрения оказывается энергетически невыгодным образованием ионной связи в молекуле Na – Cl из элементов. Идеальная же ионная связь наравне с идеальными газами представляет собой типичный пример научной абстракции.
V
