- •6. Квантовые числа
- •7.Типы атомных орбиталей.
- •8. Распределение электронов в атоме
- •12. Электронные конфигурации атомов и ионов.
- •13. Периодический закон д. И. Менделеева.
- •15. Структура периодической системы: период, ряд, группа и подгруппа.
- •17. Энергия ионизации, сродство к электрону, электроотрицательность Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •19.Механизм образования ковалентной связи. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •20 Метод валентных связей
- •21 Свойства ковалентной связи
- •22. Гибридизация атомных орбиталей, геометрическая структура молекул.
- •23. Ковалентная связь полярная и неполярная
- •24. Полярность молекул.
- •25. И 26 ионная связь. Ионная химическая связь
- •28. Окислительно- восстановительные процессы.
- •29. 30 Окислители и восстановители.
- •33Основные термодинамические понятия: система, гомогенная и гетерогенная система, изолированная закрытая система, система открытая, параметры состояния системы, термодинамические функции.
- •34 Внутренняя энергия и энтальпия
- •36 Эндотермические и экзотермические процессы.
- •37 Закон Гесса и следствия вытекающие из него Закон Гесса
- •Следствия закона Гесса
- •38 Стандартная энтальпия образования сложного вещества.
- •39Тепловой эффект реакции
- •40 41 Энтропия и изобарно-изотермический потенциал.
- •42 Химическая кинетика.
- •43 Скорость химических реакций
- •44.45 Энергия активации. Уравнение Аррениуса Уравнение Аррениуса
- •46 Зависимость скорости реакции от концентрации реагирующих веществ и давления.
- •47 Закон действующих масс
- •48 И 49 кинетическое уравнение. Константа скорости реакции.
- •50.Влияние темпер. На скорость хим реакции, правило Вант-Гоффа. Влияние температуры на константу скорости реакции
- •51 52. Влияние катализатора на скорость реакции. Катализ
- •53, 54 И 55 Процессы обратимые и необратимые. Химическое равновесие. Константа химического равновесия.
- •56 И 57. Принцип Ле- Шателье. Влияние темпер, концентрации, давления и катализатора на смещение равновесия
- •58 Общая характеристика растворов .
- •59 Способы выражения концентрации растворов
- •60 Молярная, моляльная концентрация, массовая доля, молярная концентрация эквивалентов.
- •61 И 62 давление пара растворов. Закон Рауля для растворов неэлектролитов. Замерзание и кипение растворов
- •63 И 64 Понижение температуры замерзания и повышение температуры кипения раствора. Криоскопия и эбуллиоскопия.
- •65 И 66 осмос, осмотическое давление. Закон вант-Гоффа. Осмотическое давление
- •67 Теория электролитической диссоциации Аррениуса.
- •69Степень и константы диссоциации
- •68 Электролиты сильные и слабые.
- •70 Электролитическая диссоциация сильных и слабых электролитов: кислот, оснований, солей в воде
- •71 Ступенчатая диссоциация.
- •72 Ионные реакции. 73 условия течения реакций обмена в растворах электролитах.
- •74 Электролитическая диссоциация воды. Ионно-молекулярные равновесия
- •Правила составления уравнений ионно-молекулярных реакций
- •75 Ионное произведение воды(kw) 77 pH кислот и оснований. Кислотно-основные равновесия. Водородный показатель рН
- •76 Водородный показатель pH как мера кислотности и щелочности среды.
- •78Понятия об индикаторах.
- •79 Окраска индикаторов в различных средах.
- •80 Гидролиз солей
- •81 Соли гидролизующиеся по аниону катиону, не гидролизирующиеся соли.
- •82 Изменение пш среды при гидролизе.
- •83 Влияние внешних факторов на степень полноты гидролиза
- •84 Электродный потенциал, механизм его возникновения.
- •85 Уравнение Нернста. Уравнение Нернста
- •86 Электрохимический ряд напряжений металлов.
- •87 Типы электродов
- •Механизм возникновения электродных потенциалов и определение их величин
- •88 Гальванические элементы. 90 поляризация
- •89 Измерение электродвижущей силы.
- •91 Химические источники тока: аккумуляторы, топливные элементы.
- •92 Коррозия металлов.
- •93 Виды коррозии.
- •Химическая коррозия
- •94 Механизм Электрохимической коррозии Электрохимическая коррозия
- •95.Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •97 Аналитический сигнал
- •98. Основы качественного и количественного анализа.
- •Количественный химический анализ
- •99 Качественные реакции на ионы
21 Свойства ковалентной связи
А)Среди многих свойств ковалентной связи наиболее важны насыщаемость, поляризация и направленность. Насыщаемость химической связи — это то, что отличает ее от всех других видов взаимодействия частиц. Собственно, основные положения МВС, обменный и донорно-акцепторный механизмы ее образования — служат обоснованием насыщаемости химической связи. Именно насыщаемость ковалентной связи определяет стехиометрию молекулярных химических соединений
Ковалентная связь неполярна только для молекул и соединений, состоящих из одинаковых атомов. Абсолютное большинство соединений образуется сочетанием неодинаковых атомов. При этом происходит смещение связывающего электронного облака под влиянием одного из атомов − поляризация, результатом чего является полярная связь. Смещение связующего электронного облака происходит в сторону более электроотрицательного атома.
Таким образом, чем больше разность ОЭО компонентов соединения, тем более полярна ковалентная связь. Для галогенидов и оксидов металлов межатомная связь наиболее полярна потому, что галогены и кислород имеют высокие значения ОЭО.
Б)сигма- и пи-связи, направленность, и энергия связи.
Химическая связь, для которой линия, соединяющая атомные ядра, является осью симметрии связывающею электронною облака, называется -связью.-связь возникает при "лобовом" перекрывании атомных орбиталей. В молекуле этилена каждый атом углерода образует по три -связи: одну — друг с другом, а две другие — с двумя атомами водорода. Имеющиеся у атомов углерода негибридные орбитали образуют одну так называемую -связь. Химическая связь, для которой связывающее электронное облако имеет только плоскость симметрии, проходящую через атомные ядра, называется -связью. На рис. 1.10. -связь показана пунктиром. В действительности при образовании -связей происходит "боковое" перекрывание атомных орбиталей (рис).

Рис. 1.10. Строение молекулы этилена
энергия двойной связи меньше удвоенной энергии одинарной связи, которая всегда является -связью.
Приведенные примеры дают основание утверждать, что одинарная связь всегда является чистой или гибридной -связью. Двойная связь состоит из одной - и одной -связи.
Наконец, тройная связь слагается из одной - и двух -связей, расположенных перпендикулярно друг другу. Примером может являться молекула ацетилена (С2Н2) или азота, центральный атом подвергается sp – гибридизации, валентный угол в этой молекуле 180°, строение – линейное.
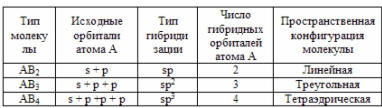
22. Гибридизация атомных орбиталей, геометрическая структура молекул.
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.