- •6. Квантовые числа
- •7.Типы атомных орбиталей.
- •8. Распределение электронов в атоме
- •12. Электронные конфигурации атомов и ионов.
- •13. Периодический закон д. И. Менделеева.
- •15. Структура периодической системы: период, ряд, группа и подгруппа.
- •17. Энергия ионизации, сродство к электрону, электроотрицательность Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •19.Механизм образования ковалентной связи. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •20 Метод валентных связей
- •21 Свойства ковалентной связи
- •22. Гибридизация атомных орбиталей, геометрическая структура молекул.
- •23. Ковалентная связь полярная и неполярная
- •24. Полярность молекул.
- •25. И 26 ионная связь. Ионная химическая связь
- •28. Окислительно- восстановительные процессы.
- •29. 30 Окислители и восстановители.
- •33Основные термодинамические понятия: система, гомогенная и гетерогенная система, изолированная закрытая система, система открытая, параметры состояния системы, термодинамические функции.
- •34 Внутренняя энергия и энтальпия
- •36 Эндотермические и экзотермические процессы.
- •37 Закон Гесса и следствия вытекающие из него Закон Гесса
- •Следствия закона Гесса
- •38 Стандартная энтальпия образования сложного вещества.
- •39Тепловой эффект реакции
- •40 41 Энтропия и изобарно-изотермический потенциал.
- •42 Химическая кинетика.
- •43 Скорость химических реакций
- •44.45 Энергия активации. Уравнение Аррениуса Уравнение Аррениуса
- •46 Зависимость скорости реакции от концентрации реагирующих веществ и давления.
- •47 Закон действующих масс
- •48 И 49 кинетическое уравнение. Константа скорости реакции.
- •50.Влияние темпер. На скорость хим реакции, правило Вант-Гоффа. Влияние температуры на константу скорости реакции
- •51 52. Влияние катализатора на скорость реакции. Катализ
- •53, 54 И 55 Процессы обратимые и необратимые. Химическое равновесие. Константа химического равновесия.
- •56 И 57. Принцип Ле- Шателье. Влияние темпер, концентрации, давления и катализатора на смещение равновесия
- •58 Общая характеристика растворов .
- •59 Способы выражения концентрации растворов
- •60 Молярная, моляльная концентрация, массовая доля, молярная концентрация эквивалентов.
- •61 И 62 давление пара растворов. Закон Рауля для растворов неэлектролитов. Замерзание и кипение растворов
- •63 И 64 Понижение температуры замерзания и повышение температуры кипения раствора. Криоскопия и эбуллиоскопия.
- •65 И 66 осмос, осмотическое давление. Закон вант-Гоффа. Осмотическое давление
- •67 Теория электролитической диссоциации Аррениуса.
- •69Степень и константы диссоциации
- •68 Электролиты сильные и слабые.
- •70 Электролитическая диссоциация сильных и слабых электролитов: кислот, оснований, солей в воде
- •71 Ступенчатая диссоциация.
- •72 Ионные реакции. 73 условия течения реакций обмена в растворах электролитах.
- •74 Электролитическая диссоциация воды. Ионно-молекулярные равновесия
- •Правила составления уравнений ионно-молекулярных реакций
- •75 Ионное произведение воды(kw) 77 pH кислот и оснований. Кислотно-основные равновесия. Водородный показатель рН
- •76 Водородный показатель pH как мера кислотности и щелочности среды.
- •78Понятия об индикаторах.
- •79 Окраска индикаторов в различных средах.
- •80 Гидролиз солей
- •81 Соли гидролизующиеся по аниону катиону, не гидролизирующиеся соли.
- •82 Изменение пш среды при гидролизе.
- •83 Влияние внешних факторов на степень полноты гидролиза
- •84 Электродный потенциал, механизм его возникновения.
- •85 Уравнение Нернста. Уравнение Нернста
- •86 Электрохимический ряд напряжений металлов.
- •87 Типы электродов
- •Механизм возникновения электродных потенциалов и определение их величин
- •88 Гальванические элементы. 90 поляризация
- •89 Измерение электродвижущей силы.
- •91 Химические источники тока: аккумуляторы, топливные элементы.
- •92 Коррозия металлов.
- •93 Виды коррозии.
- •Химическая коррозия
- •94 Механизм Электрохимической коррозии Электрохимическая коррозия
- •95.Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •97 Аналитический сигнал
- •98. Основы качественного и количественного анализа.
- •Количественный химический анализ
- •99 Качественные реакции на ионы
Сродство атома к электрону
Элементы, которые, вступая во взаимодействие, оттягивают на себя электроны, обладают окислительными свойствами, и эта способность характеризуется сродством к электрону. Количественной мерой сродства к электрону является энергия, которая выделяется при присоединении электрона к атому, и также измеряется в эВ или кДж/моль.
Сродство к электрону зависит от положения элемента в периодической системе. Наибольшие значения сродства к электрону имеют галогены, кислород, сера, наименьшее элементы с электронной конфигурацией s2 (Не, Ве, Мg, Zn), с полностью или наполовину заполненными р-подоболочками (Ne, Ar, Kr, N, P, As).
В целом, сродство атома к электрону возрастает в периодах от металлов к неметаллам, то есть слева направо, в группах сверху вниз уменьшается.
Электроотрицательность
Для характеристики способности атомов в соединениях притягивать к себе электроны, введено понятие электроотрицательности (ЭО). Учитывая, что эта способность атомов зависит от типа соединений, валентного состояния элемента, эта характеристика имеет условный характер. Однако её использование полезно для объяснения типа химических связей и свойств соединений.
Имеется несколько шкал электроотрицательности. Согласно Р. Малликену (США) электроотрицательностьравнаполусумме энергии ионизации и энергии сродства к электрону. Наименьшие значения ЭО имеют s-элементы 1 подгруппы, наибольшие значения р-элементы 7 и 6 групп.
Как правило, в периоде с увеличением порядкового номера элемента ЭО возрастает, а в группе убывает.
IV
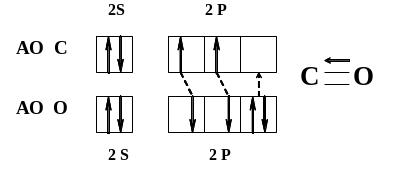
19.Механизм образования ковалентной связи. Обменный и донорно-акцепторный механизм образования ковалентной связи.
В широком смысле слова ковалентная связь — химическая связь между атомами, осуществляемая обобществленными электронами. Ковалентная связь является универсальным типом химической связи.
В настоящее время квантовая химия занимается вопросами раскрытия природы химической связи. Наибольшее распространение получили два квантово-химических способа приближенного расчета двух- и многоатомных систем с ковалентной связью: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
20 Метод валентных связей
Волновое уравнение Шрёдингера для стационарного состояния можно записать следующим образом: Н = Е, где Н – квантово-механический оператор полной энергии Гамильтона, - волновая функция электрона в атоме.
Результаты квантово-механического расчета молекулы водорода методом валентных связей с использованием различного числа волновых функций показывают, что главные положения МВС можно сформулировать так:
1) ковалентную связь образуют два электрона с антипараллельными спинами;
2) при образовании ковалентной связи происходит перекрывание волновых функций электронов и между взаимодействующими атомами увеличивается плотность электронного облака (15—20%), что приводит к уменьшению энергии системы;
3) ковалентная связь направлена в сторону максимального перекрытия электронных облаков взаимодействующих атомов (критерий наибольшего перекрывания).
Согласно МВС, пребывание двух электронов с антипараллельными спинами в поле двух ядер энергетически более выгодно, чем нахождение каждого электрона в поле своего ядра. Способ образования ковалентной связи, когда каждый из взаимодействующих атомов отдает по одному электрону для образования общей электронной пары, называется обменным.
Однако помимо обменного механизма образования ковалентной связи существует и другой, заключающийся в том, что один атом отдает в общее пользование неподеленную пару электронов, а партнер предоставляет свободную орбиталь. Первый называется донором, а второй — акцептором. Ковалентную связь, образующуюся за счет неподеленной пары электронов донора и свободной орбитали акцептора, называют донорно-акцепторной связью.Схематически ее образование может быть показано на примере образования молекулы монооксида углерода СО: