
- •6. Квантовые числа
- •7.Типы атомных орбиталей.
- •8. Распределение электронов в атоме
- •12. Электронные конфигурации атомов и ионов.
- •13. Периодический закон д. И. Менделеева.
- •15. Структура периодической системы: период, ряд, группа и подгруппа.
- •17. Энергия ионизации, сродство к электрону, электроотрицательность Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •19.Механизм образования ковалентной связи. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •20 Метод валентных связей
- •21 Свойства ковалентной связи
- •22. Гибридизация атомных орбиталей, геометрическая структура молекул.
- •23. Ковалентная связь полярная и неполярная
- •24. Полярность молекул.
- •25. И 26 ионная связь. Ионная химическая связь
- •28. Окислительно- восстановительные процессы.
- •29. 30 Окислители и восстановители.
- •33Основные термодинамические понятия: система, гомогенная и гетерогенная система, изолированная закрытая система, система открытая, параметры состояния системы, термодинамические функции.
- •34 Внутренняя энергия и энтальпия
- •36 Эндотермические и экзотермические процессы.
- •37 Закон Гесса и следствия вытекающие из него Закон Гесса
- •Следствия закона Гесса
- •38 Стандартная энтальпия образования сложного вещества.
- •39Тепловой эффект реакции
- •40 41 Энтропия и изобарно-изотермический потенциал.
- •42 Химическая кинетика.
- •43 Скорость химических реакций
- •44.45 Энергия активации. Уравнение Аррениуса Уравнение Аррениуса
- •46 Зависимость скорости реакции от концентрации реагирующих веществ и давления.
- •47 Закон действующих масс
- •48 И 49 кинетическое уравнение. Константа скорости реакции.
- •50.Влияние темпер. На скорость хим реакции, правило Вант-Гоффа. Влияние температуры на константу скорости реакции
- •51 52. Влияние катализатора на скорость реакции. Катализ
- •53, 54 И 55 Процессы обратимые и необратимые. Химическое равновесие. Константа химического равновесия.
- •56 И 57. Принцип Ле- Шателье. Влияние темпер, концентрации, давления и катализатора на смещение равновесия
- •58 Общая характеристика растворов .
- •59 Способы выражения концентрации растворов
- •60 Молярная, моляльная концентрация, массовая доля, молярная концентрация эквивалентов.
- •61 И 62 давление пара растворов. Закон Рауля для растворов неэлектролитов. Замерзание и кипение растворов
- •63 И 64 Понижение температуры замерзания и повышение температуры кипения раствора. Криоскопия и эбуллиоскопия.
- •65 И 66 осмос, осмотическое давление. Закон вант-Гоффа. Осмотическое давление
- •67 Теория электролитической диссоциации Аррениуса.
- •69Степень и константы диссоциации
- •68 Электролиты сильные и слабые.
- •70 Электролитическая диссоциация сильных и слабых электролитов: кислот, оснований, солей в воде
- •71 Ступенчатая диссоциация.
- •72 Ионные реакции. 73 условия течения реакций обмена в растворах электролитах.
- •74 Электролитическая диссоциация воды. Ионно-молекулярные равновесия
- •Правила составления уравнений ионно-молекулярных реакций
- •75 Ионное произведение воды(kw) 77 pH кислот и оснований. Кислотно-основные равновесия. Водородный показатель рН
- •76 Водородный показатель pH как мера кислотности и щелочности среды.
- •78Понятия об индикаторах.
- •79 Окраска индикаторов в различных средах.
- •80 Гидролиз солей
- •81 Соли гидролизующиеся по аниону катиону, не гидролизирующиеся соли.
- •82 Изменение пш среды при гидролизе.
- •83 Влияние внешних факторов на степень полноты гидролиза
- •84 Электродный потенциал, механизм его возникновения.
- •85 Уравнение Нернста. Уравнение Нернста
- •86 Электрохимический ряд напряжений металлов.
- •87 Типы электродов
- •Механизм возникновения электродных потенциалов и определение их величин
- •88 Гальванические элементы. 90 поляризация
- •89 Измерение электродвижущей силы.
- •91 Химические источники тока: аккумуляторы, топливные элементы.
- •92 Коррозия металлов.
- •93 Виды коррозии.
- •Химическая коррозия
- •94 Механизм Электрохимической коррозии Электрохимическая коррозия
- •95.Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •97 Аналитический сигнал
- •98. Основы качественного и количественного анализа.
- •Количественный химический анализ
- •99 Качественные реакции на ионы
84 Электродный потенциал, механизм его возникновения.
85 Уравнение Нернста. Уравнение Нернста
Величина электродного потенциала зависит от природы металла, концентрации ионов в растворе, температуры и определяется уравнением Нернста:
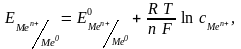
где
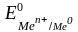 –
стандартный
электродный потенциал,
возникающий на гра-
–
стандартный
электродный потенциал,
возникающий на гра-
нице раздела металл – раствор при концентрации ионов металла 1 моль/л,
температуре 298 К и давлении 101 кПа;
R ─ универсальная газовая постоянная;
Т ─ температура, К;
n ─ число электронов, принимающих участие в процессе на электроде;
F ─ число Фарадея;
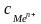 –
концентрация
ионов металла
в растворе.
–
концентрация
ионов металла
в растворе.
С учётом постоянных величин и для температуры 298 К уравнение Нернста имеет вид:
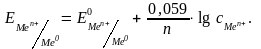
Значения стандартных электродных потенциалов содержатся в справочной литературе, некоторые из них представлены в табл. 5.1.
86 Электрохимический ряд напряжений металлов.
Металлы, расположенные в порядке возрастания алгебраической величины их электродных потенциалов, образует ряд электрохимической активности металлов, называемый «рядом активности» (рис. 5.5)

Усиление восстановительной активности металлов
MgAlMnZnFeCoNiSnPbHCuAgAu
Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Co2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Ag+ Au3+
Усиление окислительной активности ионов металлов
Рис. 5.5 ─ Ряд активности металлов
Чем отрицательнее значение электродного потенциала, тем более активным восстановителем является металл.
Ряд стандартных электродных потенциалов характеризует восстановительную способность металлов в окислительно-восстановительных реакциях, протекающих в водной среде при стандартных условиях. Металл может быть восстановителем, т.е. вступать в химическое взаимодействие в том случае, если его потенциал более отрицателен (или менее положителен), чем потенциал окислителя, находящегося в среде.
87 Типы электродов
Электрохимическими называются окислительно-восстановительные процессы, протекающие на границе раздела: электрод ─ раствор и сопровождающиеся переносом заряда через эту границу.
В строительной отрасли значение данных процессов связано, прежде всего, с электрохимической коррозией металлов, которая наносит миллиардные убытки народному хозяйству. Поэтому знание сущности коррозионных процессов и факторов, влияющих на характер и скорость их протекания, имеет большое значение для выбора рациональных методов защиты строительных конструкций от коррозии.
Механизм возникновения электродных потенциалов и определение их величин
Электрод первого родапредставляет собой металл, помещённый в водный раствор собственной соли, например: цинк в растворе сульфата цинка или медь в растворе сульфата меди.
Атомы элементов, обладающих металлическими свойствами, содержат мало электронов на внешних электронных уровнях.
Вследствие малой плотности электронов на внешних уровнях атомы металлов в процессе кристаллизации легко сближаются и обобщают электроны, которые приобретают способность легко перемещаться по всему объёму тела. Поэтому в определённый момент времени кристаллическую решётку металла можно представить как состоящую из нейтральных атомов, положительно заряженных ионов и свободных электронов, находящихся в междоузлиях решётки (рис. 5.2).
При контакте металла с раствором собственной соли протекают два противоположных процесса:
а)переход гидратированных ионов металла в раствор;
б) адсорбция катионов из раствора на поверхности металла.
В растворе полярные молекулы воды взаимодействуют с поверхностными положительно заряженными ионами металла и «уводят» их в раствор, в результате чего слой раствора, прилегающий к электроду, «заряжается» положительно, а поверхность электрода ─ отрицательно, т.к. в металле остаётся избыток электронов.
Наряду с прямым процессом перехода ионов металла в раствор наблюдается обратный ─ адсорбция ионов металла из раствора соли на поверхности металла:
Me0 + m H2O <══> Me n+∙ m H2O + n e─
При исключении гидратационной воды равновесный процесс на границе «электрод ─ раствор» можно записать следующим образом: Me0<══>Men+ + ne─.
Если в начальный момент времени скорость первого процесса больше скорости второго, поверхность металла приобретает избыточный отрицательный заряд, а прилегающий слой раствора – положительный; и наоборот, если скорость второго процесса больше скорости первого, поверхность металла заряжается положительно, а прилегающий слой раствора – отрицательно. И в том, и в другом случае между двумя заряженными слоями возникает скачок
Цинковый электрод в растворе сульфата цинка приобретает отрицательный заряд, т.к. на его поверхности скапливается избыток электронов, когда под действием диполей воды гидратированные ионы металла выходят в раствор. Подобный процесс характерен для активных металлов.
На медном электроде идёт адсорбция ионов меди из раствора на поверхности металла, в результате чего электрод приобретает положительный заряд, что характерно для неактивных металлов.
Таким образом, на границе электрод ─ раствор возникает двойной электрический слой зарядов, или разность потенциалов, измерить абсолютную величину которой не представляется возможным.
Для оценки величины электродного потенциала используют электрод сравнения, потенциал которого известен и не меняется в ходе измерения.
XII
