
- •6. Квантовые числа
- •7.Типы атомных орбиталей.
- •8. Распределение электронов в атоме
- •12. Электронные конфигурации атомов и ионов.
- •13. Периодический закон д. И. Менделеева.
- •15. Структура периодической системы: период, ряд, группа и подгруппа.
- •17. Энергия ионизации, сродство к электрону, электроотрицательность Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •19.Механизм образования ковалентной связи. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •20 Метод валентных связей
- •21 Свойства ковалентной связи
- •22. Гибридизация атомных орбиталей, геометрическая структура молекул.
- •23. Ковалентная связь полярная и неполярная
- •24. Полярность молекул.
- •25. И 26 ионная связь. Ионная химическая связь
- •28. Окислительно- восстановительные процессы.
- •29. 30 Окислители и восстановители.
- •33Основные термодинамические понятия: система, гомогенная и гетерогенная система, изолированная закрытая система, система открытая, параметры состояния системы, термодинамические функции.
- •34 Внутренняя энергия и энтальпия
- •36 Эндотермические и экзотермические процессы.
- •37 Закон Гесса и следствия вытекающие из него Закон Гесса
- •Следствия закона Гесса
- •38 Стандартная энтальпия образования сложного вещества.
- •39Тепловой эффект реакции
- •40 41 Энтропия и изобарно-изотермический потенциал.
- •42 Химическая кинетика.
- •43 Скорость химических реакций
- •44.45 Энергия активации. Уравнение Аррениуса Уравнение Аррениуса
- •46 Зависимость скорости реакции от концентрации реагирующих веществ и давления.
- •47 Закон действующих масс
- •48 И 49 кинетическое уравнение. Константа скорости реакции.
- •50.Влияние темпер. На скорость хим реакции, правило Вант-Гоффа. Влияние температуры на константу скорости реакции
- •51 52. Влияние катализатора на скорость реакции. Катализ
- •53, 54 И 55 Процессы обратимые и необратимые. Химическое равновесие. Константа химического равновесия.
- •56 И 57. Принцип Ле- Шателье. Влияние темпер, концентрации, давления и катализатора на смещение равновесия
- •58 Общая характеристика растворов .
- •59 Способы выражения концентрации растворов
- •60 Молярная, моляльная концентрация, массовая доля, молярная концентрация эквивалентов.
- •61 И 62 давление пара растворов. Закон Рауля для растворов неэлектролитов. Замерзание и кипение растворов
- •63 И 64 Понижение температуры замерзания и повышение температуры кипения раствора. Криоскопия и эбуллиоскопия.
- •65 И 66 осмос, осмотическое давление. Закон вант-Гоффа. Осмотическое давление
- •67 Теория электролитической диссоциации Аррениуса.
- •69Степень и константы диссоциации
- •68 Электролиты сильные и слабые.
- •70 Электролитическая диссоциация сильных и слабых электролитов: кислот, оснований, солей в воде
- •71 Ступенчатая диссоциация.
- •72 Ионные реакции. 73 условия течения реакций обмена в растворах электролитах.
- •74 Электролитическая диссоциация воды. Ионно-молекулярные равновесия
- •Правила составления уравнений ионно-молекулярных реакций
- •75 Ионное произведение воды(kw) 77 pH кислот и оснований. Кислотно-основные равновесия. Водородный показатель рН
- •76 Водородный показатель pH как мера кислотности и щелочности среды.
- •78Понятия об индикаторах.
- •79 Окраска индикаторов в различных средах.
- •80 Гидролиз солей
- •81 Соли гидролизующиеся по аниону катиону, не гидролизирующиеся соли.
- •82 Изменение пш среды при гидролизе.
- •83 Влияние внешних факторов на степень полноты гидролиза
- •84 Электродный потенциал, механизм его возникновения.
- •85 Уравнение Нернста. Уравнение Нернста
- •86 Электрохимический ряд напряжений металлов.
- •87 Типы электродов
- •Механизм возникновения электродных потенциалов и определение их величин
- •88 Гальванические элементы. 90 поляризация
- •89 Измерение электродвижущей силы.
- •91 Химические источники тока: аккумуляторы, топливные элементы.
- •92 Коррозия металлов.
- •93 Виды коррозии.
- •Химическая коррозия
- •94 Механизм Электрохимической коррозии Электрохимическая коррозия
- •95.Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •97 Аналитический сигнал
- •98. Основы качественного и количественного анализа.
- •Количественный химический анализ
- •99 Качественные реакции на ионы
81 Соли гидролизующиеся по аниону катиону, не гидролизирующиеся соли.
В результате взаимодействия с водой хлорида аммония в растворе накапливаются свободные ионы Н+ и реакция среды становится кислой, т.к. СН+> СОН ˉ. Раствор данной соли окрасит лакмус и универсальный индикатор в красный цвет.NH4Cl гидролизуется по катиону, который является остатком слабого основания.
Нитрит натрия NaNO2 образован слабойкислотой HNO2 и сильным основанием NaOH. Уравнения гидролиза нитрита натрия выглядят так:
NaNO2 + HOH ↔ NaOH + HNO2;
слабый электролит слабый электролит
Na+ + NO2‾ + HOH ↔ Na+ + OH‾+ HNO2;
NO2‾+ HOH ↔ OH‾+ HNO2.
Реакция среды в растворе нитрита натрия щелочная вследствие накопления свободных ионов ОН ˉ, так как СН+< СОНˉ.Причиной гидролиза является образование слабой кислоты – HNO2 , т.о. NaNO2 гидролизуется по аниону, раствор нитрита натрия фенолфталеин окрасит в малиновый цвет, лакмус, метилоранж и универсальный индикатор − в красный цвет.
Нитрит аммония образован слабым основанием NH4OH и слабой кислотой HNO2. При взаимодействии с водой образуются данные слабые электролиты:
NH4NO2 + НОН ↔ NH4OH + HNO2;
слабый электролит слабый электролит
NH4+ + NO2‾ + НОН ↔ NH4OH + HNO2.
В данном случае рН среды меняется незначительно, т.к. СН+ ≈ СОН–.
NH4NO2 гидролизуется как по катиону, так и по аниону.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, и pH среды не меняется, например:
NaCl + HOH ↔ NaOH + HCl;
слабый электролит
Na+ + Cl‾ + HOH ↔ Na+ + OH– + H+ + Cl‾;
HOH ↔ H+ + OH‾ .
82 Изменение пш среды при гидролизе.
83 Влияние внешних факторов на степень полноты гидролиза
Степень гидролиза β представляет собой отношение концентрации прогидролизовавшихся молекул к исходной концентрации растворённых молекул соли:
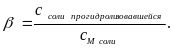
Степень гидролиза зависит от константы равновесия, температуры и концентрации соли.
Влияние внешних факторов. Процесс гидролиза соли во многом обратен экзотермическому процессу нейтрализации, а поэтому сопровождается поглощением теплоты. В соответствии с правилами смещения химического равновесия нагревание раствора соли должно смещать равновесие в сторону процесса, который идёт с поглощением тепла, то естьусиливатьгидролиз соли. Разбавление раствора водой также способствует протеканию гидролиза, так как увеличивается число ионов H+ и OH¯, взаимодействующих с ионами соли.
Если реакция среды в растворе кислая, то уменьшить гидролиз можно добавлением сильной кислоты (увеличивается концентрация продуктов реакции и равновесие смещается в сторону исходных веществ), а усилить ─ добавлением щёлочи ( ионы Н+ связываются ионами ОН¯ в слабый электролит Н2О, что вызывает уменьшение концентрации продуктов реакции и смещение равновесия в сторону их образования). В случае щелочной среды добавлением кислоты гидролиз усиливается, а добавлением щёлочи ─ уменьшается.
XI
