
- •6. Квантовые числа
- •7.Типы атомных орбиталей.
- •8. Распределение электронов в атоме
- •12. Электронные конфигурации атомов и ионов.
- •13. Периодический закон д. И. Менделеева.
- •15. Структура периодической системы: период, ряд, группа и подгруппа.
- •17. Энергия ионизации, сродство к электрону, электроотрицательность Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •19.Механизм образования ковалентной связи. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •20 Метод валентных связей
- •21 Свойства ковалентной связи
- •22. Гибридизация атомных орбиталей, геометрическая структура молекул.
- •23. Ковалентная связь полярная и неполярная
- •24. Полярность молекул.
- •25. И 26 ионная связь. Ионная химическая связь
- •28. Окислительно- восстановительные процессы.
- •29. 30 Окислители и восстановители.
- •33Основные термодинамические понятия: система, гомогенная и гетерогенная система, изолированная закрытая система, система открытая, параметры состояния системы, термодинамические функции.
- •34 Внутренняя энергия и энтальпия
- •36 Эндотермические и экзотермические процессы.
- •37 Закон Гесса и следствия вытекающие из него Закон Гесса
- •Следствия закона Гесса
- •38 Стандартная энтальпия образования сложного вещества.
- •39Тепловой эффект реакции
- •40 41 Энтропия и изобарно-изотермический потенциал.
- •42 Химическая кинетика.
- •43 Скорость химических реакций
- •44.45 Энергия активации. Уравнение Аррениуса Уравнение Аррениуса
- •46 Зависимость скорости реакции от концентрации реагирующих веществ и давления.
- •47 Закон действующих масс
- •48 И 49 кинетическое уравнение. Константа скорости реакции.
- •50.Влияние темпер. На скорость хим реакции, правило Вант-Гоффа. Влияние температуры на константу скорости реакции
- •51 52. Влияние катализатора на скорость реакции. Катализ
- •53, 54 И 55 Процессы обратимые и необратимые. Химическое равновесие. Константа химического равновесия.
- •56 И 57. Принцип Ле- Шателье. Влияние темпер, концентрации, давления и катализатора на смещение равновесия
- •58 Общая характеристика растворов .
- •59 Способы выражения концентрации растворов
- •60 Молярная, моляльная концентрация, массовая доля, молярная концентрация эквивалентов.
- •61 И 62 давление пара растворов. Закон Рауля для растворов неэлектролитов. Замерзание и кипение растворов
- •63 И 64 Понижение температуры замерзания и повышение температуры кипения раствора. Криоскопия и эбуллиоскопия.
- •65 И 66 осмос, осмотическое давление. Закон вант-Гоффа. Осмотическое давление
- •67 Теория электролитической диссоциации Аррениуса.
- •69Степень и константы диссоциации
- •68 Электролиты сильные и слабые.
- •70 Электролитическая диссоциация сильных и слабых электролитов: кислот, оснований, солей в воде
- •71 Ступенчатая диссоциация.
- •72 Ионные реакции. 73 условия течения реакций обмена в растворах электролитах.
- •74 Электролитическая диссоциация воды. Ионно-молекулярные равновесия
- •Правила составления уравнений ионно-молекулярных реакций
- •75 Ионное произведение воды(kw) 77 pH кислот и оснований. Кислотно-основные равновесия. Водородный показатель рН
- •76 Водородный показатель pH как мера кислотности и щелочности среды.
- •78Понятия об индикаторах.
- •79 Окраска индикаторов в различных средах.
- •80 Гидролиз солей
- •81 Соли гидролизующиеся по аниону катиону, не гидролизирующиеся соли.
- •82 Изменение пш среды при гидролизе.
- •83 Влияние внешних факторов на степень полноты гидролиза
- •84 Электродный потенциал, механизм его возникновения.
- •85 Уравнение Нернста. Уравнение Нернста
- •86 Электрохимический ряд напряжений металлов.
- •87 Типы электродов
- •Механизм возникновения электродных потенциалов и определение их величин
- •88 Гальванические элементы. 90 поляризация
- •89 Измерение электродвижущей силы.
- •91 Химические источники тока: аккумуляторы, топливные элементы.
- •92 Коррозия металлов.
- •93 Виды коррозии.
- •Химическая коррозия
- •94 Механизм Электрохимической коррозии Электрохимическая коррозия
- •95.Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •97 Аналитический сигнал
- •98. Основы качественного и количественного анализа.
- •Количественный химический анализ
- •99 Качественные реакции на ионы
75 Ионное произведение воды(kw) 77 pH кислот и оснований. Кислотно-основные равновесия. Водородный показатель рН
Вода является очень слабым электролитом и диссоциирует по уравнению
Н2О ↔ Н+ + ОН‾.
В любом водном растворе при 22 0С произведение концентраций ионов воды (ионное произведение воды – КW) является величиной постоянной:
КW = [Н+] ∙ [OH─] = 10–14,
где [Н+] ─ равновесная концентрация ионов Н+;
[OH─] ─ равновесная концентрация ионов ОН─.
В нейтральной среде [Н+] = [OH─] = 10–7моль/л;
в кислой среде [Н+]>[OH─], т.е.[Н+]>10–7моль/л ,
например [Н+] = 10–6моль/л;
в щелочной среде [Н+] <[OH─], т.е.[Н+] <10–7моль/л,
например [Н+] = 10–8моль/л
76 Водородный показатель pH как мера кислотности и щелочности среды.
Реакция среды характеризуется через водородный показатель
pH = ─ lg [Н+].
При решении задач будем пользоваться формулойpН = – lg сH+. В более точных расчётах следует пользоваться активностью ─ pН = – lg аH+ .
Если подставить значения концентраций ионов водорода сH+, полученные в вышеприведённом примере,в формулу для вычисления рН, то получим:
в нейтральной среде: рН = ─ lg 10–7 = 7;
в кислой среде: рН = ─ lg 10–6= 6;
в щелочной среде: рН = ─ lg 10–8= 8.
Следовательно:

Данные сведения находят отражение в шкале рН (рис. 4.8).

Рис. 4.8 – Шкала рН
78Понятия об индикаторах.
Наиболее простым способом оценки рН среды является использование кислотно-основных индикаторов, которые по своему составу относятся к слабым органическим кислотам или основаниям. Например, индикатор метиловый оранжевый представляет слабую органическую кислоту, электролитическую диссоциацию которой условно можно представить следующим образом:
HJnd ↔ H+ + Jnd– .
кислотная форма основная форма
(красная) (жёлтая)
79 Окраска индикаторов в различных средах.
Окраска индикаторов зависит от строения молекул и определяется наличием особых групп – хромофоров. Изменение окраски индикатора происходит в определённом интервале рН:
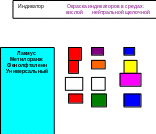
Рис. 4.9 – Окраска некоторых индикаторов в различных средах
80 Гидролиз солей
Таким образом, гидролиз солей относится к обратимым реакциям и протекает тем полнее, чем более слабым электролитом будет кислота или основание, образовавшие соль. Причиной гидролиза, то есть веществом, смещающим равновесие гидролиза в сторону образования продуктов реакции, являются слабые кислоты и основания.

Формально реакция гидролиза соли обратна реакции нейтрализации, в результате которой соль образуется.

