
- •6. Квантовые числа
- •7.Типы атомных орбиталей.
- •8. Распределение электронов в атоме
- •12. Электронные конфигурации атомов и ионов.
- •13. Периодический закон д. И. Менделеева.
- •15. Структура периодической системы: период, ряд, группа и подгруппа.
- •17. Энергия ионизации, сродство к электрону, электроотрицательность Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •19.Механизм образования ковалентной связи. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •20 Метод валентных связей
- •21 Свойства ковалентной связи
- •22. Гибридизация атомных орбиталей, геометрическая структура молекул.
- •23. Ковалентная связь полярная и неполярная
- •24. Полярность молекул.
- •25. И 26 ионная связь. Ионная химическая связь
- •28. Окислительно- восстановительные процессы.
- •29. 30 Окислители и восстановители.
- •33Основные термодинамические понятия: система, гомогенная и гетерогенная система, изолированная закрытая система, система открытая, параметры состояния системы, термодинамические функции.
- •34 Внутренняя энергия и энтальпия
- •36 Эндотермические и экзотермические процессы.
- •37 Закон Гесса и следствия вытекающие из него Закон Гесса
- •Следствия закона Гесса
- •38 Стандартная энтальпия образования сложного вещества.
- •39Тепловой эффект реакции
- •40 41 Энтропия и изобарно-изотермический потенциал.
- •42 Химическая кинетика.
- •43 Скорость химических реакций
- •44.45 Энергия активации. Уравнение Аррениуса Уравнение Аррениуса
- •46 Зависимость скорости реакции от концентрации реагирующих веществ и давления.
- •47 Закон действующих масс
- •48 И 49 кинетическое уравнение. Константа скорости реакции.
- •50.Влияние темпер. На скорость хим реакции, правило Вант-Гоффа. Влияние температуры на константу скорости реакции
- •51 52. Влияние катализатора на скорость реакции. Катализ
- •53, 54 И 55 Процессы обратимые и необратимые. Химическое равновесие. Константа химического равновесия.
- •56 И 57. Принцип Ле- Шателье. Влияние темпер, концентрации, давления и катализатора на смещение равновесия
- •58 Общая характеристика растворов .
- •59 Способы выражения концентрации растворов
- •60 Молярная, моляльная концентрация, массовая доля, молярная концентрация эквивалентов.
- •61 И 62 давление пара растворов. Закон Рауля для растворов неэлектролитов. Замерзание и кипение растворов
- •63 И 64 Понижение температуры замерзания и повышение температуры кипения раствора. Криоскопия и эбуллиоскопия.
- •65 И 66 осмос, осмотическое давление. Закон вант-Гоффа. Осмотическое давление
- •67 Теория электролитической диссоциации Аррениуса.
- •69Степень и константы диссоциации
- •68 Электролиты сильные и слабые.
- •70 Электролитическая диссоциация сильных и слабых электролитов: кислот, оснований, солей в воде
- •71 Ступенчатая диссоциация.
- •72 Ионные реакции. 73 условия течения реакций обмена в растворах электролитах.
- •74 Электролитическая диссоциация воды. Ионно-молекулярные равновесия
- •Правила составления уравнений ионно-молекулярных реакций
- •75 Ионное произведение воды(kw) 77 pH кислот и оснований. Кислотно-основные равновесия. Водородный показатель рН
- •76 Водородный показатель pH как мера кислотности и щелочности среды.
- •78Понятия об индикаторах.
- •79 Окраска индикаторов в различных средах.
- •80 Гидролиз солей
- •81 Соли гидролизующиеся по аниону катиону, не гидролизирующиеся соли.
- •82 Изменение пш среды при гидролизе.
- •83 Влияние внешних факторов на степень полноты гидролиза
- •84 Электродный потенциал, механизм его возникновения.
- •85 Уравнение Нернста. Уравнение Нернста
- •86 Электрохимический ряд напряжений металлов.
- •87 Типы электродов
- •Механизм возникновения электродных потенциалов и определение их величин
- •88 Гальванические элементы. 90 поляризация
- •89 Измерение электродвижущей силы.
- •91 Химические источники тока: аккумуляторы, топливные элементы.
- •92 Коррозия металлов.
- •93 Виды коррозии.
- •Химическая коррозия
- •94 Механизм Электрохимической коррозии Электрохимическая коррозия
- •95.Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •97 Аналитический сигнал
- •98. Основы качественного и количественного анализа.
- •Количественный химический анализ
- •99 Качественные реакции на ионы
42 Химическая кинетика.
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях, соответствующих их стехиометрическим коэффициентам.
Для реакции
аА + bВ + dD + ... ––> еЕ + ...
можно записать:
υ=k· сa·сb·сd
(если все реагирующие вещества представлены жидкими или газообразными фазами)
Если реагирующее вещество является твердым или кристаллическим, то с твёрдый = 1 (принимается за константу)
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции.
43 Скорость химических реакций
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций (здесь и далее рассматриваются только односторонние реакции) очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (Δсисходных веществ < 0), а концентрации продуктов реакции увеличиваются (Δспродуктов реакции > 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
![]()
44.45 Энергия активации. Уравнение Аррениуса Уравнение Аррениуса
Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если бы каждое столкновение приводило к химическому взаимодействию частиц, все реакции протекали бы практически мгновенно. С. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Рассмотрим путь некоторой элементарной реакции
А + В ––> С
Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом K#:
А ––> K# ––> B.
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное, система должна преодолеть своего рода энергетический барьер.
Энергия активации реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е'А выше, нежели энергия активации прямой реакции EA. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции. Вышесказанное можно проиллюстрировать с помощью энергетической диаграммы химической реакции (рис. 3.4.).
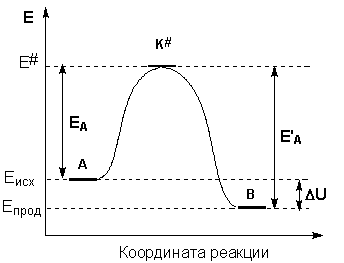
Рис. 3.4. Энергетическая диаграмма химической реакции. Eисх – средняя энергия частиц исходных веществ, Eпрод – средняя энергия частиц продуктов реакции.
Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.3.5.):
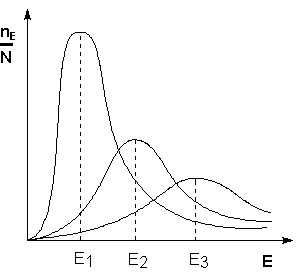
Рис. 3.5. Распределение частиц по энергии
nЕ/N – доля частиц, обладающих энергией E; Ei - средняя энергия частиц при температуре Ti (T1 < T2 < T3)
