
- •Агрегатні стани речовини
- •Тверді тіла
- •Кристалічні решітки і елементарні комірки
- •Кубічна: p, I, f Тетрагональна: p, I Ромбічна: p, c, I, f Моноклінна: p, c Триклінна Тригональна (Ромбоедрична) Гексагональна
- •Дослідження структури кристалів
- •Дефекти в кристалах
- •Ковалентний зв’язок
- •Металічний зв’язок
- •Міжмолекулярні сили
ВСТУП
Фізична хімія вивчає взаємний зв’язок хімічних і фізичних явищ. Такі явища пов’язані з різними формами руху матерії. В першу чергу це рух молекул і атомів з яких складається речовина.
Зародження фізичної хімії слід віднести до 1752 – 1754 років, коли М.В. Ломоносов для студентів Петербурзької Академії наук читав створений ним курс “Введение в истинную физическую химию”. Але виділення фізичної хімії в окрему науку і дисципліну відбулося пізніше, після здійснення цілого ряду відкриттів і узагальнень.
У 1865 році вперше після Ломоносова курс фізико-хімії читався у Харківському університеті М.М. Бекетовим. У 1887 році у Лейпцігському університеті створено кафедру фізичної хімії, яку очолив В.Ф. Оствальд. Фізична хімія виникла як відгалуження хімії, тісно пов’язане з фізикою за умови широкого використання математики.
Головну увагу фізична хімія звертає на дослідження законів протікання хімічних процесів і законів хімічної рівноваги.
Головна задача фізичної хімії – передбачення напрямку і швидкості протікання хімічного процесу при заданих умовах та кінцевого результату цього процесу. Це означає, що фізична хімія може вказувати шляхи керування хімічними технологічними процесами з метою оптимізації цих процесів в заводських масштабах.
Чіткої межі між фізичною хімією і іншими природничими науками встановити не можна. Існує тісний зв’язок фізичної хімії з такими науками як біохімія, біофізика, геохімія, геофізика і астрофізика та цілим рядом прикладних наук, в тім числі і екологією.
Основні розділи фізичної хімії такі: будова речовини, хімічна термодинаміка, вчення про розчини, поверхневі явища, електрохімія, хімічна кінетика та каталіз, фотохімія і радіаційна хімія.
Основними методами фізико-хімічних досліджень є методи фізики і хімії. Це експериментальні методи дослідження властивостей речовини в залежності від зовнішніх умов та експериментальне вивчення законів протікання хімічних реакцій та законів хімічної рівноваги. Серед теоретичних методів досліджень виділяють квантово – механічний, метод статистичної фізики та термодинамічний метод.
Агрегатні стани речовини
Відомо чотири агрегатних стани речовини: твердий, рідкий, газоподібний та стан плазми. Два з цих станів – твердий і рідкий називають конденсованими. В таких тілах існує сильна взаємодія між частинками, що їх утворюють. Міжатомні віддалі встановлюються такими, щоб сили притягання і відштовхування були зрівноваженими. Внаслідок цього конденсовані тіла чинять великий опір до зміни об’єму. Тверді тіла чинять опір і до зміни форми, тобто, вони важко деформуються, на відміну від рідин.
Рідини деформуються легко і не мають власної форми. При наявності сил тяжіння рідини приймають форму посудини, в яку рідина налита. За відсутності сил тяжіння під дією сил поверхневого натягу рідина приймає форму кулі, тобто площа поверхні рідини при заданому об’ємі зводиться до мінімуму.
Гази легко змінюють форму і об’єм. Взаємодіяти частинки розрідженого газу можуть лише в момент зіткнення.
У стані плазми під дією високих температур речовина розпадається на складові частини, які мають електричні заряди (суміш електронів та іонізованих атомів).
Тверді тіла
В твердому стані існують ідеальні монокристали, монокристали з дефектами кристалічної решітки, полікристалічні речовини та аморфні тверді тіла.
Кристалами називають тіла, обмежені власними поверхнями – гранями. Форма кристала визначається певними властивостями його речовини та умовами росту кристалу. Кристали однієї і тієї ж модифікації даної речовини можуть мати різну величину, форму і кількість граней, але кути між відповідними гранями при заданій температурі і тиску залишаються постійними. Наука, яка вивчає структуру кристалів, називається кристалографія.
МІЖАТОМНІ СИЛИ
Тверді тіла можна розглядати як сукупність ядер і електронів, між якими діють електростатичні сили. При зближенні двох атомів спочатку між ними виникають сили взаємного притягання, які зростають із зменшенням віддалі між центрами атомів. На малих віддалях переважають сили відштовхування між однойменно зарядженими ядрами.
Потенціальну енергію взаємодії двох атомів наближено записують у вигляді суми двох членів
![]()
де
![]() і
і
![]() - константи, що характеризують притягання
і відштовхування, r – віддаль атомами.
Найчастіше користуються потенціалом
Ленарда – Джонса (n = 6, m = 12). Перший доданок
характеризує притягання; а другий –
відштовхування. Сила міжатомної взаємодії
визначається із співвідношення:
- константи, що характеризують притягання
і відштовхування, r – віддаль атомами.
Найчастіше користуються потенціалом
Ленарда – Джонса (n = 6, m = 12). Перший доданок
характеризує притягання; а другий –
відштовхування. Сила міжатомної взаємодії
визначається із співвідношення:
![]()
![]()
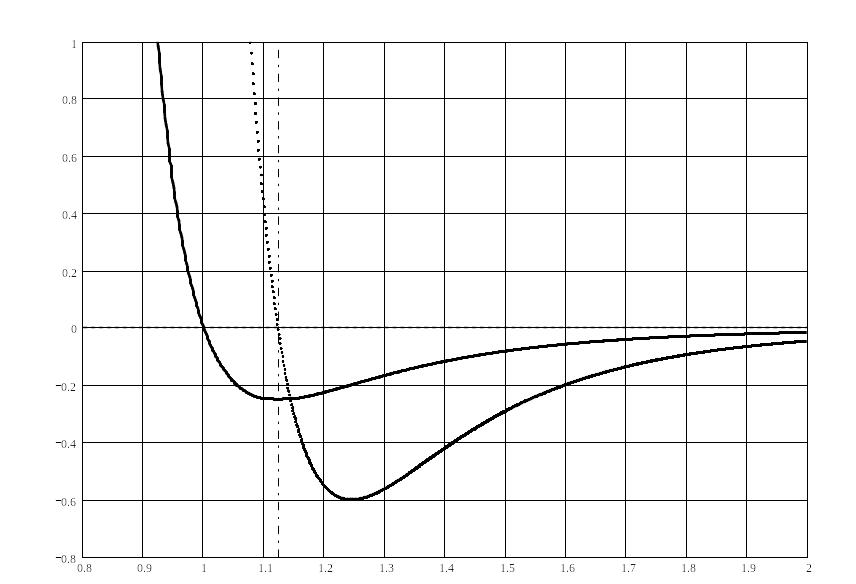
U, F
b
a
r
Рис. 1. Графіки
залежностей потенціалу міжатомної
взаємодії (а) та сили цієї взаємодії (б)
від міжатомної віддалі
![]() Найкоротша міжатомна віддаль у
недеформованому кристалі
Найкоротша міжатомна віддаль у
недеформованому кристалі
![]() відповідає нульовому значенню сили
відповідає нульовому значенню сили
![]() та мінімуму потенціальної енергії
та мінімуму потенціальної енергії
![]()
Кристалічні решітки і елементарні комірки
Внутрішній порядок у кристалічних тілах характеризується строгою періодичністю в розташуванні атомів або молекул. Це дає можливість розглядаючи лише маленьку частину кристалу одержати уявлення про будову всього кристалу. Найменша частинка кристалічної решітки, тобто тривимірного розташування утворюючих кристал частинок, називається елементарною коміркою. Вона дозволяє побудувати увесь кристал простим переміщенням елементарної комірки у трьох вимірах на віддалі кратні сталим кристалічної решітки a, b, c. Такі переміщення називають трансляціями.
Періодичну
структуру даного типу кристалу можна
описати математично використовуючи
поняття решітки Браве. Вона утворюється
зображеними точками повторюваними
елементами кристалу, тобто, це нескінченна
просторова періодична структура,
зображена дискретними точками. Вона
має абсолютно однаковий просторовий
порядок і орієнтацію незалежно від
того, яку її точку ми вибрали початковою
і може бути
одновимірною, двовимірною і тривимірною.
Положення
у просторі дискретних точок решітки
Браве можна задати за допомогою радіус
‑ вектора
![]() :
:
![]() ,
,
де
![]() ‑
базисні векторами. Їх називають такими,
що породжують кристалічну решітку.
Модулі базисних венкторів
‑
базисні векторами. Їх називають такими,
що породжують кристалічну решітку.
Модулі базисних венкторів
![]() ,
,
![]() ,
,
![]() характеризують віддалі між атомами або
молекулами в кристалах і звичайно
дорівнюють
характеризують віддалі між атомами або
молекулами в кристалах і звичайно
дорівнюють
![]() Å
(ангстрем). (1Å
Å
(ангстрем). (1Å![]() ).
).
![]() - числа сталих решітки, відрахованих у
даному напрямку. У молекулярних кристалах
віддалі між точками решітки Браве можуть
бути в десятки і сотні разів більшими.
Якщо тверда фаза має певну структуру,
точки якої можна задати радіус – вектором
,
то це означає наявність далекого порядку,
тобто, це буде кристал. Якщо ж у твердій
фазі далекий порядок відсутній, вона
вважається аморфною. Зауважимо, що
далекий порядок відсутній у рідинах.
- числа сталих решітки, відрахованих у
даному напрямку. У молекулярних кристалах
віддалі між точками решітки Браве можуть
бути в десятки і сотні разів більшими.
Якщо тверда фаза має певну структуру,
точки якої можна задати радіус – вектором
,
то це означає наявність далекого порядку,
тобто, це буде кристал. Якщо ж у твердій
фазі далекий порядок відсутній, вона
вважається аморфною. Зауважимо, що
далекий порядок відсутній у рідинах.
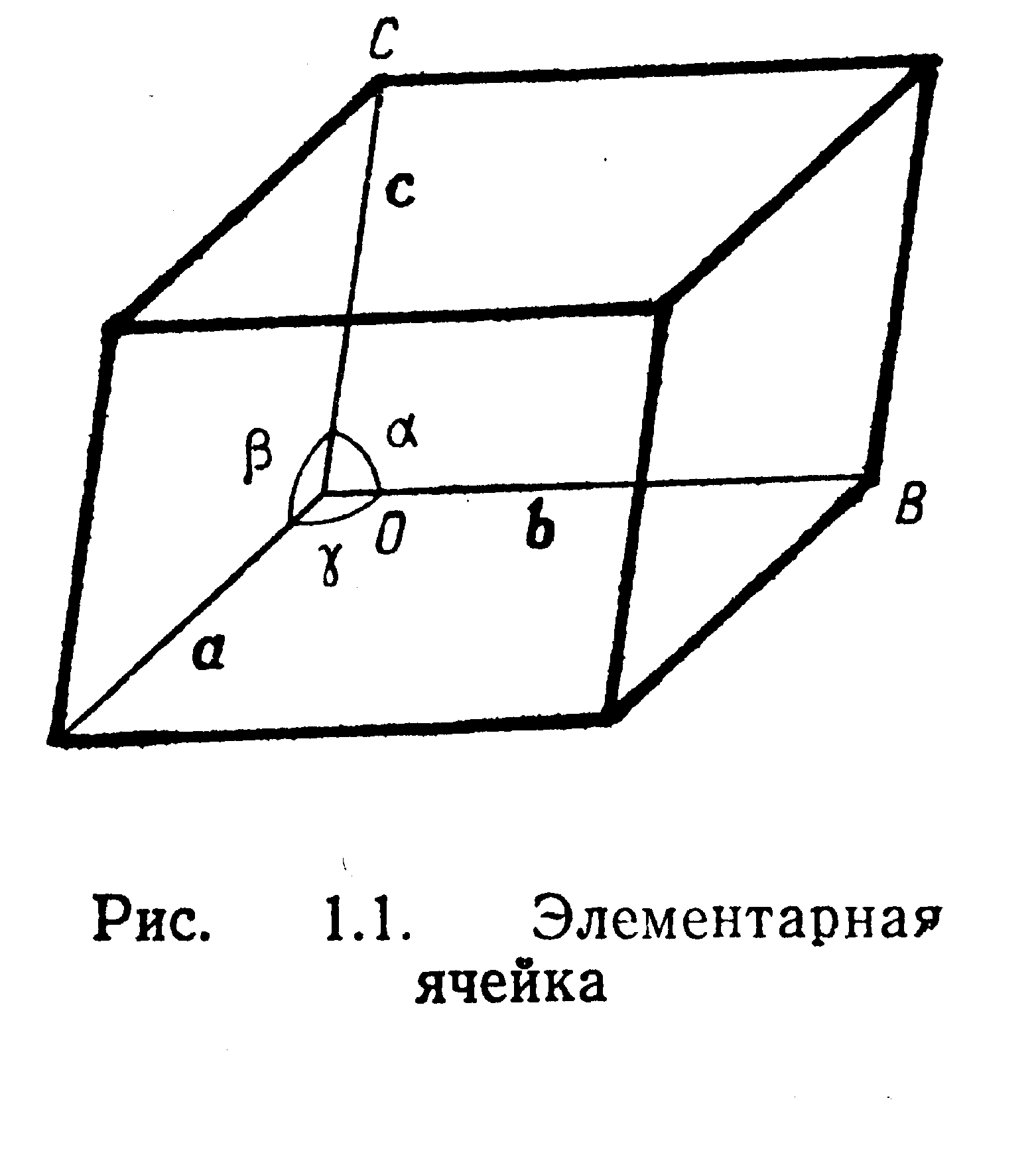
Рис. 2 Елементарна комірка.
Існує
чотирнадцять типів тривимірних
елементарних комірок. Їх поділяють на
сім кристалографічних систем (сингоній)
у відповідності з типом елементарної
комірки. Розмір і форму елементарної
комірки задають за допомогою шести
незалежних параметрів
![]() Перші три параметри є характерними
відрізками (сталими решітки, модулями
базисних векторів), що відкладаються
вздовж координатних осей, а наступні
три визначають кути між цими координатними
осями.
Перші три параметри є характерними
відрізками (сталими решітки, модулями
базисних векторів), що відкладаються
вздовж координатних осей, а наступні
три визначають кути між цими координатними
осями.
Особливості елементарних комірок позначаються такими символами: P-примітивна; I-об’ємноцентрована , F-гранецентрована , C- з центрованою основою (базою), R - ромбоедрична.
Положення і орієнтація атомних площин у кристалах
Площину можна проводити через три точки, що не лежать на одній прямій. Отже, вибирають три атоми, кожен з яких знаходиться на своїй кристалографічній осі, а їх координати записують в одиницях сталих решітки, наприклад, (4,0,0), (0,1,0), (0,0,2). Кристалографічна площина буде характеризуватися трьома числами: 4,1,2. на практиці найчастіше користуються індексами Міллера (hkl).
Знайдемо точки, в яких дана атомна площина перетинає головні координатні осі і запишемо їх координати в одиницях сталої решітки.
Візьмемо обернені значення одержаних чисел і приведемо їх до найменшого цілого, кратного кожному з чисел.
![]() .
.
Результат
записують у круглих дужках (142).
Ці цифри називають індексами
Міллера. Якщо площина перетинає
координатну вісь в області від’ємних
значень, то і відповідний індекс буде
негативним, наприклад
![]() .
.
Для позначення
напрямів у кристалах застосовують набір
найменших цілих чисел, які відносяться
між собою як компоненти вектора,
паралельного даному напрямку. Вони
записуються у квадратних дужках
![]() .
В кубічних кристалах напрямок
завжди перпендикулярний до площини
.
В кубічних кристалах напрямок
завжди перпендикулярний до площини![]() .
.
Таблиця 1. Елементарні комірки чотирнадцяти просторових решіток.
Система |
Сталі решітки |
Кути |
Символи комірок |
Число комірок в системі |
Кубічна |
|
|
|
3 |
Тетрагональна |
|
|
|
2 |
Ромбічна |
|
|
|
4 |
Гексагональна |
|
|
|
1 |
Ромбоедрична |
|
|
|
1 |
моноклінна |
|
|
|
2 |
триклінна |
|
|
|
1 |
