
- •Вступ. Значення легованих сталей у сучасній техніці і промисловості
- •1. Легуючі елементи і домішки
- •1.1.Легування, мікролегування і модифікування
- •1.2 Маркірування сталей
- •1.3 Класифікація легуючих елементів по впливу на α- і γ-області
- •1.3.1. Легуючі елементи, що розширюють γ-область
- •1.3.2. Легуючі елементи, що звужують γ-область
- •1.4. Вплив легуючих елементів на критичні крапки сталі
- •1.4.1 Вплив на температуру евтектоідного перетворення
- •1.4.2 Вплив на концентрацію вуглецю в крапках s і e
- •2. Фази в легованих сталях
- •2.1. Карбідна фаза в легованій сталі
- •2.1.1. Умови карбидоутворення
- •2.1.2. Кількісний склад карбідної фази
- •2.1.3 Розчинні і нерозчинні карбіди
- •2.1.4 Дисперсійне твердіння
- •2.1.5 Вплив надлишкових карбідів
- •2.2. Тверді розчини в легованих сталях
- •2.2.1. Взаємна розчинність компонентів у сталі
- •2.2.2. Тверді розчини заміщення
- •2.2.3. Тверді розчини впровадження
- •2.3. Структура і властивості легованого фериту
- •2.4. Структура і властивості легованого аустеніту
- •2.4.1 Легування стабільного аустеніту
- •2.4.2. Легування метастабільного аустеніту
- •2.5 Термодинамічна активність вуглецю в залізі
- •2.6. Інтерметаліди
- •2.7. Залишковий аустеніт
- •3. Вплив легування на процеси аустенітизації при нагріванні
- •3.1. Механізми аустенітизації легованих сталей
- •3.1.1. Початкова неу поряд кована структура
- •3.1.2. Початкова упорядкована структура
- •3.2. Розчинення карбідів і нітридів в аустеніті
- •3.3. Ріст зерна аустеніту при нагріванні
- •3.4. Вплив розміру зерна на властивості легованих сталей
- •4. Вплив легування на перетворення переохолодженого аустеніту
- •4.1. Стійкість переохолодженого аустеніту
- •4.2. Перлітне перетворення
- •4.4. Мартенситне перетворення в легованих сталях
- •5. Вплив легуючих елементів на процеси відпустки загартованих сталей
- •5.1. Розпад мартенситу
- •5.2. Утворення і коагуляція спеціальних карбідів
- •5.3. Розпад залишкового аустеніту
- •5.4. Повернення і рекристалізація
- •5.5. Дисперсійне зміцнення
- •5.6. Відпускна крихкість сталі
- •Список використаної літератури
2.5 Термодинамічна активність вуглецю в залізі
Термодинамічна активність вуглецю багато в чому визначає його поводження у твердому розчині: розчинність, дифузійну рухливість, здатність до виділення і т.д.
Легуючі елементи впливають на активність вуглецю.
Активність елемента визначається як:

де
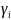 -
коефіцієнт термодинамичної активності,
-
коефіцієнт термодинамичної активності,
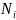 -
атомна частка елемента.
-
атомна частка елемента.
Коефіцієнт у; характеризує сили зв'язку елемента з гратами розчинника, тобто рухливість і здатність до виділення з ґрат.
При легуванні фериту й аустеніту змінюється вільна енергія вуглецю, що зв'язана з його активністю.
G=R
T
ln

де R - газова постійна;
Т - абсолютна температура, К.
Щоб
оцінити вплив легуючого елемента на
активність вуглецю в легованому розчині
( ),
його порівнюють з активністю в нелегованому
залізі з тим же змістом вуглецю:
),
його порівнюють з активністю в нелегованому
залізі з тим же змістом вуглецю:
∆G=R
T ln ( )
)
∆G=
R T ln (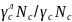 )
)
∆G=
R T ln (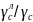 )
)
∆G=
R T ln
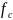
де - відносний коефіцієнт активності вуглецю.
Відносний коефіцієнт активності вуглецю характеризує вплив легуючого елемента на активність вуглецю.
Якщо > 1, то легуючий елемент підвищує активність вуглецю, якщо <1 — легуючий елемент зменшує його активність.
Фізична сутність зміни полягає в тому, що легуючі елементи в розчині змінюють міцність зв'язку між атомами металу і вуглецю.
Карбідоутворюючі елементи збільшують міцність зв'язку вуглецю з атомами легуючого елемента, підвищуючи імовірність перебування атомів вуглецю в межвузліях, притягають атоми вуглецю і знижують рухливість вуглецю у твердому розчині.
Зворотна картина спостерігається для некарбідоутворюючих елементів. Вони підвищують активність вуглецю, збільшуючи тенденцію до виділення вуглецю з твердого розчину.

Фіг. 17. Вплив легуючих елементів на активність атомів вуглецю
Вплив легуючого елемента на термодинамічну активність вуглецю в аустеніті важлив в таких процесах, як розчинення карбідів, карбонітридів і нітридів в аустеніті, виділення їх із твердого розчину при охолодженні, перерозподіл елементів між фазами при термічній обробці.
Важливо! Легуючі елементи впливають на термодинамічну активність вуглецю тільки в тому випадку, коли вони розчинені у твердому розчині.
2.6. Інтерметаліди
Інтерметаліди - фази, що утворюються в результаті взаємодії легуючого елемента з основним компонентом сплаву (залізом) або іншим легуючим елементом.
Відомо приблизно 1300 інтерметалідних фаз.
Відмітна ознака цих з'єднань - наявність у них нових кристалічних ґрат, відмінних від ґрат складових їхніх фаз.
Інтерметаліди утворяться і виконують роль зміцнюючий фази у високолегованих сталях з низьким змістом вуглецю (< 0,3%): деяких швидкорізальних (У11М7Д023), штампових з мартенситним перетворенням (ХН70ВМТЮ4), аустенітних (08Х18Н10Т).
Інтерметалідні фази подібно карбідам можуть бути цілком розчинними в аустеніті і надлишковими.
Основні типи інтерметалідних фаз.
1. Фази з гексагональними або ромбічними ґратами типу (Fе,Со)7(W,Мо)6 - у сталях високої теплопровідності, легованих кобальтом, вольфрамом і молібденом (наприклад, У11М7Д023, У4М12Д023). Поводження інтерметалідів подібно карбідам у сталях з карбідним зміцненням.
Після загартування і високої відпустки інтерметаліди виділяються з аустеніту. Твердість зростає до 68-69НRС, теплостійкість - до 720°С.
2. Електронні з'єднання або фази Юм-Розері. Мають ОЦК, ГЦК або ГПУ грати. Структура фаз визначається електронною конфігурацією, тобто співвідношенням числа валентних електронів до числа атомів в осередку.
При відношенні числа валентних електронів до числа атомів рівному 3/2 утворяться β -фази з ОЦК ґратами.
Приклад: алюмініди FеАІ, СоАІ, NiА1.
β-фази мають високу жароміцність і стійкістю проти окислювання і газової корозії. Використовуються у виді матеріалів і покрить у космічній техніці.
3. Так називані σ-фази: мають тетрагональну або складну ромбоедрічну ґрати. Не мають постійного стехіометричного складу.
Виявлені в Fе-Сг сплавах як крихка складова. Приводять до окрихчування сталей і сплавів після витримки при 500-900°С. В інструментальних сталях з низьким змістом вуглецю можуть бути присутнім у виді Fе3W2 або Fe3Мo2. Кількість їх незначна.
4.Фази типу (Ni,Fе)3Ті або (Ni,Ре,Сг)3(Ті,А1). Спостерігаються в аустенітних сплавах. Ґрати - ГЦК (у') або ОЦТ (у").
Завдяки когерентному зв'язкові з ґратами основного розчину і високій температурній стабільності і пластичності є сприятливими, тому що зміцнюють сплав без окрихчування. Зміцнення стабільне до високих температур.
Часто ці інтерметаліди називають геометрично щільнопакунковими фазами.
5. Фази Лавеса (наприклад, (Fе,Ni,Со)2Мо) мають кубічні або гексагональні ґрати.
Утворення фаз Лавеса приводить до незначного окрихчування сталі, однако воно менш небезпечно, чим виділення о-фази, особливо при підвищених температурах.
Виділення фаз Лавеса використовують у теплостійких і жароміцних сплавах для зміцнення при одночасному збереженні в'язкості.
Інтерметаліди відрізняються від карбідів наступним:
- вони утворюються при кристалізації без евтектичного перетворення, тому розподілені по тілу зерна значно равномірніше, чим карбіди;
- інтерметаліди дисперсні (5-20 нм) при відстані між частками до 100 нм;
- завдяки однорідному розподілові часток, окрихчуючий вплив інтерметалідів нижче, ніж карбідів;
- температура розчинення при нагріванні в інтерметалідів вище, ніж у карбідів (1200-1300°С).
Загальне в інтерметалідів і карбідів:
- і ті й інші досить ефективно стримують ріст зерна аустеніту при нагріванні;
- при відпустці (старінні) вони виділяються з пересиченого твердого розчину, викликаючи дисперсійне твердіння.
Температура дисперсійного твердіння залежить від складу металевої основи і типу інтерметалідів що виділяються: для сталей з мартенситною основою - 500-550°С (А3В) і 580-650°С (А7В6), для сталей з аустенітною основою - 750-800°С.
