
1.Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Например для реакции
![]() скорость
можно выразить так:
скорость
можно выразить так:
![]()
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Действия масс закон — устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии. Закон Действия масс установлен в 1864—1867 гг. К. Гульдбергом и П. Вааге. Согласно Закону Действия масс скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Закон Действия масс широко используется при различных расчетах химических процессов. Он позволяет решить вопрос, в каком направлении возможно самопроизвольное течение рассматриваемой реакции при заданном соотношении концентраций реагирующих веществ, какой выход нужного продукта может быть получен.
2.
Скорость
химической реакции - это величина,
показывающая как изменяются концентрации
исходных веществ или продуктов реакции
за единицу времени. Химические
реакции, протекающие в гомогенных
системах (смеси газов, жидкие растворы),
осуществляется за счет соударения
частиц. Однако, не всякое столкновение
частиц реагентов ведет к образованию
продуктов. Только частицы, обладающие
повышенной энергией - активные
частицы, способны
осуществить акт химической реакции. С
повышением температуры увеличивается
кинетическая энергия частиц и число
активных частиц возрастает, следовательно,
химические реакции при высоких
температурах протекают быстрее, чем
при низких температурах. Зависимость
скорости реакции от температуры
определяется правилом Вант - Гоффа :
Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
3. Энергия активации в элементарных реакциях, минимальная энергия реагентов (атомов, молекул и других частиц), достаточная для того, чтобы они вступили в хим. реакцию, т. е. для преодоления барьера на поверхности потенциальной энергии, отделяющего реагенты от продуктов реакции.
Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени. Например, металлы магний и железо реагируют с соляной кислотой одинаковой концентрации с различной скоростью. Это связано с разной химической активностью металлов.
4.Катализ-изменение скорости реакций под действием катализатора. Катализ бывает гомогенный и гетерогенный.
Гомогенный катализ, ускорение химической реакции в присутствии катализатора, который находится в одной фазе с исходными реагентами (субстратами) в газовой фазе или растворе. При гомогенном катализе, как и при гетерогенном, катализатор в реакции не расходуется, однако является ее необходимым участником; без катализатора реакция протекает гораздо медленнее или не идет вовсе. |
ГЕТЕРОГЕННЫЙ КАТАЛИЗ (контактный катализ), изменение скорости хим. реакции при воздействии катализаторов, образующих самостоят. фазу и отделенных от реагирующих веществ границей раздела. наиб. распространен случай, когда твердый кат. (контакт) ускоряет реакцию между газообразными реагентами или реакцию в растворе. Каталитич. реакция протекает обычно на пов-сти твердого кат. и обусловлена активацией молекул реагентов при взаимод. с пов-стью. Поэтому для осуществления гетерогенный катализ необходима адсорбция компонентов реакц. смеси из объемной фазы на пов-сти катализатора. |
5. Обратимые и необратимые процессы, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым.
аА+вВ↔мМ+nN
Кинетическое условие равновесия:
→ ←
V = V
Скорость скорость
Прямой обратной
Константа равновесия химической реакции – это химическая величина равная отношению произведении равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях стехиометрических коэфицентов.
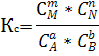
Закон действия масс для обратимой реакции.
![]()
![]()
Химическим равновесием – является динамическим, т.е. подвижным.Оно смещается в ту или иную сторону при изменение условий (параметров состояния).
6. Химическим равновесием – является динамическим, т.е. подвижным.Оно смещается в ту или иную сторону при изменение условий (параметров состояния).
Если V < V влево смещение равновесия
V > V вправо
Принцип Ле Шателье.
Если не систему находящеюся в равновесии оказать внешнее воздействие, то равновесие смещается в том направление которое ославлено эфеткмом внешнего воздействия .
1.При повышение t равновесие экзотермической реакции смещается влево, а эндотермическое вправо.
2.При повышение конденсации одного из исходных веществ равновесие смещается вправо, а при повышение концентрации одно из продуктов реакции соответственно влево.
3.При
повышение давления равновесие смещается
в сторону образования меньшего кол-ва
молей газообразного вещества, при
уменьшении давления в сторону большего
количества молей. ∆![]() -константа
равновесия
-константа
равновесия
7. Химическая термодинамика - изучает превращение энергии при химических реакциях.
1.Т.е переход энергии из одной формы в другую. От одной части системы к другой.
2.Энергитические эффекты сопровождаются химическими реакциями.
3.Возможность, направления, и примеры самопроизвольного течения процессов в данных условиях.
Внутренней энергией U называется энергия системы, зависящая только от ее термодинамического состоянии. Для системы, нe подверженной действию внешних сил и находящейся в состоянии макроскопического покоя, внутренняя энергия представляет собой полную энергию системы. В некоторых простейших случаях внутренняя энергия равна разности между полной энергией W системы и суммой кинетической энергии WK ее макроскопического движения и потенциальной энергии Wп, обусловленной действием на систему внешних силовых полей: U = W - (Wk + Wп).
Энтальпией H (теплосодержанием, тепловой функцией) называется функция состояния термодинамической системы, равная сумме ее внутренней энергии и произведения давления на объем системы, выраженного в тех же единицах:
H = U + pV Энтальпия идеального газа зависит только от его абсолютной температуры и пропорциональна массе газа.
8.Первый закон термодинамики. В любой изолированной системе общий запас энергии сохранение тел постоянным.
Функции:внутренняя энергия. Это общий её закон включающий энергию движения молекул колебаний атом движения электронов внутриядерную энергия. Теплота и работа характеризует две разные формы. Передали энергию от одного тела к другому.
Q-явл. мерой энергии переданной от одного тела к другому, за счёт разницы температуры, связанные с хаотическим движением молекул.
А-явл. Мерой энергии переданной от одного тела к другому за счёт перемещения масс под действием каких либо сил.
Q=∆U+A
Тепловой эффект хим. Реакции. Называется кол во теплоты которое выделяется или поглощается при необратимом протекании реакции, когда единственным видом работы явл. Расширение. 1.P=const, T=const Qp=∆H=H2-H1
2. T=const, V=const Qv=∆U=U2-U1
Закон Гесса. Тепловой эффект хим реакции зависит только от начального и конечного состояния вещества. И не зависит от промежуточных стадий процесса.
Следствие из законна Гесса.(Тепловой эффект хим реакции = разности сумм энтальпий образований продуктов образования и энтальпий образования исходных веществ с учётом стехиометрических коэффициентов).
9. Второй закон термодинамики. Все процессы условно делятся на две группы.
1.Процессы для совершения которых требуется затратить энергию из вне, кол во прямопропорционально произведенному изменению.
2. Процессы которые могут протекать самостоятельно.
Второй закон термодинамики опр: какие из процессов при заданной t,P и концентрации, могут протекать самопроизвольно, какое кол во работы может быть получено и каков предел самопроизвольного протекания процессов.
Самопроизвольные и несамопроизвольные процессы подразделяются на термодинамически обратимые и необратимые. Равновесные состояния системы могут изучаться на основе принципа существования энтропии. Он утверждает, что существует функция состояния системы - энтропия, изменение которой в равновесных процессах происходит только под действием энергии в форме теплоты. Равновесные процессы в природе и технике никогда не встречаются и представляют собой предельное состояние процесса.
Энтропи́я (от др.-греч. ἐντροπία «поворот», «превращение») в естественных науках — мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит и количество информации; в исторической науке, дляэкспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной приобратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]() ,
,
где dS — приращение энтропии; δQ — минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
10. Второй закон термодинамики. Все процессы условно делятся на две группы.1.Процессы для совершения которых требуется затратить энергию из вне, кол во прямопропорционально произведенному изменению.2. Процессы которые могут протекать самостоятельно.
Второй закон термодинамики опр: какие из процессов при заданной t,P и концентрации, могут протекать самопроизвольно, какое кол во работы может быть получено и каков предел самопроизвольного протекания процессов. Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; это термодинамический потенциал следующего вида:
![]()
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
